小鼠局灶性脑缺血模型行为学指标相关性研究
2012-12-06刘家兰邓礼娟原欢欢徐晓玉
刘家兰,邓礼娟,原欢欢,王 琴,徐晓玉
(西南大学药学院,重庆市药效评价工程技术研究中心,重庆 400715)
大脑中动脉是临床上缺血性脑血管病的易患部位,血管闭塞造成局部脑血流循环障碍[1]。局灶脑缺血模型是目前研究脑缺血疾病的经典模型,其成功率高,梗死范围稳定,损伤小,大鼠或者小鼠造模均可,线栓法虽然死亡率高,却是更适合于长期对脑缺血疾病研究的模型[2]。课题组长期致力于中药新药对脑缺血疾病的研究,曾建立过对局灶脑缺血大鼠前肢功能评价的一种新方法[3]。本文对药效学研究的一种实验方法进行评价。国内外已有大量关于线栓法致小鼠局灶脑缺血模型的构建方法,其损伤程度的评价指标移植于大鼠评价体系,但大鼠与小鼠在身体机能方面有很大差异,评价指标是否客观合理有待验证。Bederson等[4]研究认为神经系统体征评分与脑梗死体积明显相关,Shen等[5]发现术后自发活动与脑梗死体积明显相关。本文选取了国内外常用的神经功能评价方法,以经典的Longa等[6]五分法和脑梗死面积百分比为参照,考察线栓法小鼠局灶永久性脑缺血模型行为学指标间的相关性。以疗效确切的血管扩张剂葛根素[7],自由基清除剂依达拉奉[8]治疗模型小鼠,观察所选指标能否用于评价药物对该模型的治疗作用。
1 材料与方法
1.1 实验动物 SPF级健康KM小鼠150只,体质量25~30 g,由重庆医科大学实验动物中心提供[许可证号:SCXK(渝)2007-0001],实验动物使用许可证:SYXK(渝)2009-0002,环境适应1周。
1.2 药品与试剂 葛根素(纯度≥98%,四川玉鑫药业有限公司,批号:090602);依达拉奉注射液(吉林省辉南长龙生化药业股份有限公司,批号:2010050201);水合氯醛(国药集团化学试剂有限公司),2,3,5氯化三苯基四氮唑(北京鼎国生物技术有限公司)。
1.3 脑缺血模型的建立 小鼠适应喂养1周后用于模型制备。术前禁食不禁水12 h,3.5%水合氯醛(35 mg/10 g)ip麻醉;颈部正中切口,剥离并暴露颈动脉三角;分离出左侧颈总动脉、颈内动脉及颈外动脉;用电凝器尖端凝断颈外动脉,在其根部扎口,将线栓(直径0.10 mm)插入颈内动脉,当栓线标记(离头端1 cm)在颈总动脉分叉处,略微感到阻力时停止插入,固定栓线,缝合皮肤。假手术组不插入线栓,其余处理同上,造模后3 h进行首次神经功能评分,弃掉因失血过多,造模时间超过15 min者。
1.4 动物分组 实验一:小鼠70只,♀♂各半,10只假手术组,60只用于模型的制备,造模成功的31只用于神经功能评分指标的观察。实验二:小鼠80只,♂,用于葛根素和依达拉奉对脑缺血模型的改善效果观察,将模型成功的63只小鼠随机分为模型组、葛根素组和依达拉奉组,每组21只;剔除造模后d 1~8死亡且无脑缺血病理改变的小鼠,最终用于神经功能行为学评分的动物为假手术组10只,模型组10只,葛根素组12只,依达拉奉组12只;术后3 h第1次尾iv给药,每天1次,连续7 d,假手术组和模型组尾静脉注射同等体积的生理盐水。
1.5 神经功能行为学测试 神经行为学评分:参照Longa等[6]五分法,术后 d 1、d 4 和 d 7 对小鼠进行评分。即0分,无神经损害症状;1.0分,不能完全伸展损伤对侧前肢;2.0分,屈曲姿势,旋转运动;3.0分,行走时向对侧倾倒;4.0分,不能自发行走,痉挛、昏睡,意识丧失。
神经综合功能评分:参照Petullo等[9]的行为学评价标准。术前3 d对小鼠进行训练,包括3个方面:神经肌肉功能、前庭运动功能和综合神经运动功能,总分20,分数越高,代表缺血性脑损伤越严重。
转角试验[10]:将小鼠放在两块30 cm×20 cm×1 cm的木板间,两木板呈30°角,两板之间有一小缝鼓励小鼠进入这个转角,将小鼠面朝转角放置于去转角的半路上,当小鼠走进转角时,两边的触须会碰到木板,此时小鼠会向前或向上移,最后会向左或向右转回。脑缺血小鼠会优先向非损伤侧转回,每次实验重复10次,记录下向右的次数。
爬板试验[11]:将小鼠放于一包有铜丝网25 cm×20 cm(孔径0.2 mm)的有机玻板上,先保持平板于水平位置,后逐渐竖起平板,直至小鼠不能攀爬而从平板上落下,记录该时平板轴线与水平面之间的角度(Holding angle),每只小鼠重复3次,记平均值。即0 分,≥ 70°;1 分,≥ 65°~69°;2 分,≥ 60°~64.9°;3 分,≥ 55°~59.9°;4 分,<55°。
1.6 脑梗死灶体积测定 术后d 8,神经功能评分后,断头取大脑,-20℃冷冻8 min,取出沿视交叉冠状切成约2 mm厚的4个切片,浸入37℃ 2%TTC溶液中避光染色15 min,4%多聚甲醛固定1 d,滤纸吸干,用小镊子分开红色和白色脑组织,称重,计算脑梗死质量占全脑的百分比。
2 结果
2.1 术后症状及成功率 术后造模成功小鼠,表现为活动减少,左眼微闭,行动迟缓,呼吸窘迫,进食困难,腹泻,皮毛竖立,脑损伤对侧前肢卷曲,呈追尾状转圈等症状,从d 1~8体重不断下降;假手术组仅左眼微闭,无神经功能缺损症状,体重变化较小(Fig 1)。实验一中,60只造模小鼠,8只术后无神经功能缺损症状,2只蛛网膜下腔出血,手术成功50只,成功率约为83.3%;实验二中70只造模小鼠,7只术后无神经功能缺损症状,4只蛛网膜下腔出血,手术成功59只,成功率为84.3%。

Fig 1 Weight of mouse after operation
2.2 术后死亡率 实验一中50只造模成功小鼠,从d 1~8,总共死亡19只,用于观察31只,死亡率38%;实验二中59只造模成功小鼠,从d 1~8,死亡25只,死亡率为42.3%。
2.3 神经功能指标的相关性 对术后小鼠d 1、d 4和d 7进行评分(Tab 1)。神经行为学与其他指标在d 1、d 4和d 7中的相关性存在差异。结果显示,神经行为学与神经综合功能评分、爬板试验和转角试验在术后d 1相关性最强,d 4神经行为学与神经综合功能仍相关,与其他指标无相关性(Tab 2)。
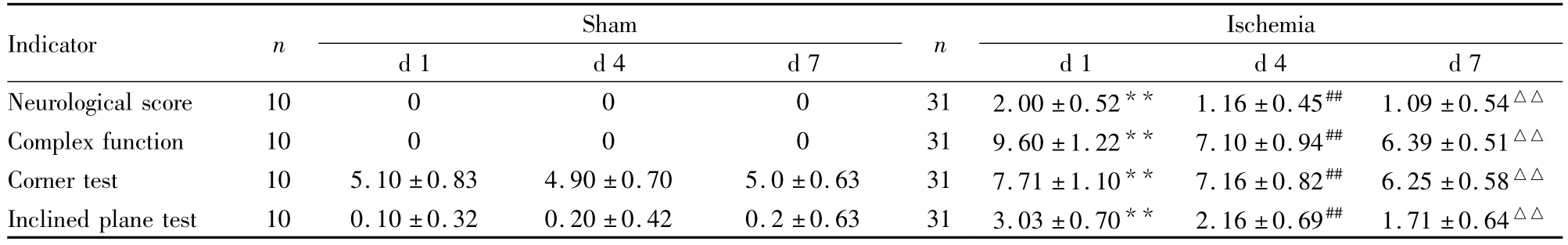
Tab 1 Neurological function scores of sham and ischemia mice
2.4 脑梗死百分比与神经功能指标相关性 将脑梗死百分比与脑缺血术后d 7的神经功能指标评分进行相关性分析。结果显示,脑梗死百分比的大小与神经行为学、神经综合功能评分和爬板试验均相关,与转角试验相关性差异无显著性(Tab 3、Fig 2)。
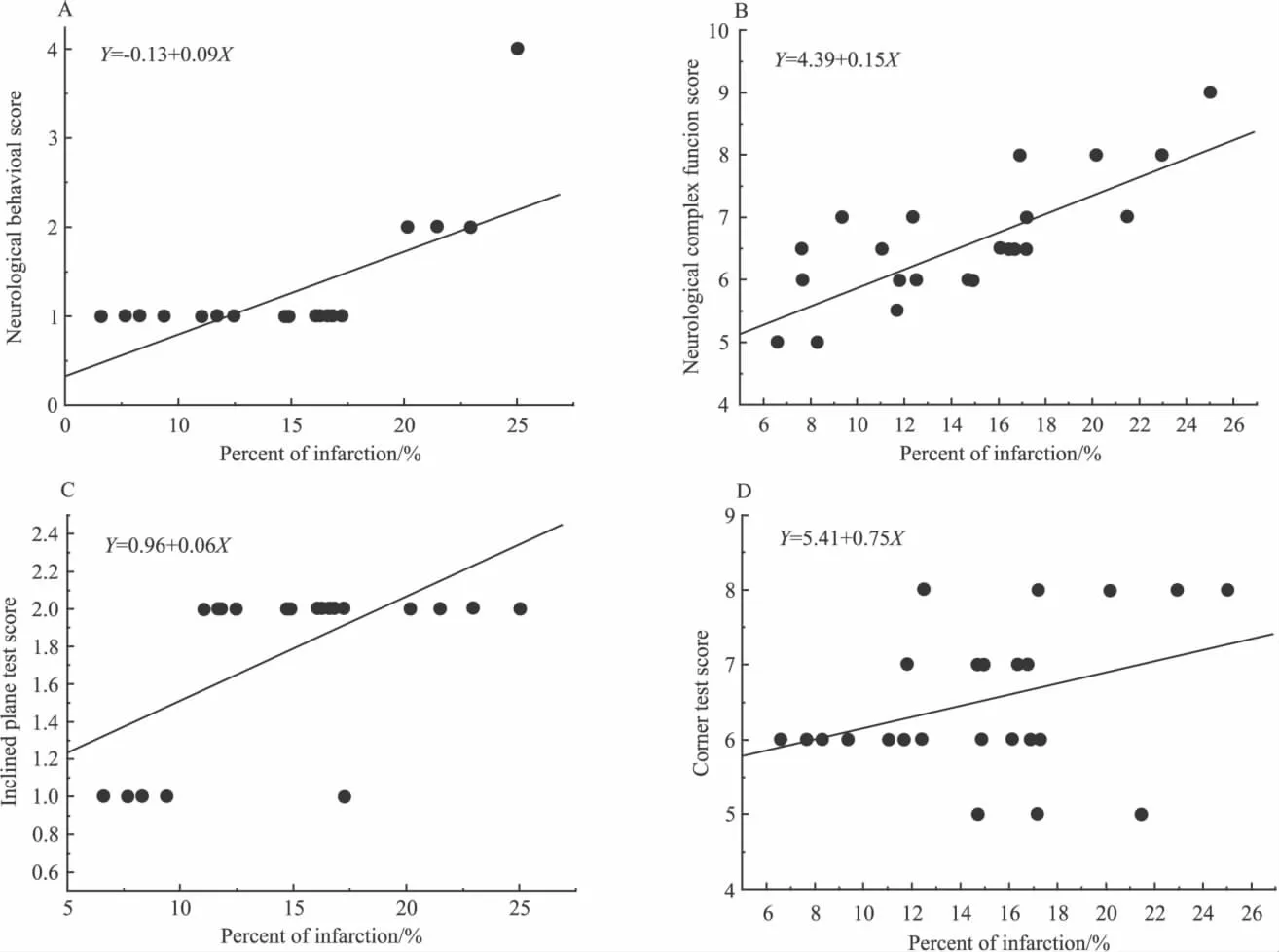
Fig 2 Correlation between infarction percentage and neurological function indicators
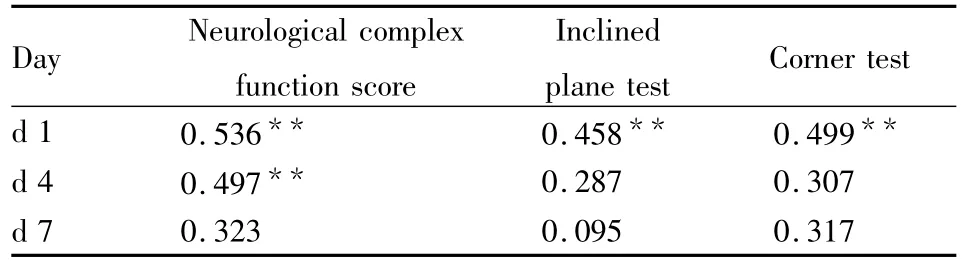
Tab 2 Correlation efficient between neurologicalbehavioral score and neurological function indicators(n=31)
2.5 药物对脑损伤小鼠的作用 根据以上神经功能指标的探讨,我们选取了神经行为学、神经综合功能和爬板试验观察药物对脑缺血小鼠的作用。术后d 1~8陆续有动物死亡,将最终存活下来并具脑缺血病理特征的小鼠进行统计。结果显示,葛根素与依达拉奉组在术后d 4和d 7脑损伤程度有明显的改善(Tab 4)。TTC染色显示梗死区为白色,正常区域为红色,假手术组均呈红色。模型组梗死区域较大,占据大脑皮层及海马区;与模型组相比,葛根素组和依达拉奉组梗死面积百分比减小(Tab 5、Fig 3)。

Tab 3 Correlation efficient between infarction percentage and neurological function indicators(n=26)
3 讨论
3.1 模型制备的成功要素 小鼠品系:不同小鼠品系造成的损伤程度不同,品系间的梗死体积不同主要是由大脑Willis环的解剖差异所致。昆明种小鼠不如BALB/c小鼠对脑缺血敏感,但梗死体积稳定,且不易死亡[12]。

Fig 3 Brain TTC staining of mice
Tab 4Effects of drug group on neurological function behavioral score(±s)
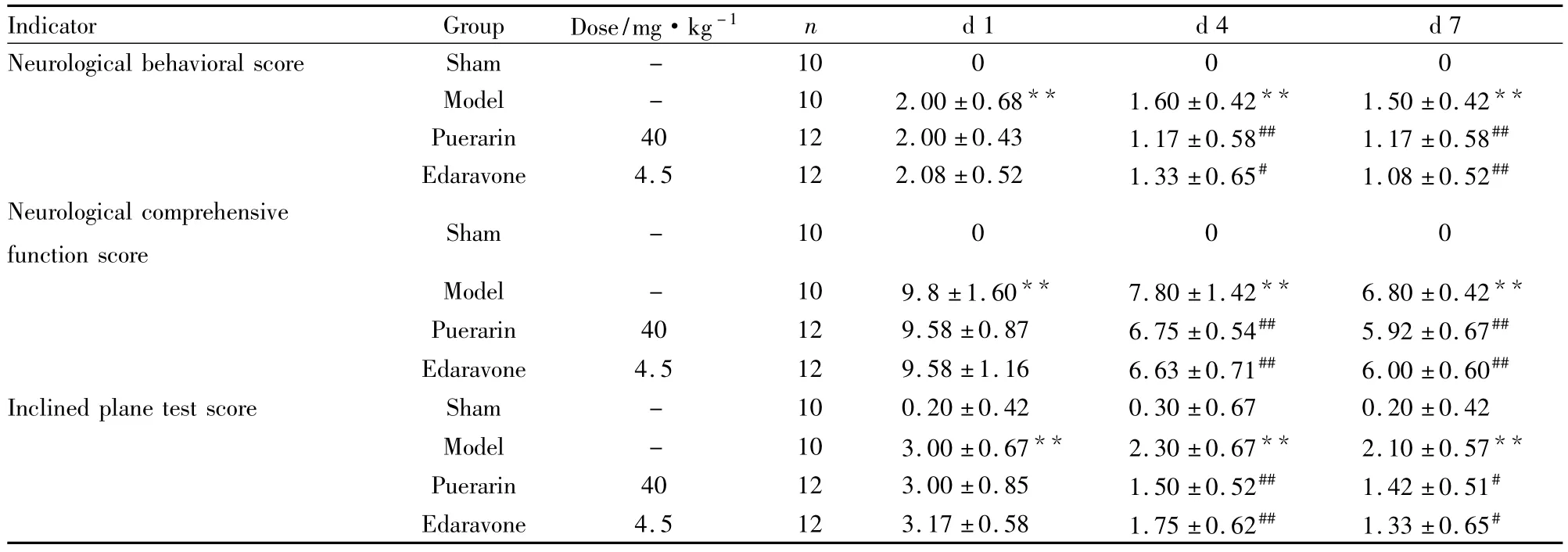
Tab 4Effects of drug group on neurological function behavioral score(±s)
**P<0.01 vs sham group;#P<0.05,##P<0.01 vs model group
Indicator Group Dose/mg·kg-1 n d 1 d 4 d 7 Neurological behavioral scoreSham-100 0 0 Model - 10 2.00 ±0.68** 1.60 ±0.42** 1.50 ±0.42**Puerarin 40 12 2.00 ±0.43 1.17 ±0.58## 1.17 ±0.58##Edaravone 4.5 12 2.08 ±0.52 1.33 ±0.65# 1.08 ±0.52##Neurological comprehensive function score Sham-100 0 0 Model - 10 9.8 ±1.60** 7.80 ±1.42** 6.80 ±0.42**Puerarin 40 12 9.58 ±0.87 6.75 ±0.54## 5.92 ±0.67##Edaravone 4.5 12 9.58 ±1.16 6.63 ±0.71## 6.00 ±0.60##Inclined plane test score Sham - 10 0.20 ±0.42 0.30 ±0.67 0.20 ±0.42 Model - 10 3.00 ±0.67** 2.30 ±0.67** 2.10 ±0.57**Puerarin 40 12 3.00 ±0.85 1.50 ±0.52## 1.42 ±0.51#Edaravone 4.5 12 3.17 ±0.58 1.75 ±0.62## 1.33 ±0.65#
Tab 5Effect of drug on infarction size percentage(±s)
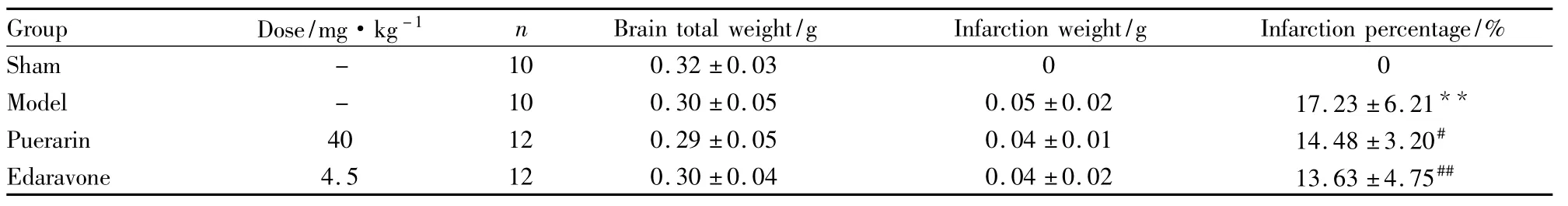
Tab 5Effect of drug on infarction size percentage(±s)
**P <0.01 vs sham group;#P <0.05,##P <0.01 vs model group
Group Dose/mg·kg-1 n Brain total weight/g Infarction weight/g Inf arction percentage/%Sham - 10 0.32 ±0.03 0 0 Model - 10 0.30 ±0.05 0.05 ±0.02 17.23 ±6.21**Puerarin 40 12 0.29 ±0.05 0.04 ±0.01 14.48 ±3.20#Edaravone 4.5 12 0.30 ±0.04 0.04 ±0.02 13.63 ±4.75##
体重和性别:小鼠个体的大小对手术损伤的耐受力和模型成功与否有一定影响。选取体重为26~30 g小鼠,大小适中,制得的模型均一。术后小鼠存活率与性别也有很大关系,♂的耐受性较♀好,存活时间更长。
操作过程:造模过程中,尽量避免损伤血管周围组织和迷走神经。可用小号针头在插线端血管扎一小口,插入线栓时要调整好进线方向,轻柔慢进,如在10~11 mm的位置遇到阻力,证明线栓进入位置正确,若没有,退出线栓调整方向再进。可不用动脉夹,在ICA近脑端用缝合线栓个活结,线栓插入后用镊子轻轻拉开活结即可,插入深度不易超过12 mm。
麻醉剂:麻醉剂对模型的成功影响较大,国内常用水合氯醛,易引起呼吸道堵塞。造模过程中,如果遇到呼吸抑制的小鼠,可用小直镊夹取少许棉花伸入气管中,取出黏液,同时节律性地压迫心脏,小鼠可快速恢复正常呼吸,减少死亡率。
3.2 模型中指标的选择 在脑缺血疾病的观察中,如何选取能真实反映疾病程度的指标相当重要。神经功能行为学指标对慢性脑缺血疾病的研究具有重要作用。实验表明,线栓法制备的小鼠局灶永久性脑缺血模型死亡率较高,脑梗死体积恒定,神经功能障碍明显。Longa评分与实验中所选指标在短期内相关性强,相关程度随时间而降低;脑梗死百分率与多数指标呈正相关。葛根素、依达拉奉能明显降低局灶性脑缺血损伤,表明可通过行为学指标分值预测脑梗死程度。在行为学指标的定量检测中,不同指标反映不同的功能,神经行为学主要反映前肢功能和偏瘫症状,不需借助任何设备,是最为经典简单易行的评价方法,分值设置少间距大,对局灶脑缺血损伤的药效观察敏感性较差,可以考虑增加分值数,缩短间距;神经综合功能反映了肌肉运动功能、前庭运动功能和平衡综合能力,与梗死质量百分比的相关性最强,对脑缺血疾病的药效观察敏感性较高,是较为理想的行为学评价方法,但评价过程较复杂;爬板试验反映协调和平衡能力,与梗死体积的相关性较强,稳定且操作简单,可用于脑缺血疾病的药效观察;转角试验用于测定前脑和纹状体的损伤程度,与梗死质量百分比无相关性,用于药效的观察可能需加大样本量以减少个体差异。为降低观察者主观因素和个体差异的影响,药物对脑缺血损伤的评价,建议加大样本量和多指标综合评价。国内外关于小鼠神经功能行为学指标较多,如:烟囱试验[13]、旋转试验[14]、梯子试验[15]、圆柱体试验[16]、悬挂试验、水谜宫、肌力测试等,分别从脑损伤引起的肌肉、平衡、运动、记忆和认知功能障碍进行评价,对急性脑缺血和长期神经功能修复进行观察,但是否可用于对小鼠永久局灶性脑缺血模型的评定尚需进一步实验。
3.3 模型的不足 本实验是将大鼠的线栓法局灶脑缺血模型制备移植于小鼠身上。此模型中需凝断颈外动脉,虽然对神经功能缺损的观察并无影响,但与临床的脑缺血病理模型有差距,有待进一步改进。
[1]纪风涛,曹铭辉,梁建军,等.姜黄素预处理对大鼠脑缺血/再灌注损伤后AQP-4及脑水肿的影响[J].中国药理学通报,2011,27(4):524-7.
[1]Ji F T,Cao M H,Liang J J,et al.Effects of chemical synthesized curcumin preconditioning on the expression of AQP-4 and cerebral edema after focal cerebral ischemia/reperfusion damage in rats[J].Chin Pharmacol Bull,2011,27(4):524-7.
[2]Agulla J,Argibay B,Perez-Mato M,et al.Comparison of the lesion produced by permanent focal cerebral ischemia in three animal models using magnetic resonance imaging[J].Rev Neurol,2011,53(5):265-74.
[3]周佳丽,祝慧凤,万 东,等.“抓取测试盒”对局灶脑缺血大鼠前肢功能的评价[J].中国药理学通报,2008,24(11):1531-3.
[3]Zhou J L,Zhu H F,Wan D,et al.Evaluation of“Grasping test box”on the forelimb function of focal cerebral ischemia rats[J].Chin Pharmacol Bull,2008,24(11):1531-3.
[4]Bederson J B,Pitts L H,Daves R L,et al.Rat middle cerebral artery occlusion:Evaluation of the model and development of a neurologic examination[J].Stroke,1986,17(3):472-6.
[5]Shen H,Wang Y.Correlation of locomotor activity and brain infarction in rats with transient focal ischemia[J].J Neurosci Meth,2010,186(2):150-4.
[6]Long E Z,Weinstein P R,Carlson S,Cummins R.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[7]何正光,陈 刚,祝慧凤,等.葛根素注射液对大鼠脑缺血/再灌注损伤的保护作用[J].中国药理学通报,2011,27(8):1181-2.
[7]He Z G,Chen G,Zhu H F,et al.Protective effects of Puerarin on focal cerebral ischemia-reperfusion injury in rats[J].Chin Pharmacol Bull,2011,27(8):1181-2.
[8]胡海涛,吴继敏,王 爽.依达拉奉对大鼠局灶性脑缺血的保护作用[J].中国药学杂志,2005,40(19):1463-5.
[8]Hu H T,Wu J M,Wang S.Neuroprotective effect of Edaravone on focal cerebral ischemia in rats[J].Chin Pharm J,2005,40(19):1463-5.
[9]Petullo D,Masonic K,Lincoln C,et al.Model development and behavioral assessment of focal cerebral ischemia in rats[J].Life Sci,1999,64(13):1099-108.
[10]Zhang L,Schallert T,Zhang Z G,et al.A test for detecting longterm sensorimotor dysfunction in the mouse after focal cerebral ischemia[J].Neurosci Meth,2002,117(2):207-14.
[11]魏尔清,朱朝阳,徐秋琴,等.一种改进的小鼠局灶性脑缺血神经症状定量评价方法[J].生理学报,2003,55(6):742-7.
[11]Wei E Q,Zhu C Y,Xu Q Q,et al.An improved quantitative method for evaluation neurological deficits in mice with focal cerebral ischemia[J].Acta Pysiol Sin,2003,55(6):742-7.
[12]王芙蓉,姜永生,肖文伍,张苏明.颈内动脉线栓法建立小鼠局灶性脑缺血再灌注模型[J].中风与神经疾病,2003,10(2):112-4.
[12]Wang H R,Jiang Y S,Xiao W M,Zhang S M.Establishment of focal cerebral ischemia-reperfusion model from carotid artery with suture method in mice[J].Stroke Nervous Dis,2003,10(2):112-4.
[13]Heinecke H.A comparison of two variants of the chimney behaviour test in mice[J].Z Versuc Chstierkd,1987,29(3-4):145-8.
[14]Rogers D C,Campbell C A,Stretton J L,Mackay K B.Correlation between motor impairment and infarct volume after permanent and transient middle cerebral artery occlusion in the rat[J].Stroke,1997,28(10):2060-5.
[15]Baird A L,Meldrum A,Dunnett S B.The staircase test of skilled reaching in mice[J].Brain Res Bull,2001,54(2):243-50.
[16]Schallert T,Fleming S M,Leasure J L,et al.CNS plasticity and assessment of forelimb sensorimotor outcome in unilateral rat models of stroke,cortical ablation,parkinsonism and spinal cord injury[J].Neuropharmacology,2000,39(5):777-87.
