精子质量综合评估指标的建立*
2012-12-04赵洪鑫武俊青吴晓芸施惠娟
赵洪鑫 王 会 武俊青 袁 瑶 吴晓芸 施惠娟△
常规精液检查是评估男性生育力的重要手段,主要包括精液量、pH值、精子密度、动力学参数、形态学参数等指标〔1〕。每个独立的精液检测指标都不能全面地评价男性的生育力状况,临床上往往综合参考多个指标。但指标太多对临床医生的诊断增加了困难。为简化临床诊断,武俊青等〔2〕曾对精液检查的结果进行主成分分析来综合评价精液质量。但仅依靠常规精液检查仍难以有效指导男性不育的诊断,更不足以在辅助生殖技术中准确评估精子功能,因此需要更多更好的精子功能检测来系统评估男性生育力〔3〕。研究表明,用荧光复合染色法检测存活精子率(live/dead sperm viability)能够评估精子质膜完整性〔4〕。与伊红染色,精子低渗肿胀实验(hypo-osmotic swelling test,HOST)相比,荧光复合染色法能更有效地反映精液中死活精子的比例,在辅助生殖技术的实验室诊断中更有应用价值。精液中的活性氧(reactive oxygen species,ROS)主要由精液中的白细胞和畸形精子产生,与精子DNA损伤密切相关,是一个能够反映精子受精能力的独立指标〔5〕。本实验室用荧光染色法对临床精液标本进行了精子质膜完整性的检测〔6〕,并首次报告了用化学发光法检测的中国男性不育人群精液ROS水平〔7〕。在前期大样本研究的基础上,本文拟对精液样本的检测结果进行主成分分析和多变量线性组合,探讨建立精子质量综合评价指标的可行性。
资料与方法
1.研究对象
273名2007年因不育症在上海计生所医院进行精液检查的男性,纳入标准:同居两年以上未避孕,性生活正常而未育。排除标准:临床诊断为女性因素导致的不育;无精子症;精液不液化。同期纳入35名已婚育的志愿者。纳入标准:已育男性。排除标准:最近一次生育时间超过5年。作为建立综合指标的数据来源。
另选取100名2009年因不育症在上海计生所医院进行精液检查的男性。同期纳入30名已育志愿者。纳入标准同上。用以对建立的综合指标进行预测评估分析。
2.常规精液检查
根据WHO标准〔8〕收集精液。待精液完全液化后使用CASA系统(Cyto-S;Alpha Innotech Corp)检测以下指标:
(1)精子密度(×106/mL)
(2)活动率(活动精子百分比)
(3)曲线速率(curvilinear velocity,VCL;μm/s)
(4)直线速率(straight-line velocity,VSL;μm/s)
(5)平均路径速率(average path velocity,VAP;μm/s)
(6)直线性(linearity,LIN;%)
(7)头部摇摆频率(amplitude of lateral head displacement,ALH;μm)
3.精子形态学检查
根据WHO标准〔8〕,采用Diff-Quik染色法评价精子形态学指标。计算正常形态精子率(sperm morphology)。
4.用荧光复染法检测精子质膜完整性
用Live/Dead Sperm Viability Kit(L-7011;Invitrogen)检测精子质膜完整性,计算存活精子率(viability):

5.用化学发光法检测精液ROS水平
将400 μL完全液化后的精液加入一次性照度计容器内。取4 μL鲁米诺储存液(25 μM于二甲亚砜),同时加入8 μL辣根过氧化物酶(12.4 U的Ⅵ型辣根过氧化物酶,310 U/mg)。使用Berthold照度计检测化学发光信号约5 min,直至其达到稳定。发光信号测量单位为相对化学发光强度(RLU/s)。
6.统计分析方法
精液各指标检测结果采用描述性统计分析,两组间的比较用Wilcoxon秩和检验;指标之间的关系采用Spearman相关分析;对精液主要指标进行主成分分析;在各精液指标和ROS水平值中设定不同的分界点以预测男性不育,绘制受试者工作特征曲线(receive operating characteristic curve,ROC),计算曲线下面积并进行分析。统计分析采用SAS 9.2软件包;ROC曲线的绘制和分析采用Medcalc 9.6软件。
结 果
1.一般情况和精液检查结果
2007年的不育患者年龄为(30.97±5.13)岁,不育年限为(4.31±2.77)年。已育志愿者,年龄为(33.15±4.46)岁。精液检测结果见表1,由于各指标均不呈正态分布,因此用中位数、25和75百分位数描述。
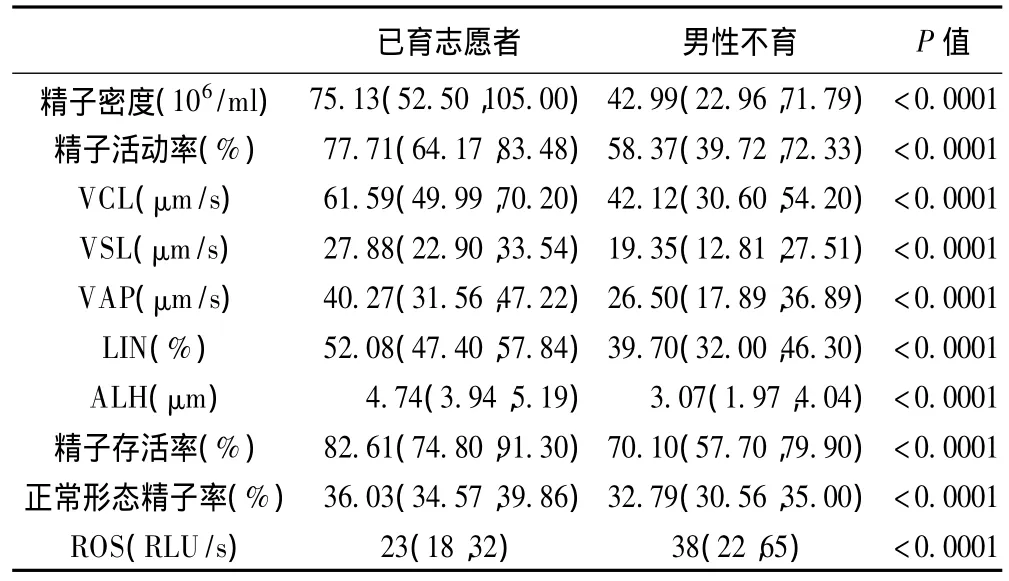
表1 已育志愿者和不育患者精液主要指标检测结果(Median(P25,P75))
2.精液参数之间的相互关系
对273例不育男性的精液参数进行Spearman等级相关分析,除ROS外的其他精液参数之间均呈正相关,精子动力学参数之间(活动精子率、VCL、VSL、VAP、LIN、ALH)有较强的正相关。精子密度和精子动力学参数、形态学参数呈中等程度的正相关。而存活精子率与活动精子率仅有中等程度的正相关。ROS除与精子形态有较弱的负相关外,与其他精液参数均无显著相关性,结果见表2。

表2 重要精液指标spearman相关系数矩阵
3.主成分分析结果
由于ROS与其余的精液参数无显著相关,是一个相对独立的指标,因此对其余9个指标进行主成分分析。
进行主成分分析之前需将原始变量进行标准化变换。本研究中有4个指标是百分率,因此采用对数转换的方法进行标化:将9个指标——精子密度、活动精子率、VCL、VSL、VAP、LIN、ALH、正常形态精子率、存活精子率加1后取以10为底的对数。标化的目的在于:减少过偏数值的影响;消除不同指标由于各自量纲不同带来的影响;减小由数量级差异带来的影响,如×106和 ×104。
各主成分的特征根、贡献率和累计贡献率见表3。

表3 主成分分析的结果
第一个主成分解释了总变异的71.46%,第二个主成分解释了总变异的9.49%。前2个主成分解释了超过80%的总变异,因此取前两个主成分就基本上反映了原资料的信息。
第一、第二主成分按照下式计算:
Prin1=0.259155×lg(精子密度+1)+0.369788×lg(活动精子率 +1)+0.387720×lg(VCL+1)+0.384482×lg(VSL+1)+0.391107×lg(VAP+1)+0.360037×lg(LIN+1)+0.373514×lg(ALH+1)+0.195413×lg(存活精子率+1)+0.194042×lg(正常形态精子率+1)
Prin2=-0.425385×lg(精子密度+1)-0.174125×lg(活动精子率 +1)-0.112581×lg(VCL+1)+0.029970×lg(VSL+1)-0.014354×lg(VAP+1)+0.162610×lg(LIN+1)-0.153000×lg(ALH+1)+0.805555×lg(存活详精率+1)+0.276007×lg(正常形态精子率+1)
由上式可知,第一主成分各分量的大小大致相当,说明第一主成分是一个综合指标,全部系数为正,因此第一主成分代表了精液的综合质量;第二主成分在活精子率上有较大的系数,在精子密度上系数也较大且为负,说明第二主成分高的精液其精子质膜完整性较高但密度较低,因此第二主成分代表了精子在体外存活的状态。因此,在临床预测自然受孕时第一主成分更有意义,而第二主成分可能在辅助生殖技术中有潜在应用价值。
为方便临床诊断,取第一主成分来评价精液综合质量,在已育志愿者中,Prin1的均值为4.6253513,标准差为0.2470433。对Prin1进行标准化处理并命名为精液质量得分(semen quality score,SQ),使已育志愿者组SQ的均值为100,标准差为10,即SQ>110为高质量精液,SQ<90为低质量精液,计算原理和方法与智商(IQ)类似:

4.多变量线性组合建立综合诊断指标
对于拥有CASA系统并能检测存活精子率的男科学实验室,可以采用SQ来评估男性生育能力,而有条件检测精液ROS水平的实验室,可以进一步用SQ和ROS两个指标联合预测男性不育。
下面以logistic回归为基础,采用多变量线性组合的方法〔9,10〕将SQ得分和ROS水平同时应用,建立联合预测因子。
以是否不育为应变量,SQ和lg(ROS+1)为自变量,拟合logistic回归模型,由于ROC资料中疾病状态为二项分布,logit连接函数参数是OR(odds ratio)的对数,较容易解释模型中参数变化的含义,故选用logit连接函数。
模型中各参数如表4所示。拟合结果用下式表示:

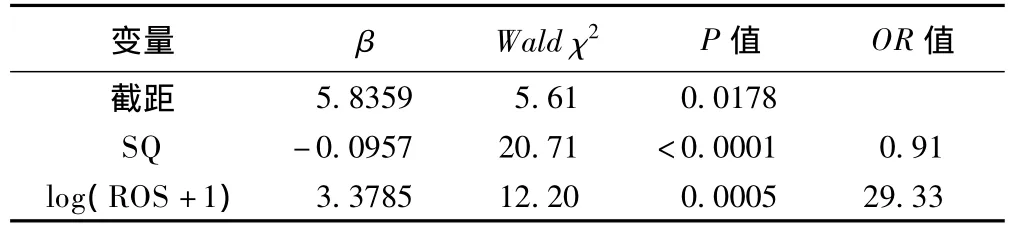
表4 logistic回归模型拟合结果(n=308)
对logistic回归方程进行变换得到预测因子Lβ(Y):
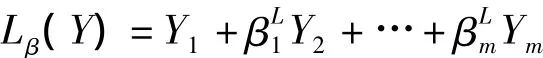
得到联合预测因子的表达式:

5.ROC曲线分析结果
在273例不育男性和35例已育志愿者中,根据上面得到的公式计算每份精液的SQ值和SQ+ROS联合诊断指标值,并比较传统的精液指标(精子密度、活动精子率、正常形态精子率)和SQ得分诊断男性不育的ROC曲线,如图1。而以SQ、ROS及SQ+ROS联合指标诊断不育的ROC曲线见图2。

图1 不同精液参数诊断男性不育的ROC曲线

图2 SQ和精液ROS水平诊断男性不育的ROC曲线
用各精液参数诊断男性不育的ROC曲线下面积(area under the curve,AUC)见表5。SQ的ROC曲线下面积大于其余所有单个指标。而SQ-ROS联合预测因子的ROC曲线下面积在所有指标中最大。

表5 不同精液参数诊断男性不育的ROC曲线下面积
6.最佳参考值的确定
在进行ROC曲线分析的过程中,计算各个指标取不同的临界点时诊断的灵敏度和特异度,计算约登指数(Youden index)最大时的临界点作为最佳参考值。各指标取最佳参考值时的灵敏度和特异度见表6。
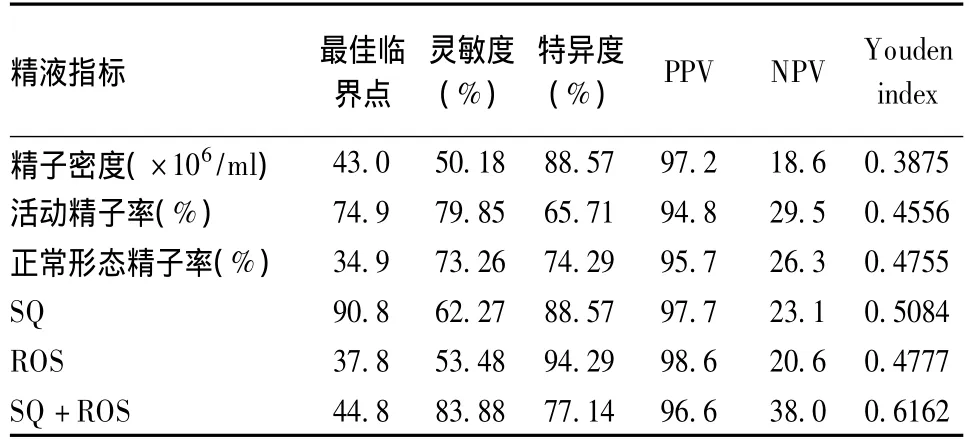
表6 各中精液指标的最佳参考值
7.用综合指标预测男性不育
利用新建立的精液综合指标对2009年收集的100例男性不育和30例已育志愿者进行模拟诊断,根据前面得到的最佳参考值及世界卫生组织推荐的参考值预测不育,并与实际结果相比较,计算其灵敏度和特异度。在使用世界卫生组织推荐的单个指标参考值时,特异度较高但灵敏度普遍偏低。而采用SQ+ROS综合指标时,灵敏度和特异度均较高,见表7。

表7 精液各指标预测男性不育的灵敏度和特异度
讨 论
光镜下的人工精液检查曾经是大部分实验室的常用的诊断方法。随着技术的进步,计算机辅助精子质量分析(computer-aided sperm analysis,CASA)系统逐渐在男科实验室普及,CASA使得检测结果更加灵敏、迅速、客观、准确〔11〕。而CASA的结果报告中有多个指标,包括精子数量和动力学参数等。然而,仅仅使用这些常规指标尚不能很好地诊断男性不育。近年来,采用荧光染色法检查精子质膜完整性可以更精确地评估精子的存活状态。评价精子质量的指标很多,单独应用不够全面,指标多又增加了临床医生对病情判断的难度。为了减少指标的数量,提高诊断效率,本研究将高度相关的指标如精子密度、活动精子率、精子动力学参数、形态学指标、膜完整性进行主成分分析,计算出精液质量得分SQ,用SQ来综合评价精液质量。
对ROC曲线进行分析后发现,SQ的曲线下面积高于单独应用任何一种常规精液质量指标,说明SQ能够较好地诊断男性不育。因此,在能够进行常规精液分析和检测存活精子率的实验室可以参考SQ来评估精液综合质量。
精液ROS的水平反映了氧化应激状态,而且ROS水平与精子DNA完整性相关,是一个评价精子功能的重要指标〔12〕。另外,ROS水平除了诊断男性不育外,在预测出生缺陷、预测辅助生殖技术成功率方面也有应用价值〔13,14〕。本研究采用基于logistic回归的多变量线性组合构建SQ-ROS联合预测因子来诊断男性不育,其ROC曲线下面积大于单独应用SQ或ROS,具有较高的灵敏度和特异度。尽管上述指标ROC曲线下面积都不及半透明带结合试验((hemizona assay,HZA)〔15〕,但该试验操作复杂,实验材料来源有限,在临床上不可能批量检测。而SQ和ROS都是目前在国内适宜推广的检测指标。
本研究通过主成分分析,建立了精液综合质量得分SQ,作为一般男科实验室诊断男性不育的参考;通过多变量线性组合,构建SQ-ROS联合预测因子,适合在有条件检测精液ROS水平的男科实验室应用,并可用于辅助生殖技术中对精液质量的评估。综合指标和最佳参考值建立后,对现有的临床资料进行了模拟预测诊断,其灵敏度和特异度都较高,可进一步推广。
1.Jequier AM.Semen analysis:a new manual and its application to the understanding of semen and its pathology.Asian J Androl,2010,12(1):11-13.
2.武俊青,杨秋英,陶建国,等.中国年轻男性精液质量主成分分析.中国卫生统计,2003,20(04):25-28.
3.Lamb DJ.Semen analysis in 21st century medicine:the need for sperm function testing.Asian J Androl,2010,12(1):64-70.
4.Ozaki T,Takahashi K,Kanasaki H,et al.Evaluation of acrosome reaction and viability of human sperm with two fluorescent dyes.Arch Gynecol Obstet,2002,266(2):114-117.
5.Agarwal A,Sharma RK,Nallella KP,et al.Reactive oxygen species as an independent marker of male factor infertility.Fertil Steril,2006,86(4):878-885.
6.赵洪鑫,袁瑶,华敏敏,等.用Transgreen/PI荧光复染法检测精子的存活率.中国男科学杂志,2008,22(04):1-4.
7.赵洪鑫,史庭燕,时伟丽,等.应用化学发光法检测男性不育人群精液活性氧水平.中国男科学杂志,2009,23(04):14-17.
8.世界卫生组织.人类精液及精子-宫颈粘液相互作用实验室检验手册.第4版.人民卫生出版社,2001:3-28.
9.Pepe MS,Cai T,Longton G.Combining predictors for classification using the area under the receiver operating characteristic curve.Biometrics,2006,62(1):221-229.
10.Pepe MS,Thompson ML.Combining diagnostic test results to increase accuracy.Biostatistics,2000,1(2):123-140.
11.Krause W,Viethen G.Quality assessment of computer-assisted semen analysis(CASA)in the andrology laboratory.Andrologia,1999,31(3):125-129.
12.Agarwal A,Makker K,Sharma R.Clinical relevance of oxidative stress in male factor infertility:an update.Am J Reprod Immunol,2008,59(1):2-11.
13.Aitken RJ,Sawyer D.The human spermatozoon--not waving but drowning.Adv Exp Med Biol,2003,518:85-98.
14.Cocuzza M,Sikka SC,Athayde KS,et al.Clinical relevance of oxidative stress and sperm chromatin damage in male infertility:an evidence based analysis.Int Braz J Urol,2007,33(5):603-621.
15.Coddington CC,Oehninger SC,Olive DL,et al.Hemizona index(HZI)demonstrates excellent predictability when evaluating sperm fertilizing capacity in in vitro fertilization patients.J Androl,1994,15(3):250-254.
