姜黄素对人神经母细胞瘤细胞作用的体外试验研究
2012-12-03秦怀洲张治国吴琳王举磊李立宏高国栋第四军医大学第二附属医院神经外科西安70038第四军医大学基础部生物化学与分子生物学教研室西安7003
秦怀洲,张治国,吴琳,王举磊,李立宏,高国栋#(.第四军医大学第二附属医院神经外科,西安70038;.第四军医大学基础部生物化学与分子生物学教研室,西安 7003)
神经母细胞瘤是神经外科临床常见而难治的原发性肿瘤,目前其治疗主要应用手术切除再辅以常规放疗或化疗,患者预后情况普遍较差[1]。研究认为,以姜黄素为主要活性成分的姜黄,具有抗炎、抗氧化、抗HIV病毒等多种作用。已有研究表明,姜黄素对鼻咽癌[2]和宫颈癌[3]等多种肿瘤具有抑制作用。但目前姜黄素对抗神经系统肿瘤的作用及其机制研究较少,其对神经母细胞瘤的作用尚未见报道。笔者拟通过观察姜黄素促进神经母细胞瘤凋亡作用,进一步了解姜黄素对肿瘤细胞侵袭能力的影响,探讨其抗神经母细胞瘤的作用机制,并为多手段治疗该肿瘤打下基础。
1 仪器与材料
1.1 仪器
BX260型荧光显微镜、CK30型倒置相差显微镜(日本Olympus公司);Sunrise RC+TW型遥控酶标分析仪(奥地利Tecan公司);FACSCalibur型流式细胞仪(美国BD公司),2406-2型CO2培养箱(美国Shellab公司)。
1.2 试药
姜黄素、MTT、顺铂、Annexin V/PI双标试剂盒、Hoechst33258试剂盒均购自美国Sigma公司;DMEM培养基(美国Gibco公司);小牛血清(杭州四季青生物材料工程有限公司);其余试剂均为国产分析纯。
1.3 细胞瘤
人神经母细胞瘤SH-SY5 Y细胞购自中国科学院上海细胞所。
2 方法
2.1 MTT法测定细胞存活率
取对数生长期的细胞,倾出其培养液,用PBS洗细胞3次,加适量的胰蛋白酶消化并细胞计数后,将细胞浓度调整至104个/mL。细胞悬液按每孔200 μL加入96孔培养板。姜黄素用75%的乙醇溶解配成母液,使用时用DMEM培养液稀释至所需浓度。将姜黄素设定6个浓度:1.25、2.5、5.0、10.0、15.0、20.0 μmol·L-1,即姜黄素①、②、③、④、⑤、⑥组;每种药物浓度接种5个复孔,每个浓度设阴性对照组(培养液中只有细胞,无药物)和空白对照组(培养液中只有等量的药物,无细胞)。细胞常规培养24 h后,将培养液换成含不同浓度药物的培养液,培养板置于CO2培养箱,37℃、50 mL·L-1CO2条件下继续培养48 h。然后取出全部培养板,每孔加入MTT溶液(5 g·L-1)20 μL,再继续培养4 h,小心吸出培养液,每孔加入150 μL二甲基亚砜,振荡10min,使沉淀充分溶解,用酶标仪在490 nm波长处测定吸光度,计算肿瘤细胞存活率:细胞存活率(%)=(用药组吸光度值-空白对照组吸光度值)/(阴性对照组吸光度值-空白对照组吸光度值)×100%。
2.2 流式细胞仪分析细胞凋亡
根据Annexin V/PI双标试剂盒说明,用双蒸水1∶4稀释结合缓冲液,PBS洗涤样品细胞后,以稀释的结合缓冲液重悬细胞,并调整细胞浓度为(2~5)×105个/mL。姜黄素设定4个浓度:5.0、10.0、15.0、20.0μmol·L-1,即姜黄素①、②、③、④组。取195μL细胞悬液,加入5μL Annexin V混匀,室温反应10 min,PBS洗细胞1次,再以190 μL稀释的结合缓冲液重悬,加10 μL 20 μg·mL-1PI,用流式细胞仪分析,并计算凋亡细胞百分比。试验另设阳性对照(3 μg·mL-1顺铂)和阴性对照。
2.3 Hoechst33258荧光染料染色观察细胞核形态的改变
姜黄素设定4个浓度:5.0、10.0、15.0、20.0 μmol·L-1,即姜黄素①、②、③、④组。药物处理后的细胞用PBS洗涤并重悬,加入浓度为5 μg·mL-1的Hoechst33258荧光染料反应10 min,于荧光显微镜下观察。观察细胞核形态,以细胞萎缩、核固缩、染色质凝聚和荧光强度增强等作为凋亡细胞指征。试验另设阳性对照(3 μg·mL-1顺铂)和阴性对照。
2.4 SH-SY5Y细胞体外侵袭能力的测定
Transwell小室为一杯状结构,杯孔直径6.5mm;杯底由8.0 μm孔径的聚碳酸脂微孔滤膜封闭。滤膜内表面均匀涂人工重构基底膜材料基质胶约50 mg·L-1,包被后水化基底膜。将制备好的小室4℃风干,用紫外线照射2 h杀菌,使用前加入少量无血清的培养基水化。各组分别处理SH-SY5 Y细胞后,小室内加入100 μL肿瘤细胞悬液,细胞密度为105 mL,培养液为含10 g·L-1的BSA无血清培养液,Transwell小室加入500 μL含胎牛血清培养液。培养12 h后取出滤膜,PBS液淋洗,用棉签擦去滤膜上层的细胞,95%酒精固定,4 g·L-1结晶紫溶液染色。计数穿膜细胞数,取每个视野的平均数表示肿瘤细胞的侵袭能力。试验设阳性对照(3 μg·mL-1顺铂)和阴性对照。
2.5 统计学方法
3 结果
3.1 姜黄素对SH-SY5Y细胞生长的抑制作用
MTT试验检测细胞存活率(重复3次试验得到相似的结果),并绘制细胞生存曲线。结果表明,姜黄素能抑制SH-SY5 Y 细胞的生长,且半数抑制浓度(IC50)为 15 μmol·L-1。姜黄素对SH-SY5 Y细胞生长的抑制作用见图1。
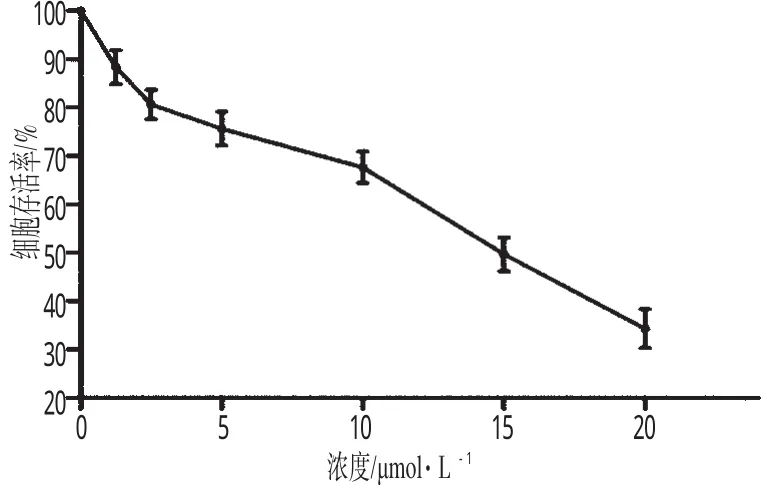
图1 姜黄素对SH-SY5Y细胞生长的抑制作用Fig 1 Inhibition effect of curcumin on the growth of SH-SY5Y
3.2 姜黄素对SH-SY5Y细胞凋亡的影响
由流式细胞仪分析结果可知,姜黄素各浓度组均出现了明显的亚二倍体凋亡峰,各组的凋亡细胞百分比与阴性对照比较,有显著性差异(P<0.01)。不同浓度姜黄素对SH-SY5 Y细胞凋亡的影响见表1。
3.3 姜黄素对细胞形态学的影响
随着药物浓度的增加,与阴性对照组比较,姜黄素各组中SH-SY5 Y细胞数量逐渐减少。姜黄素处理48h后,经Hoechst33258荧光染料染色,可见具有凋亡征象的肿瘤细胞,细胞变圆、变小、收缩,胞核深染、固缩,细胞质也出现收缩现象。正常细胞则细胞膜完整、光滑,细胞核正常。
表1 不同浓度姜黄素对SH-SY5Y细胞凋亡的影响(±s)Tab 1 Effects of different concentrations of curcumin on the apoptosis of SH-SY5Y(±s)

表1 不同浓度姜黄素对SH-SY5Y细胞凋亡的影响(±s)Tab 1 Effects of different concentrations of curcumin on the apoptosis of SH-SY5Y(±s)
与阴性对照组比较:*P<0.01vs.negative control group:*P<0.01
组别阴性对照组阳性对照组姜黄素①组姜黄素②组姜黄素③组姜黄素④组浓度/μmol·L-1- - 5101520 n 333333凋亡细胞百分比5.22±1.6862.63±5.21*16.87±4.25*29.90±2.95*45.77±5.65*61.53±4.91*
3.4 姜黄素对SH-SY5Y细胞侵袭能力的影响
阴性对照组细胞均能够穿过铺有人工重构基底膜材料的基质胶,姜黄素各组穿膜细胞数均少于阴性对照组(P<0.01),且随姜黄素浓度升高,穿膜细胞数明显减少。姜黄素④组与阳性对照组比较,穿膜细胞数无显著性差异。不同浓度姜黄素对SH-SY5 Y细胞穿膜数量的影响见表2。
4 讨论
本试验以SH-SY5 Y细胞为研究对象,结果随着剂量的增加,细胞生存率显著降低,SH-SY5 Y细胞的生存曲线显示其生长明显受到抑制,说明姜黄素能明显抑制该肿瘤细胞生长。Hoechst33258荧光染色结果也表明,姜黄素可促进SH-SY5 Y细胞的凋亡,并使细胞出现形态学改变。Transwell细胞侵袭能力试验发现,随着姜黄素作用浓度的增加,肿瘤细胞的侵袭能力逐渐下降,这与近期国外一项研究显示的姜黄素能降低结肠癌的侵袭能力一致[4]。提示姜黄素具有减少神经母细胞瘤转移复发的作用。这些数据可为姜黄素治疗神经母细胞瘤提供依据,也可为多途径综合治疗神经母细胞瘤提供策略,但其具体作用机制还需进一步研究。
表2 不同浓度姜黄素对SH-SY5Y细胞穿膜数量的影响(±s)Tab 2 Effects of different concentrations of curcumin on the number of passed membrane SH-SY5Y(±s)

表2 不同浓度姜黄素对SH-SY5Y细胞穿膜数量的影响(±s)Tab 2 Effects of different concentrations of curcumin on the number of passed membrane SH-SY5Y(±s)
与阴性对照组比较:*P<0.01vs.negative control group:*P<0.01
组别阴性对照组阳性对照组姜黄素①组姜黄素②组姜黄素③组姜黄素④组浓度/μmol·L-1--5101520 n 333333穿膜细胞数(个/孔)197.0±9.862.7±6.8*164.3±12.1*133.7±4.2*100.0±10.5*64.7±7.8*
[1]Saulnier SG,Bergendahl GM,Brard L,et al.Aphase 1 study of nifurtimox in patients with relapsed/refractory neuroblastoma[J].J Pediatr Hematol Oncol,2011,33(1):25.
[2]Wong TS,Chan WS,Li CH,et al.Curcumin alters the migratory phenotype of nasopharyngeal carcinoma cells through up-regulation of E-cadherin[J].Anticancer Res,2010,30(7):2851.
[3]Singh M,Singh N.Curcumin counteracts the proliferative effect of estradiol and induces apoptosis in cervical cancer cells[J].Mol Cell Biochem,2011,347(1-2):1.
[4]Nautiyal J,Banerjee S,Kanwar SS,et al.Curcumin enhances dasatinib-induced inhibition of growth and transformation of colon cancer cells.[J].Int J Cancer,2011,128(4):951.
