115例病例分析造血干细胞对化疗药物肝毒性的保护作用
2012-12-03宋国红邸立军卢元丽祝毓琳北京大学肿瘤医院暨北京市肿瘤防治研究所乳腺肿瘤内科恶性肿瘤发病机制及转化研究教育部重点实验室北京100142
梁 旭,宋国红,邸立军,卢元丽,祝毓琳,张 洁,贾 军,严 颖,任 军(北京大学肿瘤医院暨北京市肿瘤防治研究所乳腺肿瘤内科,恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142)
药物性肝损伤是指在药物治疗过程中,肝脏由于药物或药物代谢性产物的毒性损害,或者对药物的变态反应所致的疾病,也称药物性肝炎。由于诊断困难、原因多样化、病人不能及时就诊等多方面的因素,急性药物性肝毒性在临床中容易被忽视。化疗在恶性肿瘤治疗中占有重要地位,但化疗药物所导致的药物性肝损害给患者带来痛苦及不适,并可影响化疗的剂量及化疗给药进程。如何预防和治疗化疗药物所致的不良反应,已成为肿瘤临床工作者重要的研究课题。本文采用美国国立癌症研究所常规毒性判定标准3.0版(NCI CTC 3.0)为判定标准,对北京肿瘤医院近5年来乳腺内科完成的115例造血干细胞支持下的大剂量化疗住院患者作回顾性研究,对其化疗药物引发肝毒性的情况进行统计分析,并对比有无造血干细胞支持对化疗药物的肝细胞毒性的影响。
1 材料与方法
1.1 资料来源
研究对象为北京肿瘤医院2005年1月– 2009年10月乳腺癌住院患者,接受以紫杉类为基础方案的大剂量化疗,共分三周期进行,第一周期动员化疗给予多西紫杉醇120 mg·m-2联合G-CSG 5 μg·kg-1动员采集外周血造血干细胞,第二周期给予多西紫杉醇120 mg·m-2+ 塞替派175 mg·m-2±卡铂300 mg·m-2大剂量化疗后,予以自体造血干细胞支持保护,第三周期重复第二周期方案。共131例患者完成该方案化疗。患者每周期化疗前均要求肝功能正常,化疗过程中给予还原型谷胱甘肽预防治疗药物的肝脏毒性反应。排除了治疗期间肝脏转移病灶明显进展、合并活动性病毒性肝炎造成肝功能异常、明确因同时服用中药等易引发肝功异常的药物、及其他合并肝功异常的肝脏基础病变的病例,符合上述条件的患者共115例。
1.2 分析方法
采用回顾性调查,自身配对研究的方法,对入组的115例患者完成第一周期动员化疗和第二周期大剂量化疗联合造血干细胞支持治疗后的肝功能生化结果进行采集,以用药后1个月内最高的血清谷丙转氨酶(ALT)为主要观察指标。采用NCI CTC 3.0为标准,以ALT为主要观察指标,评价药物的肝细胞毒性。在NCI CTC 3.0中的标准:ALT值大于正常值上限至2.5倍正常值上限为ALT异常升高1度,2.5 ~ 5倍为2度,5 ~ 20倍为3度,大于20倍为4度。ALT检测的正常值上限为40 IU·L-1。
1.3 统计学处理
采用SPSS15.0软件包进行资料的处理与分析。采用Wilxon符号秩和检验考察患者在第二周期联合干细胞治疗后肝功能较第一周期的变化情况。采用χ2检验比较动员化疗和大剂量化疗联合干细胞治疗后发生2 ~ 4度肝毒性患者比例。均采用双侧检验,以P< 0.05为差异有统计学意义。
2 结果
2.1 病例特点
115例患者均为经病理证实、具有可测量病灶的复发转移乳腺癌患者,距离末次放化疗、手术时间 >4周;年龄18 ~ 65岁,中位年龄49.2岁;预计生存期> 6个月;KPS评分≥70分,化疗前包括肝功能在内的各项血液生化指标均符合化疗适应证。其中,乳腺癌合并肝转移13例(11.3%),乙肝抗原阳性3例(2.6%),丙肝抗原阳性1例(0.8%)。患者在动员化疗后和大剂量化疗(HDC)联合干细胞(PBSCs)支持治疗后肝毒性的发生比例见表1。
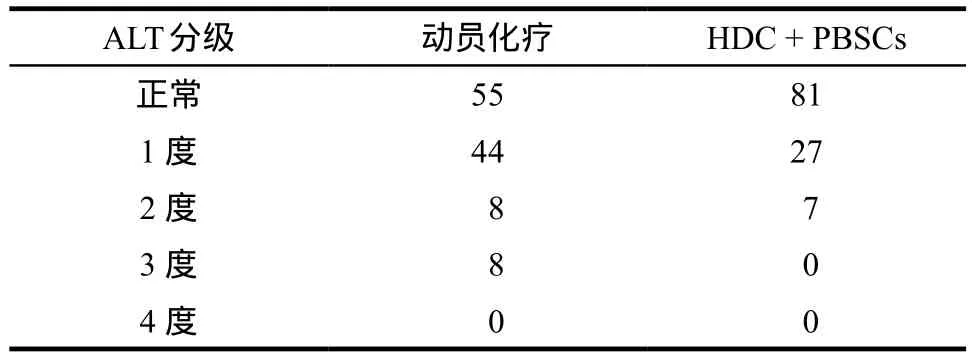
表1 动员化疗和大剂量化疗联合干细胞后肝毒性发生的病例数Tab 1 The cases with hepatotoxity in conditioning chemotherapy and HDC
2.2 两周期治疗后肝功能的变化
对比同一患者动员化疗后和化疗联合干细胞治疗后肝功能的变化,采用Wilxon符号秩和检验方法,115例患者中,64例患者单纯化疗后和化疗联合干细胞支持治疗后ALT无明显变化,40例患者在化疗联合干细胞支持治疗后肝功能较前一周期化疗有所下降,11例患者第二周期较第一周期肝功能有所升高,P = 0.000,说明化疗联合干细胞治疗较单纯化疗明显减低肝功能异常的发生。
2.3 中重度肝毒性的比较
第一周期化疗后患者2 ~ 4度肝毒性的发生率为13.9%(16例),第二周期化疗联合干细胞支持治疗后2 ~ 4度肝毒性的发生率为6.1%(7例),经χ2检验,P= 0.048,说明两周期化疗后发生2 ~ 4度肝功异常的病例数有明显差异,且差异具有统计学意义,说明干细胞支持后,患者中重度肝细胞毒性的发生率明显下降。
3 讨论
骨髓干细胞在特定的条件下均可向肝细胞方向分化。肝脏微环境中分泌各种因子,诱导骨髓造血干细胞分化为成熟的肝细胞或胆管细胞[1-3],种植于肝脏的干细胞通过旁分泌形式分泌多种细胞因子和生长因子、白细胞介素-10(IL-10)、肿瘤坏死因子(TNF-α)、肝细胞生长因子(HGF)和神经生长因子等,它们在促进肝脏再生和修复的同时,抑制肝脏炎性反应、促进细胞外基质(ECM)降解、抑制肝细胞凋亡,提高血清白蛋白水平[4-5]。临床研究中,利用骨髓干细胞、外周血干细胞、人脐血干细胞等多来源的干细胞对多种肝病引起的肝功能衰竭,且目前没有非常有效治疗的重症肝病进行治疗,患者在临床症状、实验室生化指标等方面得到改善[6-8]。肝炎病毒携带者发生肿瘤需要进行化疗时,肝功能异常可能引起化疗不能如期进行甚至终止化疗。本研究通过分析同一患者在连续接受化疗后肝功能的不同反应,讨论造血干细胞可能存在减轻药物性肝毒性的作用。
在临床实践中,患者接受剂量强度增大的联合方案化疗并联合干细胞支持治疗后,往往比单纯接受单药化疗时肝功能异常的发生率低,故我们回顾性分析了近5年来,在我院接受以多西紫杉醇为基础的大剂量化疗的115例患者的资料:多为高危复发转移乳腺癌患者,不伴有引起肝功能异常的弥漫多发肝转移灶,KPS评分≥70分。我们采用自身对照的方式比较干细胞输注引起患者两周期化疗后肝功能的不同,其中40例患者肝功能在第二周期化疗后比前一周期有所下降,说明我们所采用的骨髓来源外周血干细胞对化疗药物引起的肝细胞损伤具有保护作用,同时,化疗后给予干细胞输注使得发生2 ~ 4度中重度肝毒性的比例明显下降。肝功能异常是化疗的禁忌证,往往需要延迟甚至终止化疗。在肝脏发生严重损伤时,通过分泌肝细胞生长因子(HGF)、基质趋化因子(SDF-1)等,进一步动员骨髓中的干细胞转移种植于肝脏,其中对于间充质干细胞(MSCs)的研究较多。Chapel等首次证实骨髓MSCs在多器官损伤的灵长类动物体内的归巢作用,且其分布数量与损伤部位的表面形状及损伤程度有关。基质细胞衍生因子(SDF)及趋化因子受体CXCR4构成的SDF/CXCR4轴,肝细胞生长因子HGF及其受体c-met构成的HGF-c-met轴,连同基质金属蛋白酶(MMP9),均可能与MSCs的归巢作用有关[9]。WNT信号转导途径可能起作用,但归巢机制仍不明确。随着肝脏损伤程度的加重,这一信号通路的作用随之增强,有更多的造血干细胞向肝脏区趋化转移[10-11],这也解释了在我们的研究中,经过干细胞输注后,中重度肝损伤的发生率明显下降。
针对经使用谷胱甘肽类、甘草甜素类等治疗仍无效且病情持续时间较长,或合并黄疸、急性严重肝功能损伤的患者,给予患者自体造血干细胞输注后有很好的治疗效果,这一临床研究正在进行当中。抗肿瘤药物引起的药物性肝损害,特别是在肝炎发病率较高的中国,肝脏毒副作用及具有肝脏基础病的肿瘤患者的治疗策略值得关注[12]。干细胞对于多种肝脏疾病的治疗已在临床广泛开展,通过我们的研究,推测干细胞对于化疗药物引起的肝损伤存在保护和快速修复的治疗作用,其具体机制正在进一步研究中。
