参附注射液对脑缺血再灌注大鼠MDA、SOD、TXB2及6-keto-PGF1a的影响及意义
2012-12-03江承平刘福李毅王柏强唐晓蓉吴碧华王晓明
江承平,刘福,李毅,王柏强,唐晓蓉,吴碧华,王晓明
(1.川北医学院附属医院药剂科,四川 南充 63 700 7;2.川北医学院神经病学研究所,四川 南充 63 7000)
近年来脑缺血后继发性损伤、炎性反应对脑缺血后神经功能缺损及致残率方面的作用逐渐引起重视。虽然人们更倾向于超早期溶栓治疗脑梗死,但是脑缺血再灌注损伤引起的一系列继发改变,导致缺血组织损伤恶化。研究发现,某些中药如川芎、参附等可以减轻脑缺血再灌注的损伤,但目前国内这方面的具体研究极少。本实验通过观察参附注射液对局灶性脑缺血-再灌注大鼠血清中超氧化物歧化酶(SOD)活性及丙二醛(MDA)、血栓素B2(TXB2)、6-酮-前列腺素 F1a(6-keto-PGF1a)含量的影响,探讨参附注射液对脑的保护机制。
1 材料与方法
1.1 材料
参附注射液由雅安三九药业有限公司生产,10 mL/支(批号为:991202);丙二醛(MDA)、超氧化物歧化酶(SOD)、血检素B2(TXB2)及6-酮-前列腺素Fla(6-keto-PGF1a)试剂盒购自南京建成生物工程研究所;2,3,5-氯化三苯基四氮唑(TTC),Amresco 公司;其他试剂均为国产分析纯。低温离心机,美国Beckman TJ-6Centrfuge;TU-1901紫外可见分光光度计,北京普析通用有限责任公司。
1.2 方法
1.2.1 动物分组及模型建立:健康雄性成年SD大鼠60只,体质量240~270 g(清洁级)购自川北医学院实验动物中心,许可证号SCXK(川2008-18)。实验前置于实验室适应环境1周。将大鼠随机分为假手术组、脑缺血再灌注组(IR组)、参附治疗组,每组20只。动物术前12 h禁食不禁水,参照Longa[1]及改良线栓法[2]制备大鼠脑缺血再灌注损伤模型,用2%戊巴比妥钠(40 mg·kg-1腹腔内注射,麻醉后分离颈部各动脉,将直径0.20 mm尼龙线,自右颈外动脉插入颈内动脉,至遇阻力为止,深度约为18 mm(自颈总动脉分叉处算起),注意防止栓线滑出,结扎固定栓线,术中监测直肠温度,保持在36.5~37.5℃。缺血2 h后,在麻醉状态下,拔出栓线,再灌注24 h,以大鼠苏醒后出现左侧Horner征,爬行向左侧划圈或左前肢屈曲为模型建成的标志。假手术组只进行麻醉和血管分离术,不进行缺血再灌注及静脉注射;参附治疗组于再灌注后经静脉给参附注射液8 mg/kg(生药浓度),7 d,IR组于再灌注后经静脉给予生理盐水 8 mg/kg,7 d。
1.2.2 神经功能缺失评分:按 Longa[1]及 Bederson[3]5分制法对各组动物进行神经功能缺失评分。0分:无神经功能缺失症状体征;1分,对侧前爪不能完全伸直,同侧Horner征;2分,行走时向对侧旋转;3分,行走时向对侧倾倒;4分,不能自行行走,意识丧失。
1.2.3 脑梗死面积测定[4]:各组动物实验结束,迅速断头取脑,置于-20℃冰箱中冷冻20 min,距额极后2.5 mm,冠状面切取脑片5张,将切片迅速置于2%TTC溶液中,避光,37℃温孵15~30 min,不时翻动切片,使均匀接触染色剂,正常脑组织呈玫瑰红色,梗死组织呈白色。然后置于4%多聚甲醛中固定,将染色结果输入计算机,利用图像处理软件(AutoCAD),分别计算出5个脑片缺血侧的总面积和梗死区域的面积,求出梗死区域占大脑半球总面积的百分比作统计参数。
1.2.4 脑组织 SOD、MDA、TXB2、6-Keto-PGF1a 水平测定:各组动物实验结束,迅速断头取脑,脑组织于冰浴中分离大脑皮层,称取200 mg,冷PBS液10 mL匀浆,-20℃备用,测定时样本作适当稀释。采用黄嘌呤氧化酶法检测血清中SOD活性(单位:U/mL);硫代巴比妥酸显色法(TBA法)检测血清中MDA含量(单位:nmol/L);平衡法测定TXB2(单位:ng/L);非平衡法测定6-Keto-PGF1a(单位:ng/L),操作按试剂盒说明书进行。
1.3 统计学分析
2 结果
2.1 参附注射液对脑缺血再灌注大鼠神经功能的影响
假手术组的神经功能评分为0,IR组有明显的神经功能缺失症状,主要表现为提尾悬空时的强迫体态——左前肢紧贴胸壁躯体向左侧扭转,右侧肌张力相对增强以及运动时的追尾征——向左侧旋转,致尾巴呈特殊的盘绕状;参附组能明显降低模型组神经功能缺失症状。见表1。

2.2 参附注射液对脑缺血再灌注大鼠脑梗死面积比的影响
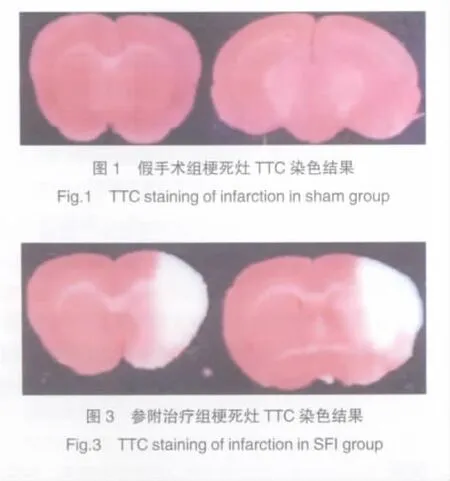
TTC染色结果表明,假手术组脑片均红染,无白色梗死灶。IR组可见明显的梗死灶,主要位于嗅沟上方的颞叶皮质和尾壳核。参附治疗组与IR组比较脑梗死比显著下降(P<0.05)。见表1,图1~3。
2.3 参附注射液对脑缺血再灌注大鼠SOD活性、MDA、TXB2及6-keto-PGF1a含量的影响
IR组与假手术组比较,血清中SOD活性降低,MDA、TXB2含量增加,6-keto-PGF1a含量降低(P<0.05);参附治疗组与IR组比较,血清中SOD活性增高,MDA、TXB2含量降低,6-keto-PGF1a含量增高(P<0.05);参附治疗组血清中SOD活性低于假手术组,MDA、TXB2含量高于假手术组(P<0.05)。见表2。


3 讨论
本研究从行为学、形态学和生物化学等方面证实参附注射液对大鼠脑缺血再灌注损伤具有保护作用。
3.1 改善MCAOR损伤后大鼠神经功能缺失症状
由于大脑中动脉供血区涉及调控运动的脑区,因此动物麻醉清醒后即可表现出运动失调的神经病学症状,右侧MCAOR,同侧调控运动控制区发生损伤,由于皮层交叉支配,导致左侧肢体肌无力,故运动时向左侧旋转,表现出典型的追尾征或向左侧倾倒等症状。参附组的大鼠神经功能评分均降低,表明该药能改善MCAOR大鼠的神经功能障碍。TTC染色结果显示,参附治疗组大鼠脑梗死体积百分比显著下降,说明参附注射液在减轻大鼠脑缺血再灌注损伤中起着重要的作用。
3.2 提高SOD的活性,降低MDA含量,维持血浆中TXB2/6-keto-PGF1a动态平衡
MDA是氧自由基引发的生物膜不饱和脂肪酸过氧化反应代谢产物,能够反应细胞损伤的程度[5],而SOD是天然抗氧化酶,能够清除体内生成的氧自由基,从而阻断脂质过氧化连锁反应,其活性能够反应机体清除氧自由基的能力。本实验中我们发现,大鼠脑缺血再灌注后血清中SOD活力显著下降,MDA含量显著增高,说明大鼠脑缺血再灌注后大量氧自由基的产生及SOD活力下降引起生物膜脂质过氧化损伤,使MDA含量增高。脂质过氧化增加能够使细胞溶解,还能引起血小板膜的损伤,促使血小板的聚集,并且会抑制动脉壁前列环素(PGI2)合成酶活性,使得PGI2合成减少,导致TXA2/PGI2比例失调,引起对机体的损伤[6,7]。PGI2是血管壁内皮细胞合成和释放的有舒张血管和抗血小板聚集作用的生物活性物质,半衰期短,迅速转化为稳定的无生物活性的6-keto-PGF1a。而TXA2是血小板微粒体合成释放的具有促进血小板聚集和促进血管收缩的生物活性物质,半衰期也很短,很快转为稳定无生物活性的TXB2。在正常的生理环境下,PGI2和TXA2保持平衡,控制血管的正常张力,防止血栓的形成。本实验中我们发现,脑缺血再灌注损伤时,TXB2(TXA2)增多,6-keto-PGF1a(PGI2)减少,导致血小板聚集和血管强烈收缩,导致低灌流,加重了脑组织的损伤,这与其他报道的结论一致[8,9]。
研究中我们发现,参附注射液可以显著提供SOD的活性,使得体内氧自由基减少,减少了氧自由基引发的脂质过氧化损伤,使MDA含量降低,表明其可减轻缺血所致的脑组织自由基损伤;同时PGI2(6-keto-PGF1a)合成增多,显著提高TXB2(TXA2)的含量,有利于TXA2/PGI2平衡的恢复,提示参附注射液对脑缺血再灌注的损伤具有显著的保护作用。
[1]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[2]罗勇,董为伟.Wistar大鼠插线法局灶性脑缺血/再灌注模型的实验研究[J].重庆医科大学学报,2002,27(1):1-4.
[3]Bederson JB,Pitts LH,Tsuji M,et al.Rat middle cerebral artery occlusion:evaluation of the model and development of a neurologic examination[J].Stroke,1986,17(3):472-475.
[4]张均田.现代药理学试验方法[M].北京:北京医科大学,中国协和医科大学出版联社,1998:1241.
[5]Ikeda Y,Long DM.The molecular basis of brain injury and brain edema:The role of oxygen free radicals[J].Neurosurgery,1990,27(1):1-11.
[6]DurukanA,StrbianD,TatlisumakT.Rodentmodelsofischemic stroke:a useful tool for stroke drug development[J].Curr Pharm Des,2008,14(4):359-370.
[7]Fang YC,Wu JS,Chen JJ,et,al.Induction of prostacyclin/PGI(2)synthase expression after cerebral ischemia-reperfusion[J].J Cerebr Blood F Met,2006,26(4):491-501.
[8]李青兰,任泽恩,武建坤,等.络泰对大鼠局灶性脑缺血再灌注损伤的保护作用[J].长治医学院学报,2008,22(3):165-167.
[9]Vikram D.Effect of phospholipase C blockade on cerebral vasospasm[J].Cerebrovasc Dis,2008,25(4):362-365.
