HMGB1基因真核细胞表达载体的构建及其在人脐静脉血管内皮细胞中的表达
2012-08-21张晓娟李旭栾正刚马晓春
张晓娟,李旭,栾正刚,马晓春
(中国医科大学附属第一医院重症医学科,沈阳 110001)
脓毒症是指由感染引起的全身炎性反应综合征,其发生率以每年1.5%~8%的速度递增[1]。高迁移率族蛋白 1(high mobility group box 1,HMGB1)是高迁移率族蛋白超家族成员之一,是广泛存在于真核细胞核中最重要的非组蛋白,分子质量小,含量丰富,序列高度保守[2,3]。HMGB1 是脓毒血症晚期重要的炎性介质[4]。血管内皮细胞在脓毒症的发生发展中具有重要作用,当其受到炎性刺激时可释放HMGB1,促进细胞因子和黏附分子的表达[5,6]。HMGB1激活血管内皮细胞的分子机制尚未明确。本研究旨在构建HMGB1基因真核细胞表达载体,并鉴定重组质粒转染到细胞中后HMGB1蛋白的表达,为HMGB1基因在脓毒症发病机制和细胞信号的研究提供有利的分子工具。
1 材料与方法
1.1 菌株、细胞和质粒
人脐静脉血管内皮细胞(human umbilical venular endothelial cell,HUVEC)株购自南京凯基生物公司,PCDNA-3.1-myc-his-B质粒和大肠杆菌DH5α购自大连TaKaRa公司。
1.2 主要试剂
High-glucose DMEM、胎牛血清购于Hyclone公司;KpnⅠ、EcoRⅠ限制性内切酶﹑T4 ligase DNA连接酶﹑氨苄青霉素100 mg/mL﹑琼脂糖凝胶﹑DL2000 DNA Marker﹑HindⅢ-digest DNA Marker﹑RT-PCR 试剂盒均购自TaKaRa公司;Trizol购自Invitrogen公司;兔抗His标签抗体购自Santa Cruze公司;辣根过氧化物酶标记的山羊抗兔二抗购自中杉公司,小提质粒试剂盒、凝胶回收试剂盒购自于爱思进公司。引物合成、DNA测序鉴定由上海生物工程有限公司完成。
1.2 方法
1.2.1 载体构建:用含10%胎牛血清的高糖DMEM培养HUVEC至90%融合,Trizol法提取总RNA,反转录为cDNA,PCR扩增HMGB1的可读框。用Primer5.0软件设计引物,上游和下游分别引入KpnⅠ和EcoRⅠ酶切位点,引物序列如下:上游:5′-GGGGTACCATGGGCAAAGGAGATCCTAAGA-3′;下游 :5′-CGGAATTCGTTTCATCATCATCATCTTCTTC-3′。扩增条件为:94 ℃ 2 min,94 ℃ 40 s,54 ℃ 40 s,72℃50 s,循环30次。扩增长度为647 bp,将PCR产物和PCDNA-3.1-myc-his-B用KpnⅠ和EcoRⅠ双酶切,电泳后切胶回收。T4连接酶16℃连接16 h,转化感受态DH5α,以含氨苄青霉素的LB选择性固体培养基培养,次日挑取阳性克隆,提取质粒,酶切鉴定,然后测序。
1.2.2 提取无内毒素重组载体:将酶切阳性且测序结果吻合的菌液接种于含100 μg/mL氨苄青霉素的LB培养基中,37℃振荡培养过夜,收集菌液,采用无内毒素质粒中提试剂盒,按照说明书抽提无内毒素重组体。
1.2.3 质粒转染:收获处于对数生长期的HUVEC,以 5×104/孔接种于 6孔培养板中,37℃、5%CO2环境中培养24 h,细胞长至80%~90%融合,按转染试剂说明书进行转染。将细胞分为阴性对照组(转染PCDNA-3.1-myc-his-B空载体)和实验组(转染PCDNA-3.1-myc-his-B-HMGB1重组质粒)。转染48 h后收集RNA和蛋白进行相应的检测。
1.2.4 Western blot:PCDNA-3.1-myc-his-B-HMGB1重组质粒转染HUVEC 48 h后,提取转染后细胞的总蛋白,考马斯亮兰定量,将样品调成相同的浓度,加入5×SDS凝胶加样缓冲液,沸水煮5 min,行SDS-聚丙烯酰胺凝胶电泳,转移至PVDF膜上,5%脱脂奶粉封闭,将膜与一抗(兔抗His标签抗体1︰500稀释)4℃孵育过夜,PBST洗膜,再与辣根过氧化物酶标记的二抗在室温下孵育1 h,PBST洗膜,将膜与ECL发光底物结合,曝光,显影。
2 结果
2.1 琼脂糖电泳结果
1%琼脂糖电泳结果显示,PCR反应产物大小为647 bp,与GenBank中登录的人HMGB1基因大小一致。见图1。
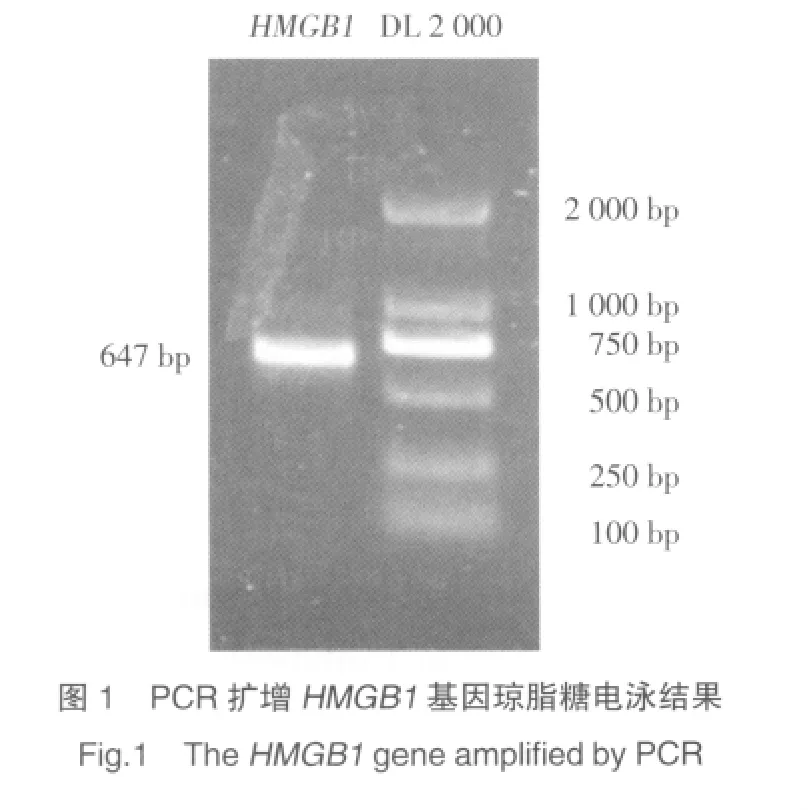
2.2 PCDNA-3.1-myc-his-B-HMGB1重组质粒的的双酶切鉴定
提取PCDNA-3.1-myc-his-B-HMGB1重组质粒,经KpnⅠ和EcoRⅠ双酶切,电泳结果如图2所示,重组质粒酶切后产生5 500 bp与647 bp 2个条带,分别与PCDNA-3.1-myc-his-B和HMGB1基因大小相符,初步确定PCDNA-3.1-myc-his-B-HMGB1重组质粒构建成功。

2.3 PCDNA-3.1-myc-his-B-HMGB1重组质粒测序结果分析
提取PCDNA-3.1-myc-his-B-HMGB1重组质粒,经上海生工生物公司测序,结果与GenBank中HMGB1序列比对,完全一致,无移码,无突变,确定重组质粒构建成功。
2.4 蛋白水平检测PCDNA-3.1-myc-his-B-HMGB1重组质粒在HUVEC中的表达
PCDNA-3.1-myc-his-B-HMGB1重组质粒转染HUVEC 48 h后,提取细胞总蛋白做Western blot检测,与PCDNA-3.1-myc-his-B空载体转染细胞组相比,外源重组蛋白HMGB1在PCDNA-3.1-myc-his-BHMGB1重组质粒转染组HUVEC内有表达。见图3。

3 讨论
HMGB1是一种普遍存在的核蛋白,广泛分布于哺乳动物细胞中,在胸腺、淋巴组织、睾丸和新生儿肝脏中均可检测到高水平的HMGB1[7]。不同存在部位的HMGB1可发挥不同的生物学功能及效应:细胞核内的HMGB1为DNA结合蛋白,能维持核小体结构,调节基因转录及类固醇类激素受体的活性;胞外HMGB1为一种重要的炎性介质和致炎细胞因子,是启动和维持炎症瀑式反应的中心分子,与脓毒症的发病机理关系密切[8]。胞外HMGB1需要与相应胞膜受体结合才能发挥其生物学效应,晚期糖基化终末产物受体(receptor for advanced glycation end products,RAGE)与HMGB1具有高亲和力,是HMGB1的主要受体[9],HMGB1与RAGE结合后,可引发丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)的磷酸化(包括 p38MAPK、JNK1/2、ERK1/2),核转录因子 NF-κB 和活化蛋白 1的核内转移,使其他炎性因子如IL-1β、TNF-α及IL-8等表达加强,释放增多,从而启动炎症或使炎症恶化[10]。脓毒症时,RAGE在内皮中广泛表达,提示HMGB1可能对血管内皮细胞有激活作用,并且促成了对感染的炎性反应。然而,RAGE不应是HMGB1的唯一受体,近期研究结果显示,Toll样受体 2(toll like receptor 2,TLR2)和 4(TLR4)可能也作为HMGB1的受体参与HMGB1的信号转导[11]。前期的研究证实,HMGB1可由激活的内皮细胞释放,促进细胞因子和黏附分子的表达增加。内皮可能是HMGB1分泌的重要源泉[12]。本研究应用PCR方法从HUVEC中扩增HMGB1全长基因,酶切后定向克隆到带有HIS标签的真核细胞表达载体PcDNA3.1中,酶切测序鉴定质粒构建成功;再将质粒转染到HUVEC中,Western blot检测到HMGB1在HUVEC中与转染空载体组对比呈高表达。本研究结果为进一步探索HMGB1在脓毒症血管内皮细胞损伤或激活中的作用提供了一种新的研究工具。
[1]Angus DC,Linde-Zwirble WT,Lidicker J,et al.Epidemiology of severe sepsis in the United States:analysis of incidence,outcome,and associated costs of care [J].Crit Care Med,2001,29 (7):1303-1310.
[2]Bustin M.Revised nomenclature for high mobility group(HMG)chromosomal proteins[J].Trends Biochem Sci,2001,26(3):152-153.
[3]Bianchi ME,Beltrame M.Upwardly mobile proteins.Workshop:the role of HMG proteins in chromatin structure,gene expression and neoplasia[J].EMBO Rep,2000,1(2):109-114.
[4]Wang H,Bloom O,Zhang M,et al.HMG-1 as a late mediator of endo toxin lethality in mice[J].Science,1999,285(5425):248-251.
[5]Ait-Oufella H,Maury E.The endothelium:physiological functions and role in microcirculatory failure during severe sepsis[J].Intensive Care Med,2010,36(8):1286-1298.
[6]Fiuza C,Bustin M,Talwar S,et al.Inflammation-promoting activity of HMGB1 on human microvascular endothelial cells[J].Blood,2003,101(7):2652-2660.
[7]Li J,Kokkola R,Tabibzadeh S,et al.Structural basis for the proinflammatory cytokine activity of high mobility group box 1 [J].Mol Med,2003,9(122):37-45.
[8]Yang H,Wang H,Czura CJ,et al.The cytokine activity of HMGB1[J].J Leukoc Biol,2005,78(1):1-8.
[9]Kokkola R,Andersson A,Mullins G,et al.RAGE is the major receptor for the proinflammatory activity of HMGB1 in rodent macrophages[J].Scand J Immunol,2005,61(1):1-9.
[10]Chen G,Ward MF,Sama AE,et al.Extracellular HMGB1 as proinflammatory cytokine[J].J Interferon Cytokine Res,2004,24(6):329-333.
[11]Park JS,Svetkauskaite D,He Q,et al.Involvement of toll like receptors 2 and 4 in cellular activation by high mobility group box 1 protein[J].J Biol Chem,2004,279(9):7370-7377.
[12]Mullins GE,Sunden-Cullberg J,Treutiger CJ,et al.Activation of human umbilical vein endothelial cells leads to relocation and release of high-mobility group box chromosomal protein 1[J].Scand J Immunology,2003,60(6):566-573.
