壮骨关节丸对肾虚型骨性关节炎大鼠脏器系数及总胆红素的影响*
2012-12-01荆生龙赵宏艳何晓鹃孙舒玉王敏智
荆生龙,徐 彭,赵宏艳,何晓鹃,李 静,孙舒玉,罗 丹,王敏智,肖 诚,吕 诚△
(1.江西中医学院,南昌 330004;2.中国中医科学院中医基础理论研究所,北京 100700;3.中国中医科学院临床所,北京 100700;4.中日友好医院,北京 100029)
壮骨关节丸主要由狗脊、淫羊藿、独活、骨碎补、续断、补骨脂、桑寄生、鸡血藤、熟地黄、木香、乳香、没药组成,功以补益肝肾,养血活血,舒筋活络,理气止痛为主,用于肝肾不足、血瘀气滞、脉络痹阻所致的骨性关节炎、腰肌劳损。自上市以来,临床疗效确切,得到市场认可,但2001年11月19日,国家药品不良反应监测中心首次通报了壮骨关节丸引起肝损害等不良反应情况,通报后(2001年11月)至2008年5月27日,国家中心病例报告数据库共收到相关病例报告158例,不良反应表现主要为皮疹、瘙痒、恶心、呕吐、腹痛、腹泻、胃痛、血压升高、肝功能异常,其中表现为肝损害的47例占30.4%。来自13个省、自治区、直辖市的47例肝损害相关病例报告显示,患者主要为骨性关节炎、风湿性关节炎、腰间盘突出、颈椎病、骨质增生、腰肌劳损等老年退行性骨关节病变。虽然症状明确,但未深入调查患者病因病机,因此推测由于临床试验中所选对象的局限性,不能完全反映药物对于不同中医证候人群的效应。为了探究壮骨关节丸对于不同类型骨性关节炎的影响,本研究通过壮骨关节丸连续灌胃肾虚型骨性关节炎及骨性关节炎模型大鼠4周后的脏器系数及血清中TBIL含量变化,评价其对大鼠不良反应的具体证况,为后续上市药物安全性再评价中药物毒理与证型研究提供实验基础。
1 材料与方法
1.1 动物
雌性SD大鼠72只,体重 160g~180g,由中国人民解放军军事医学科学院实验动物中心提供(合格证号SCXK-(军)2007-004)。
1.2 药物
注射用青霉素钠由华北制药股份有限公司生产(批号X1007206),壮骨关节丸由三九医药股份有限公司生产(批号1111020S),均由本实验室人员粉碎后,实验前以蒸馏水配成所需浓度。
1.3 仪器
HITACHI7180型全自动生化分析仪(日本Hitachi High-Tech Science SystemsCorporation),AE240型电子分析天平(日本 METTLER公司)。
1.4 方法
1.4.1 动物分组 动物适应性饲养1周后,随机分为正常组、骨性关节炎组、肾虚型骨性关节炎组3大组,每组24只。每组大鼠按照不同的给药剂量随机分为正常对照组、治疗量组、高倍量组3小组,每组8只。共分为骨性关节炎模型组、治疗量组、高倍量组,肾虚型骨性关节炎模型组、治疗量组和高倍量组。
1.4.2 建立模型 手术切除雌性大鼠卵巢,可造成NIM网络平衡失调,从而反映临床肾虚证的某些病理变化特征,因此被用作肾虚模型常用造模方法,其分为骨性关节炎模型组、治疗量组、高倍量组;肾虚型骨性关节炎模型组、治疗量组、高倍量组。当然也有其他方法,比如外源性糖皮质激素刺激[1]、腺嘌呤喂养等。此次研究主要采取无菌状态下切除雌鼠双侧卵巢的方法进行肾虚模型的建立。将肾虚型骨性关节炎组大鼠麻醉后腹位固定,剪去鼠毛暴露手术视野,以75%酒精及碘酊消毒切开皮肤、背部肌肉和腹膜,用小镊子分离脂肪团便可见卵巢,先将卵巢下端输卵管用手术线结扎,然后摘除卵巢,切口缝合后敷以消炎粉。其他组全部大鼠手术入路同上,发现卵巢后仅切除与卵巢等量的脂肪后缝合皮肤。
肾虚模型建立 4周后,参考文献方法[2~4]并加以调整,肾虚型骨性关节炎组及骨性关节炎组大鼠用戊巴比妥钠麻醉,在无菌状态下切断右侧膝关节内前交叉韧带和内侧部分半月板,制成骨性关节炎模型,缝合皮肤后连续3d腹腔注射4万单位PG0.2ml/只。正常组将右侧膝关节部位皮肤切开,然后缝合进行假手术处理。
1.4.3 给药剂量及方法 骨性关节炎模型建立后第2天,各组大鼠按照如下方式给药:所有高倍量组给予壮骨关节丸5.55g/(kg·d)(成人等效剂量的5倍)灌胃;治疗量组按照壮骨关节丸1.11g/(kg·d)剂量(成人等效剂量)灌胃;模型组及对照组大鼠则给予同等体积的蒸馏水灌胃。所有给药,持续4周,实验过程中动物正常供给饲料和饮水。
1.4.4 取材 给药结束后,麻醉处死大鼠,立即取脏器心、肝、脾、肺、肾、肾上腺、胸腺,称湿重计算脏器系数并收集血清进行TBIL含量检测。
2 结果
2.1 动物脏器系数
表1显示,各组动物给药4周后大鼠脏器系数(脏器重量/体重)变化情况:胸腺指数与正常对照组比较,正常治疗量组及高倍量组却显著降低(P<0.05),而肾虚型骨性关节炎模型组显著偏高(P<0.05),即药物对于正常大鼠可能具有一定影响,而对于病理状态下的大鼠胸腺无明显影响;肝脏指数与正常对照组相比较,正常高倍量组显著增加(P<0.05),而肾虚型骨性关节炎模型组却显著降低(P<0.05);肾脏指数与正常对照组相比较,肾虚型骨性关节炎模型组和治疗量组显著降低(P<0.01),而骨性关节炎模型组却显著偏高(P<0.01);肾上腺指数与正常对照组相比较,仅正常高倍量组显著偏高(P<0.05),其他组别无统计学差异。心脏、脾脏以及肺脏指数与正常对照组相比,均无明显差异(P>0.05)。
2.2 总胆红素检测结果
血液生化指标也为药物毒性评价提供依据[5],血清中的胆红素大部分来源于衰老红细胞被破坏后产生出来的血红蛋白衍化而成,在肝内经过葡萄糖醛酸化的叫做直接胆红素,未在肝内经过葡萄糖醛酸化的叫做间接胆红素,二者之和就是总胆红素,是胆色素的1种,肝细胞具有摄取、结合、排泄胆红素的功能。血清胆红素数值的高低可以反映出肝脏病变或胆管阻塞等异常信息。报道显示[6],急性肝炎中血清TBIL浓度水平异常,因此其在实际临床肝病检测中意义重大。
图1显示,大鼠血清总胆红素(Total bilirubin,TBIL)结果显示,与正常对照组相比,正常高倍量组和OA高倍量组具有显著差异。
表1 不同骨性关节炎大鼠灌胃壮骨关节丸后脏器系数结果(±s)

表1 不同骨性关节炎大鼠灌胃壮骨关节丸后脏器系数结果(±s)
注:各给药组及模型组指标数值分别与正常对照组比较:*P<0.05,△P<0.01
组别胸腺 心 肝 脾 肺 肾 肾上腺正常对照组1.86 ×10 -3±5.13 ×10 -4 3.74×10-3±2.54×10-4 3.39×10-2±2.16×10-3 2.04 ×10 -3±2.75 ×10 -4 6.78×10-3±1.06×10-3 6.53×10-3±4.08×10-4 2.27×10-4±4.40 ×10-5正常治疗量组正常高倍量组OA模型组OA治疗量组OA高倍量组肾虚型OA模型组肾虚型OA治疗量组1.39 ×10 -3±2.78 ×10 -4*1.45 ×10 -3±4.91 ×10 -4*1.67 ×10 -3±3.26 ×10 -4 1.99 ×10 -3±2.62 ×10 -4 1.69 ×10 -3±2.59 ×10 -4 2.42 ×10 -3±4.97 ×10 -4*1.90 ×10 -3±3.99 ×10 -4 3.59×10-3±2.92×10-4 3.67×10-3±1.82×10-4 3.81×10-3±3.47×10-4 3.93×10-3±3.02×10-4 3.64×10-3±3.46×10-4 3.13×10-3±3.98×10-4 3.59×10-3±3.50×10-4 3.38×10-2±2.13×10-3 3.66×10-2±2.99×10-3*3.28×10-2±2.81×10-3 3.61×10-2±3.52×10-3 3.47×10-2±2.47×10-3 3.04×10-2±2.17×10-3*3.33×10-2±2.28×10-3 1.99 ×10 -3±4.58 ×10 -4 2.01 ×10 -3±2.58 ×10 -4 1.83 ×10 -3±2.58 ×10 -4 2.12 ×10 -3±1.96 ×10 -4 1.97 ×10 -3±3.16 ×10 -4 2.08 ×10 -3±5.67 ×10 -4 2.22 ×10 -3±3.61 ×10 -4 6.39×10-3±9.37×10-4 6.73×10-3±1.45×10-3 5.95×10-3±7.24×10-4 8.05×10-3±2.46×10-3 6.66×10-3±8.39×10-3 6.34×10-3±5.02×10-4 5.55×10-3±7.29×10-4 6.71×10-3±3.07×10-4 6.72×10-3±4.80×10-4 7.19×10-3±5.56×10-4 6.65×10-3±2.91×10-4 6.65×10-3±5.39×10-4 5.70×10-3±5.66×10-4 5.84×10-3±4.50×10-4 2.55×10-4±6.23 ×10 -5 2.84×10-4±6.84 ×10 -5*2.41×10-4±4.28 ×10 -5 2.32×10-4±3.55 ×10 -5 2.38×10-4±2.93 ×10 -5 1.84×10-4±2.95 ×10 -5 1.90×10-4±4.03 ×10 -5肾虚型OA高倍量组1.81 ×10 -3±2.68 ×10 -4 3.51×10-3±3.58×10-4 3.21×10-2±2.84×10-3 2.06 ×10 -3±1.98 ×10 -4 6.43×10-3±1.94×10-3 6.07×10-3±4.26×10-4 2.28×10-4±4.10 ×10-5
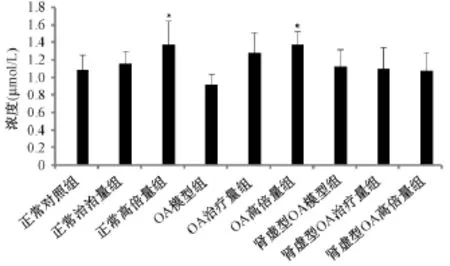
图1 不同骨性关节炎大鼠灌胃壮骨关节丸后血清TBIL结果(μmol/L)
3 讨论
骨性关节炎(osteoarthritis,OA)常被称为退行性关节病、骨质增生、骨关节病,其主要病变是关节软骨退行性变和继发性骨质增生,是中老年人群多发的风湿性疾病,而其中又以女性更为常见,具体受累关节多发于负重较大的膝关节、髋关节、脊柱以及手指关节等。中医认为,骨性关节炎首先是由于肝肾亏损,肝虚则血不养筋,筋不能维持骨节之张弛,关节失滑利,肾虚而髓减,致使筋骨失其所养;其次过度劳累,日积月累,筋骨受损,营卫失调,气血受阻,经脉凝滞,筋骨失养,致生本病,故肝肾亏虚和慢性劳损是本病发病基础[7]。
壮骨关节丸是治疗退行性骨关节病的常用口服中药复方制剂。据现代中药药理学毒理研究提示,该方剂12味中药中至少已发现2种成分可造成实验动物(大鼠和豚鼠)的肝损害,如独活含有佛手柑内酯、欧芹酚甲醚、欧芹属乙素、异补骨脂素和花椒毒素等,可引起实验动物的肝毒损害。另1味中药淫羊藿给药3d,小鼠即出现呕吐、纳少、活动减少,给药15d处死,可见肝脏脂肪变性[8~10]。临床报道也是在肝损害方面最为突出,而且患者以老年人为主要人群。当然,单一成分的药理研究结果不能等同于方剂的作用,对于其引起肝损害不良反应的机制还有待于进一步研究。
病证结合动物模型既有西医疾病的特点,又有中医证候特征,它将有助于中药药理学研究和中药药效的评价,有利于更全面、客观地认识中药的科学内涵,对于探讨中药毒性与中医证候特征之间的关系,更是显示出较大的优势。由于中医存在着同病异治和异病同治的理论,岳美中指出“病者本也,体也;证者标也,象也;有病始有证,辨证方能识病,识病后可以施治”,因此临床中药使用过程中必须依据患者病因病机朔本求源、辨证施治,否则可能会因为药物应用不当而产生不良影响。本研究所采用的动物模型为病证结合模型,一定程度上能反映疾病的证候属性,减少了中医临床的随意性,使得中医临床辨病施治和辨证施治有证可循,这也将成为中医理论与现代科技结合的一个突破口,为中药临床研究提供了广阔的前景,所以采用对应病证结合动物模型评价中药药效和毒性更具有说服力。
脏器系数在药物的毒性反应中,作为1项常规检测指标,可为药物的评价提供参考。本次实验研究发现,脏器系数与正常对照组相比正常高倍量组胸腺、肝及肾上腺具有显著变化,而肾虚型骨性关节炎模型组胸腺、肝、肾变化明显,给药后却无显著差异,提示本药口服不会影响肾虚型骨性关节炎模型大鼠的饮食、体重及各主要器官的生长发育及组织形态,对这些方面无明显毒副作用。但是对于正常大鼠影响较大,且血清中 TBIL的含量对比说明,高倍量药物对于正常及骨性关节炎大鼠肝脏影响较为显著,由此说明对证施药在临床中的重要性。
《内经》云:“……有故无殒,亦无殒也。”中医传统理论强调中药药性毒性和“证”的密切关系,而目前中药毒理学研究采用正常动物研究中药毒性的方法恰恰忽略了这些方面。所谓“有病则病受之”,反之无病则体受之[11,12]。在没有病邪存在的情况下,中药的药性作用于正常机体就表现为毒性。而当我们采用证候动物模型时,其药性作用于病邪,可能表现的就是治疗作用,后者才能准确反映中药应用于临床的情况。但这种研究方法目前存在的最大问题,就在于中医证候动物模型的建设尚未形成一个完善的体系。有毒中药对不同状态、不同层次证候模型所产生的药物效应是有差异的,在评价中通过比较这些差异,可以为深入揭示其毒-效关系和发生机制提供科学依据[13]。因此,通过加强证候动物模型的建设来促进中药毒理学研究是必要的。
[1]谭勇,李健,吕诚,等.白附片对健康及肾阳虚模型大鼠心电图及心肌组织病理形态的影响[J].中国中医基础医学杂志,2011,(17)10:1080-1083.
[2]赵京涛,方斌,杨俊兴,等.补肾健骨中药对骨关节炎肾虚模型大鼠的PGE2及 E2的影响[J].临床和实验医学杂志,2006,5(7):912-913.
[3]Ashraf S,Mapp PI,Walsh DA.Contributions of angiogenesis to inflammation, jointdamage, and pain in a ratmodelof osteoarthritis[J].Arthritis Rheum,2011,63(9):2700-2710.
[4]Wen ZH,Tang CC,Chang YC,et al.Glucosamine sulfate reduces experimentalosteoarthritis and nociception in rats:association with changes of mitogen-activated protein kinase in chondrocytes[J].Osteoarthritis Cartilage,2010,18(9):1192-1202.
[5]谭勇,吕诚,赵宏艳,等.白附片对正常和肾阳虚大鼠血液生化指标的影响[J].中国中医药信息杂志,2010,17(1):31-33.
[6]刘亚萍,陈新军.前白蛋白、总胆汁酸、总胆红素测定在肝脏疾病中的应用[J].中国民族民间医药,2010,19(5):82,85.
[7]Wang Bin.Understanding and treating about pathogenesis of osteoarthritis in TCM[J].Clinical Journal of Chinese Medicine,2011,3(4):118.
[8]邓培媛,蔡皓东,程经华,等.壮骨关节丸致肝损害30例报告[J].中国新药杂志,1996,5(3):212-214.
[9]冉先德.中华药海[M].哈尔滨:哈尔滨出版社,1993:76.78.654.
[10]李广勋.中药药理毒理与临床[M].天津:天津科技翻译出版公司,1992:94.391.
[11]周宜,陈钢,夏丽娜,等.从《内经》“有故无陨”思想看中药毒性研究[J].中国中医基础医学杂志,2007,13(5):342:343.
[12]谭勇,李健,陈杲,等.白附子对正常和肾阳虚证大鼠毒性作用的差异[J].中医杂志,2011,52(14):1229-1232.
[13]谭勇,古洁乃特,吕诚,等.有毒中药安全性评价中的问题与对策[J].中国中医基础医学杂志,2009,15(9):696-697,699.
