单分散SiO2的焙烧温度对Rh基催化剂上CO加氢反应性能的影响
2012-11-30毛东森郭强胜韩璐蓬卢冠忠
俞 俊 毛东森 郭强胜 韩璐蓬 卢冠忠,*
(1华东理工大学工业催化研究所,上海200237;2上海应用技术学院应用催化研究所,上海201418)
单分散SiO2的焙烧温度对Rh基催化剂上CO加氢反应性能的影响
俞 俊1,2毛东森2,*郭强胜2韩璐蓬2卢冠忠1,2,*
(1华东理工大学工业催化研究所,上海200237;2上海应用技术学院应用催化研究所,上海201418)
在比较了分别以商业SiO2和采用Sto¨ber法制备的单分散SiO2为载体的Rh-Mn-Li/SiO2催化剂催化CO加氢反应性能的基础上,进一步调变了Sto¨ber法制备SiO2时的焙烧温度,并考察了其对Rh-Mn-Li/SiO2催化CO加氢性能的影响.利用N2吸附-脱附、傅里叶变换红外(FTIR)光谱、H2程序升温还原(H2-TPR)、程序升温表面反应(TPSR)等方法对载体及催化剂的物理化学性能进行了表征.结果表明:不同温度焙烧的载体表面具有不同的Si―OH数量,从而影响金属的分散状态及Rh和Mn之间的相互作用.载体表面较多的羟基有利于Rh的分散和CO的吸附,从而增强催化剂的反应活性.载体表面适当数量的羟基能够得到适中的Rh与Mn之间的相互作用,使催化剂具有合适的CO解离能力,有利于CHx的CO插入反应,从而提高了C2含氧化合物的选择性.
Rh-Mn-Li/SiO2;CO加氢;C2含氧化合物;焙烧温度
1 引言
乙醇、乙醛和乙酸等碳二(C2)含氧化合物均是重要的化工原料,而且乙醇还是理想的车用燃料及汽油添加剂.目前,C2含氧化合物都是以石油或粮食为原料生产的.近年来,随着原油价格的不断攀升以及粮食供应的日益短缺,促使人们寻求替代C2含氧化合物传统生产路线的方法.因此,进行从煤、天然气或生物质等经合成气制C2含氧化合物技术的研究开发,既有助于解决上述问题,又可以充分利用煤、天然气和生物质等资源.1此外,合成气一步制C2含氧化合物能在很大程度上简化现有的生产工艺,具有显著的经济效益.2因此,研制和开发具有工业应用前景的CO加氢制C2含氧化合物的催化剂具有重要的理论和实际意义.其中,以SiO2为载体的Rh基催化剂被认为是最具开发价值的一种催化剂.2-8
已有报道表明,很多学者对Rh/SiO2基催化剂的助催化剂进行了广泛而深入的研究,2-11但对载体SiO2的研究却相对较少.12-14虽然SiO2被公认为是一种相对惰性的载体,但其表面羟基的性质和数量会对其所负载金属的催化性能产生重要的影响.15,16此外,目前所研究的Rh/SiO2基催化剂中的SiO2大多限于商业产品,由于不同厂家所生产的SiO2的结构和杂质含量等显著不同,从而对催化剂的催化性能产生较大的影响.17为此,本文在比较了以商业SiO2和采用Stöber法18制备的单分散SiO2为载体的Rh-Mn-Li/SiO2催化剂催化CO加氢性能的基础上,考察了不同焙烧温度对单分散SiO2及其所制备的Rh-Mn-Li/SiO2催化剂所产生的影响.据我们所知,以单分散SiO2为载体的Rh基催化剂用于CO加氢反应制C2含氧化合物尚未见文献报道.
2 实验部分
2.1 催化剂的制备
利用Stöbor法18制备单分散SiO2载体,具体步骤如下:在15°C下将20%(φ)正硅酸四乙酯的乙醇溶液(50 mL)缓慢滴入76 mL氨水和210 mL无水乙醇的混合液中,磁力搅拌2 h后,陈化10 h.所得悬浊液离心分离,并用乙醇洗涤三次.所得产物在90°C干燥,最后分别在90、350和550°C焙烧4 h得到不同的SiO2载体,分别标记为SiO2(90),SiO2(350)和SiO2(550).用作比较的商业SiO2由青岛海洋化工有限公司提供,使用前在去离子水中煮沸24 h,过滤干燥,最后在550°C焙烧4 h,样品标记为SiO2(CM).
利用传统共浸渍法制备催化剂.将1 g载体等体积浸渍于RhCl3·xH2O、Mn(NO3)2和Li2CO3的混合水溶液中,室温晾干后分别于90和110°C干燥8和4 h,最后于350°C下焙烧4 h,得到不同的Rh-Mn-Li/SiO2催化剂,分别标记为RML/SiO2(CM)、RML/ SiO2(90)、RML/SiO2(350)和RML/SiO2(550),所有催化剂中Rh、Mn、Li的负载量(质量分数)均相同,分别为1.5%、1.5%和0.075%.上述所用试剂均为分析纯,RhCl3·xH2O由阿拉丁试剂(上海)有限公司提供,其余试剂由国药集团化学试剂有限公司生产.
2.2 催化剂的评价
催化反应在固定床反应器中进行.反应器是内径为5 mm的不锈钢管,气体流量由美国Brooks公司生产的5850E型质量流量计控制.催化剂用量为0.3 g,粒径为20-40目.反应前,催化剂于400°C用10%(φ,下同)的H2/N2混合气还原2 h,冷却至260°C后,切换成合成气(V(H2)/V(CO)=2),缓慢升压和升温至3.0 MPa和300°C,待反应稳定后(8 h)取样分析,用惠普上海分析仪器有限公司生产的带有自动进样阀的Agilent 6820型气相色谱仪进行在线分析. CO、CO2和H2经过TDX-01碳分子筛填充柱分离后,用热导池检测器(TCD)检测;烃类及含氧化合物经过PLOT-Q毛细管柱分离后,用氢火焰离子化检测器(FID)检测.为防止产物的冷凝,用加热带将反应器出口至色谱仪进样口之间的所有管路均保温至150°C以上.19
2.3 催化剂的表征
采用日本日立公司生产的Hitachi S-4000型扫描电镜(SEM)观察载体的形貌特征及晶粒大小.催化剂的形貌及Rh颗粒分布情况由日本电子公司生产的JEM-2100透射电镜(TEM)观测,加速电压为200 kV.样品的晶相结构采用XRD测试,在荷兰帕纳科公司生产的XʹPert PRO PW3040/60型X射线衍射仪上进行,Cu Kα射线,Ni滤波片,电压40 kV,电流40 mA,扫描范围2θ=10°-70°,扫描速率4(°)· min-1.样品的比表面积、孔容和孔径的测定在美国麦克公司生产的ASAP 2020 M+C多功能自动物理化学吸脱附仪上进行.测定前,样品于100°C真空脱气10 h.然后在液氮温度(-196°C)下以氮为吸附质进行测定.
利用美国热电公司生产的Nicolet 6700型智能红外光谱仪分析载体的表面结构,并对催化剂进行原位红外漫反射表征.催化剂首先在10%的H2/N2混合气(气体流速30 mL·min-1)中于400°C预处理2 h后降至室温,接着抽真空至系统真空度达到10-3Pa,并扫描背景.然后通入相应压力的CO气体并采集红外图谱.为了排除干扰,使用纯度大于99.997%的高纯CO气体,并且再经过脱水、脱氧装置进一步净化气体.在所有实验中,红外光谱的分辨率为4 cm-1,扫描次数为64次.
H2程序升温还原(H2-TPR)实验在常压微型石英反应器中进行,催化剂用量为50 mg,在20%的O2/ N2(气体流速50 mL·min-1,下同)气氛下程序升温(升温速率为10°C·min-1)至350°C并维持1 h.降温至30°C后切换成10%的H2/N2混合气,待基线平稳后,以10°C·min-1的速率升温至650°C,尾气经TCD检测.
程序升温表面反应(TPSR)同样在常压微型石英反应器中进行,催化剂用量为100 mg.催化剂首先在10%的H2/He混合气中于400°C还原2 h后,继续在He气氛中吹扫30 min.然后降温至30°C,CO吸附30 min后再切换成10%的H2/He混合气,待基线走平,以10°C·min-1的速率升温至650°C,尾气由德国Pfeiffer公司生产的OmniStar 200型质谱仪检测.
3 结果与讨论
3.1 RML/SiO2(CM)与RML/SiO2(550)催化性能
的比较
在完全相同的反应条件下,RML/SiO2(CM)与 RML/SiO2(550)催化CO加氢反应性能见表1.由此可见,以Stöber法制备的单分散SiO2为载体的Rh-Mn-Li/SiO2催化剂比商业SiO2为载体的相应催化剂具有更高的CO转化率和C2+含氧化合物选择性,从而使其C2+含氧化合物的时空收率较后者提高了158%.为此,下文通过对Stöber法制备SiO2的焙烧温度进行调变,以进一步提高Rh基催化剂的CO转化率和C2+含氧化合物的选择性.
3.2 载体焙烧温度对Rh-Mn-Li/SiO2催化剂上CO加氢反应性能的影响
表2给出了以不同温度焙烧的SiO2为载体所制备的Rh-Mn-Li/SiO2催化剂上CO加氢反应的性能.可以看出,随着载体焙烧温度的升高,催化剂上的CO转化率逐渐下降.90°C焙烧载体制得的催化剂上的CO转化率高达23.3%,而载体经550°C焙烧后催化剂上的CO转化率仅为13.7%,下降了41.2%.此外,三种催化剂上C2+含氧化合物的选择性大小顺序为RML/SiO2(350)>RML/SiO2(550)>RML/SiO2(90),而C2+烃类的选择性大小顺序恰好与之相反.综合比较三种催化剂的反应性能可以看出,以350°C焙烧的SiO2为载体制备的Rh-Mn-Li/SiO2催化剂具有适中的CO转化率和最高的C2+含氧化合物选择性,从而使C2+含氧化合物的时空收率达到最大(308.1 g· kg-1·h-1).
3.3 样品的形貌、织构和结构表征
为了探明载体焙烧温度不同所导致的Rh-Mn-Li/SiO2催化性能差异的内在原因,我们对载体和催化剂的形貌、织构和结构进行了表征.图1给出了利用Stöbor法制备、经不同温度焙烧的SiO2样品的SEM照片.可以看出,利用Stöbor法制备的SiO2均为单分散的球形,平均颗粒直径在800 nm左右.此外,随着焙烧温度的升高,SiO2球体表面羟基进一步缩合完全,因此球体形貌逐渐变得规整且表面光滑.
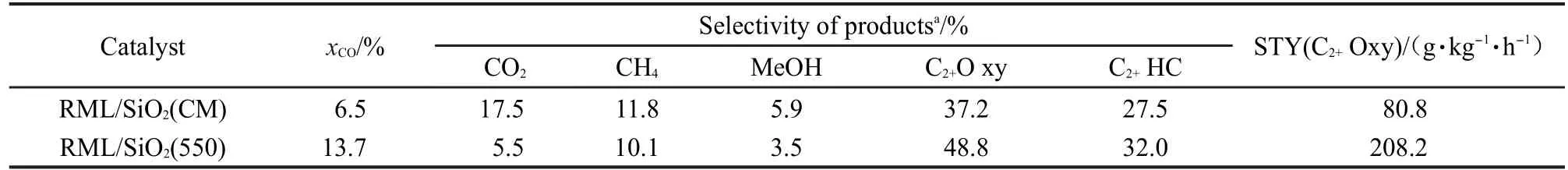
表1 RML/SiO2(CM)与RML/SiO2(550)催化剂上的CO加氢反应性能Table 1 Performances for CO hydrogenation on RML/SiO2(CM)and RML/SiO2(550)catalysts
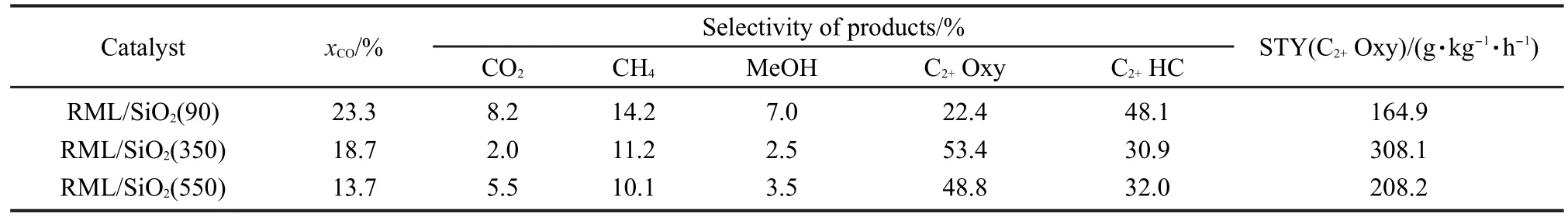
表2 不同Rh-Mn-Li/SiO2催化剂上的CO加氢反应性能Table 2 Performances for CO hydrogenation over different Rh-Mn-Li/SiO2catalysts

图1 使用Sto¨ber法经不同温度焙烧的SiO2载体的SEM照片Fig.1 SEM images of SiO2supports bySto¨bermethod at different calcination temperatures (a)SiO2(90);(b)SiO2(350);(c)SiO2(500)

图2 不同Rh-Mn-Li/SiO2催化剂的TEM照片Fig.2 TEM images of different Rh-Mn-Li/SiO2catalysts(A)RML/SiO2(90);(B)RML/SiO2(550)
图2为由两种不同温度焙烧的SiO2为载体所制备的Rh-Mn-Li/SiO2催化剂的TEM照片.如图所示, SiO2载体均为实心球体,与SEM结果一致.比较两种样品上Rh粒子的负载情况可以看出,RML/SiO2
(90)表面Rh粒子的大小较为均匀,分布较窄,分散度相对更高;而RML/SiO2(550)表面Rh粒子的分布较宽,分散度相对较低.
表3给出了各载体及相应Rh基催化剂的比表面积、孔径和孔容的数据.从比表面积数据看出, SiO2(90)与其他样品有着截然不同的结果,其SBET达到了268.3 m2·g-1,平均孔径只有2.2 nm.而无论是其制得的催化剂,还是其它350或550°C焙烧的载体及其所制得的催化剂,均保持了比较相近的较小的比表面积和较大的孔径.推测其原因可能是SiO2
(90)表面Si―OH缩合不完全,表面富集着大量的微小孔道,因此比表面积大、孔径小.而当其经350或550°C焙烧后,表面Si―OH缩合相对完全,因此其余样品均形成了比表面积较小(10.9-13.4 m2· g-1),孔径较大(6.7-9.3 nm)的结构.在相关工作中, Szekeres20和Hsu21等的研究结果也表明,采用Stöbor法制备的SiO2比表面积较小,均在10 m2·g-1左右.同时,比较各催化剂的XRD谱图发现,所有催化剂均未出现Rh及其它金属的衍射峰(图略),表明Rh及其它金属高度分散在催化剂表面.
将催化剂的反应性能(表2)与其织构性能(表3)进行关联可以发现,由不同SiO2所制备的Rh-Mn-Li/SiO2催化性能之间存在很大的差异,而其比表面积、孔容及孔径均相差很小,表明催化剂的比表面积、孔容及孔径与其催化性能之间并没有直接的关系,因此它们不是决定催化剂性能差异的主要因素,这与罗洪原等17的结论相一致.
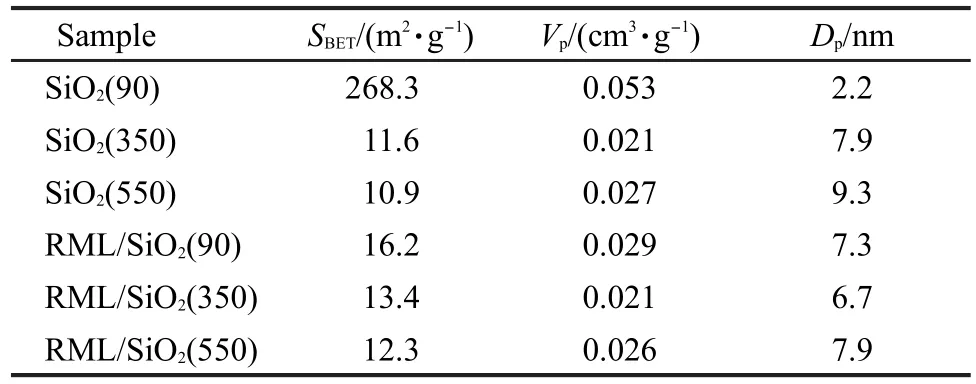
表3 载体及催化剂的比表面积(SBET)、孔容(Vp)和孔径(Dp)Table 3 Specific surface area(SBET),pore volume(Vp),and pore diameter(Dp)of the supports and the corresponding catalysts
为了进一步研究焙烧温度对载体表面所产生的影响,我们对其表面结构进行了红外光谱研究.如图3所示,随着焙烧温度的升高,3600-3000 cm-1及950 cm-1这两处的吸收峰均逐渐减弱,尤其是当焙烧温度升高至550°C时,950 cm-1吸收峰已完全消失.一般认为,3600-3000 cm-1吸收峰是吸附水及表面羟基的振动吸收,而950 cm-1归属于Si―OH的伸缩振动峰.22上述结果表明,低温焙烧时载体表面含有丰富的Si―OH,而经高温(550°C)焙烧后载体表面的Si―OH则会缩合完全.此外,仔细比较载体及其相应催化剂的IR光谱(图3(a)和(b))可以发现,浸渍Rh、Mn和Li后,载体表面的羟基数量有所减少,表明金属是通过与载体表面的羟基相互作用而固定在表面上的.12
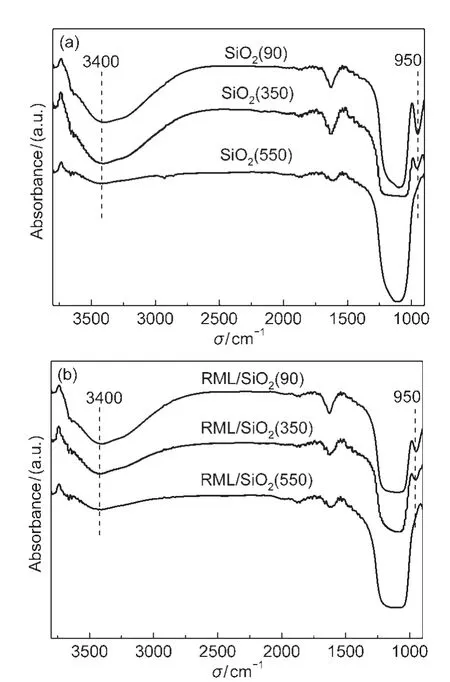
图3 样品的FTIR谱Fig.3 FTIR spectra of the samples(a)SiO2supports;(b)Rh-Mn-Li/SiO2catalysts
许多学者12-14认为,载体表面的羟基与Rh、Mn等有着较强的相互作用,从而影响其分散状态和各组分之间的相互作用.结合不同催化剂反应性能间的差异,我们有理由推断,焙烧温度改变所带来的载体表面羟基及SiO2结构的变化可能是引起Rh-Mn-Li/SiO2催化剂性能差异的内在因素.
3.4 催化剂上CO吸附的红外光谱表征
三种催化剂吸附CO的漫反射红外吸收光谱见图4.如图所示,三种催化剂均在2070、2104和2030 cm-1出现三个大小不等的吸收峰.一般认为,2070 cm-1左右的吸收峰对应于线式吸附态CO的伸缩振动,而2104和2030 cm-1这一对肩峰可分别归属于孪式吸附态CO的对称和反对称伸缩振动.14,23由图可以发现,随着载体焙烧温度的升高,催化剂各个吸收峰的强度均减弱,表明催化剂上CO的吸附能力随载体焙烧温度的升高而逐渐减弱,而CO吸附能力的强弱直接与催化剂的活性有关,三种催化剂上CO的转化率有效地证明了这一点.另外,随载体焙烧温度的不断升高,催化剂上孪式吸附的CO所占的比例逐渐下降.Mo等24认为,孪式吸附形成于相对孤立的Rh+中心上,而线式吸附形成于Rh0中心上.同时,Basu等25认为表面羟基的存在有利于氧化Rh0的金属簇得到Rh+.因此结合载体的表面骨架红外信息可以推断,表面羟基存在两种作用.一是有利于金属在载体表面的分散,从而提高了催化剂对CO的吸附能力,此结论与TEM结果(图2)相一致.事实上,陈建刚等15在研究不同硅胶载体对费托(F-T)合成Co/SiO2催化剂的影响时也发现,SiO2表面羟基的多寡会影响金属的分散度,从而对其催化性能产生影响,此结论与本文的结果相一致.二是能与金属Rh结合使其转变成Rh+,从而有利于孪式吸附态CO的形成.
3.5 催化剂的TPSR表征
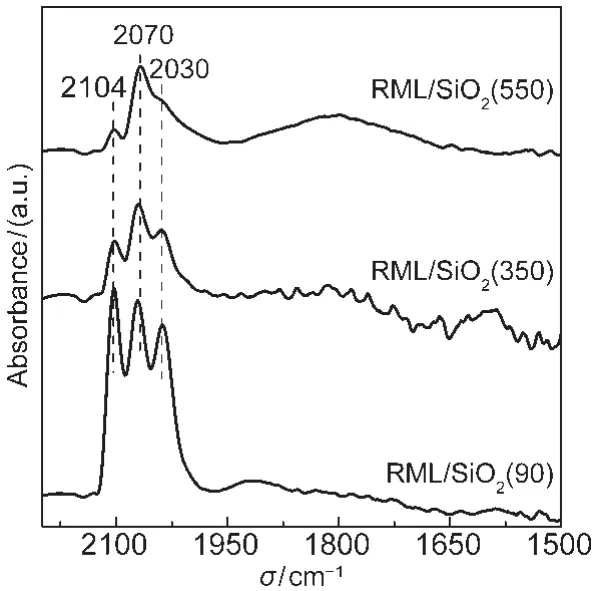
图4 CO在不同催化剂上吸附的FTIR光谱Fig.4 FTIR spectra of CO adsorbed on different catalysts
由于解离的CO在Rh基催化剂上加氢生成CH4的速率非常快,所以CH4的生成是表征催化剂催化CO解离能力的有效工具.图5给出了三种不同催化剂吸附CO后,在H2存在条件下程序升温反应过程中CH4的生成曲线.由图可以看出,RML/SiO2(90)和RML/SiO2(550)催化剂的CH4峰的峰温相近(约240°C),但均略低于RML/SiO2(350)催化剂CH4峰的峰温(250°C).此外,三种不同催化剂的CH4峰的面积相差较大,其大小顺序为RML/SiO2(90)>RML/ SiO2(550)>RML/SiO2(350).上述结果表明三种催化剂的CO解离能力大小为:RML/SiO2(90)>RML/SiO2
(550)>RML/SiO2(350).
由CO加氢生成含氧化合物及烃类的反应机理可知,吸附的CO首先解离成C,然后加氢生成含氧化合物和烃类的共同中间体CHx.该中间体直接加氢可得到甲烷;若插入CO可生成含氧化合物的前驱体CHxCO,再加氢得到含氧化合物;如果插入CHx则发生碳链的增长,进一步加氢得到高碳烃类.通常认为,CHx加氢生成烃类和CO插入生成C2含氧化物是相互竞争的反应,它们之间反应速率的相对大小决定了C2含氧化合物的生成活性和选择性.26因此,要保持较高的C2含氧化合物生成活性则需要适中的CO解离能力.结合催化剂的反应性能(表2),我们推断正是因为RML/SiO2(350)催化剂适中的CO解离活性更有利于CO插入反应的进行,从而得到了相对最高的C2含氧化合物选择性和最低的烃类选择性.
3.6 催化剂的H2-TPR表征
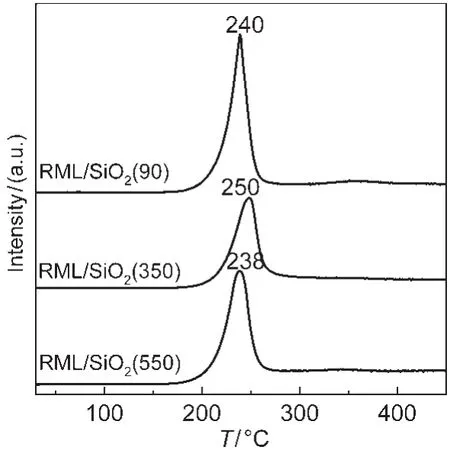
图5 不同催化剂上生成CH4的TPSR谱Fig.5 TPSR profiles of different catalysts for CH4 formation
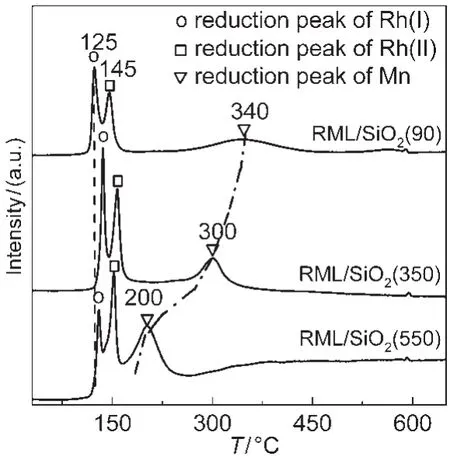
图6 不同催化剂的H2-TPR谱Fig.6 H2-TPR profiles of different catalysts
图6给出了三个不同催化剂的H2-TPR谱.由图可见,在不同催化剂上均出现了三个明显的还原峰.根据丁云杰及其合作者23,27的研究结果可知,高温峰为Mn氧化物的还原峰,两个低温峰分别归属于两种不同Rh氧化物的还原.根据温度由低到高可区分为Rh(I)和Rh(II)的氧化物,而Rh(II)氧化物与Mn有着更强的相互作用.由图可见,随载体焙烧温度的升高,Mn氧化物的还原峰不断向低温方向移动并逐渐增强,同时与Mn有着强相互作用的Rh(II)氧化物还原峰的比例不断增大.
大量研究结果表明,在Rh催化剂中加入Mn后,Rh氧化物的还原峰温度升高,而Mn氧化物的还原峰温度降低,10,27,28由此可根据Rh和Mn的氧化物还原峰之间的温度差来判断催化剂中Rh和Mn之间相互作用的强弱:还原峰之间的温度差越小表明Rh和Mn之间的相互作用越强.上述H2-TPR表征结果表明,随载体焙烧温度的不断升高,催化剂中Rh与Mn的相互作用逐渐增强.结合前述载体表面的红外分析结果可以推断,低温焙烧的SiO2表面残留了较多的Si―OH,这些羟基有利于金属在载体表面的分散并阻隔了Rh与Mn的相互接触,使得Rh与Mn之间的相互作用减弱.随载体焙烧温度的不断升高,SiO2表面的Si―OH量逐渐减少,从而使得Rh与Mn之间的相互作用增强.
综合上述CO-IR、TPSR和H2-TPR的表征结果,我们发现,当载体的焙烧温度太低(90°C)时,由于Rh与Mn之间的相互作用太弱,Mn的助催化效果较差,导致C2含氧化合物的选择性较低.而当载体的焙烧温度太高(550°C)时,由于Rh与Mn之间的相互作用太强,Mn氧化物在还原过程中会覆盖在活性金属颗粒的表面,导致催化剂的CO吸附能力下降,从而使得催化剂的活性较低.29只有当载体的焙烧温度适中(350°C)时,由于Rh与Mn之间的相互作用适中,不仅有利于发挥Mn的助催化作用,又能得到适中的CO吸附和解离能力,有利于CO插入反应的发生,从而得到较高的反应活性和C2含氧化合物的选择性,最终得到最高的C2含氧化合物收率.陈维苗等30在研究干燥时间对Rh-Mn-Li-Ti/SiO2催化性能的影响时也强调,当Rh和Mn之间的相互作用处于适当的强度时才可得到较高的催化性能,这与本文的结论是一致的.
4 结论
通过改变载体的焙烧温度可有效调节SiO2表面的Si―OH数量,从而改变金属在载体表面的分散状态及Rh与Mn之间的相互作用大小.CO原位吸附红外光谱表征结果表明,载体表面羟基的增多有利于Rh的分散和对CO的吸附,从而增强Rh-Mn-Li/SiO2催化剂的反应活性.结合TPSR和H2-TPR研究结果进一步表明,载体表面适当数量的羟基能得到适中的Rh、Mn相互作用,使催化剂得到合适的CO解离性能,有利于CHx的CO插入反应,最终提高C2含氧化合物的选择性.
(1) Ye,T.Q.;Zhang,Z.X.;Xu,Y.;Yan,S.Z.;Zhu,J.F.;Liu,Y.;Li, Q.X.Acta Phys.-Chim.Sin.2011,27,1493.[叶同奇,张朝霞,徐 勇,颜世志,朱九方,刘 勇,李全新.物理化学学报, 2011,27,1493.]
(2) Li,J.W.;Ding,Y.J.;Lin,R.H.;Gong,L.F.;Song,X.G.; Chen,W.M.;Wang,T.;Luo,H.Y.Chin.J.Catal.2010,31, 365.[李经伟,丁云杰,林荣和,龚磊峰,宋宪根,陈维苗,王 涛,罗洪原.催化学报,2010,31,365.]
(3)Wang,Y.;Song,Z.;Ma,D.;Luo,H.Y.;Liang,D.B.;Bao,X.H. Chin.J.Catal.1998,19,533. [王 毅,宋 真,马 丁,罗洪原,梁东白,包信和.催化学报,1998,19,533.]
(4) Lin,P.Z.;Liang,D.B.;Luo,H.Y.;Xu,C.H.;Zhou,H.W.; Huang,S.Y.;Lin,L.W.Appl.Catal.A 1995,131,207.
(5)Wang,Y.;Luo,H.Y.;Liang,D.B.;Bao,X.H.J.Catal.2000, 196,46.
(6)Yin,H.M.;Ding,Y.J.;Luo,H.Y.;Xiong,J.M.;He,D.P.; Wang,T.;Lin,L.W.Chin.J.Catal.2002,23,352.[尹红梅,丁云杰,罗洪原,熊建民,何代平,王 涛,林励吾.催化学报, 2002,23,352.]
(7) Chuang,S.S.C.;Stevens,R.W.,Jr.;Khatri,R.Top.Catal. 2005,32,225.
(8) Chen,W.M.;Ding,Y.J.;Jiang,D.H.;Yan,L.;Wang,T.;Zhu, H.J.;Luo,H.Y.Chin.J.Catal.2006,27,1059.[陈维苗,丁云杰,江大好,严 丽,王 涛,朱何俊,罗洪原.催化学报,2006, 27,1059.]
(9) Gao,J.;Mo,X.H.;Chien,A.C.;Torres,W.;Goodwin,J.G.,Jr. J.Catal.2009,262,119.
(10) Haider,M.A.;Gogate,M.R.;Davis,R.J.J.Catal.2009,261,9.
(11) Mo,X.H.;Gao,J.;Umnajkaseam,N.;Goodwin,J.G.,Jr. J.Catal.2009,267,167.
(12) Ma,H.T.;Wang,Y.;Bao,X.H.Acta Sci.Nat.Univ.Pekinensis 2001,37,210.[马洪涛,王 毅,包信和.北京大学学报(自然科学版),2001,37,210.]
(13) Chen,W.M.;Ding,Y.J.;Jiang,D.H.;Pan,Z.D.;Luo,H.Y. Catal.Lett.2005,104,177.
(14) Jiang,D.H.;Ding,Y.J.;Pan,Z.D.;Chen,W.M.;Luo,H.Y. Catal.Lett.2008,121,241.
(15) Chen,J.G.;Xiang,H.W.;Sun,Y.H.Chin.J.Catal.2000,21, 169.[陈建刚,相宏伟,孙予罕.催化学报,2000,21,169.]
(16) Qu,Z.P.;Huang,W.X.;Zhou,S.T.;Zheng,H.;Liu,X.M.; Cheng,M.J.;Bao,X.H.J.Catal.2005,234,33.
(17) Luo,H.Y.;Yin,H.M.;Ding,Y.J.;Lin,L.W.Petroch.Technol. 2004,33,194.[罗洪原,尹红梅,丁云杰,林励吾.石油化工, 2004,33,194.]
(18) Stöber,W.;Fink,A.;Bohn,E.J.Colloid Interface Sci.1968,26, 62.
(19) Mao,D.S.;Guo,Q.S.;Yu,J.;Han,L.P.;Lu,G.Z.Acta Phys.-Chim.Sin.2011,27,2639.[毛东森,郭强胜,俞 俊,韩璐蓬,卢冠忠.物理化学学报,2011,27,2639.]
(20) Szekeres,M.;Kamalin,O.;Grobet,P.G.;Schoonheydt,R.A.; Wostyn,K.;Clays,K.;Persoons,A.;Dkénáy,I.Colloids Surf. A:Physicochem.Eng.Aspects 2003,227,77.
(21) Hsu,W.P.;Yu,R.C.;Matijevic,E.J.Colloid Interface Sci. 1993,156,56.
(22) Zhang,L.;Xu,Y.;Huang,Z.X.High Power Laser and Particle Beams 2005,17,669.[张 磊,徐 耀,黄祖鑫.强激光与粒子束,2005,17,669.]
(23) Yin,H.M.;Ding,Y.J.;Luo,H.Y.;Zhu,H.J.;He,D.P.;Xiong, J.M.;Lin,L.W.Appl.Catal.A 2003,243,155.
(24) Mo,X.H.;Gao,J.;Goodwin,J.G.,Jr.Catal.Today 2009,147, 139.
(25) Basu,P.;Panayotov,D.;Yates,J.T.J.Phys.Chem.1987,91, 3133.
(26) Chen,W.M.;Ding,Y.J.;Jiang,D.H.;Jiao,G.P.;Zhu,H.J.; Pan,Z.D.;Luo,H.Y.Chin.J.Catal.2006,27,999.[陈维苗,丁云杰,江大好,焦桂萍,朱何俊,潘振栋,罗洪原.催化学报, 2006,27,999.]
(27) Jiang,D.H.;Ding,Y.J.;Pan,Z.D.;Li,X.M.;Jiao,G.P.;Li,J. W.;Chen,W.M.;Luo,H.Y.Appl.Catal.A 2007,331,70.
(28) Ojeda,M.;Granados,M.L.;Rojas,S.;Terreros,P.;Garcia-Garcia,F.J.;Fierro,J.L.G.Appl.Catal.A 2004,261,47.
(29) Luo,H.Y.;Xie,S.B.;Lin,L.W.;Liang,D.B.Chin.J.Catal. 1995,16,136.[罗洪原,谢水波,林励吾,梁东白.催化学报, 1995,16,136.]
(30) Chen,W.M.;Ding,Y.J.;Luo,H.Y.;Yan,L.;Wang,T.;Pan,Z. D.;Zhu,H.J.Chin.J.Appl.Chem.2005,22,470.[陈维苗,丁云杰,罗洪原,严 丽,王 涛,潘振栋,朱何俊.应用化学, 2005,22,470.]
October 11,2011;Revised:December 1,2011;Published on Web:December 22,2011.
Effect of Calcination Temperature of Monodispersed SiO2on the Performance of Rh-Based Catalysts for CO Hydrogenation
YU Jun1,2MAO Dong-Sen2,*GUO Qiang-Sheng2HAN Lu-Peng2LU Guan-Zhong1,2,*
(1Research Institute of Industrial Catalysis,East China University of Science and Technology,Shanghai 200237,P.R.China;2Research Institute of Applied Catalysis,Shanghai Institute of Technology,Shanghai 201418,P.R.China)
Based on a comparison of catalytic performances of Rh-Mn-Li/SiO2catalysts,in which commercial SiO2and monodispersed SiO2synthesized by theSto¨bermethod were used as the support, respectively,the effect of the calcination temperature of the synthesized SiO2on the catalytic performance of Rh-Mn-Li/SiO2for CO hydrogenation to C2oxygenates was investigated.Fourier transform infrared spectroscopy,N2adsorption-desorption,temperature-programmed reduction with hydrogen(H2-TPR),and temperature-programmed surface reaction(TPSR)were used to characterize the physico-chemical properties of the SiO2supports and the corresponding catalysts.The results showed that the number of surface Si―OH groups on the SiO2supports affected the dispersion of metal and the interaction between Rh and Mn.Large amount of surface Si―OH groups was favorable for the dispersion of Rh particles and CO adsorption,and enhanced the activity of the catalyst.An appropriate amount of Si―OH groups can gain moderate interaction between the Rh and Mn.This interaction is conducive to achieve the right CO dissociation ability,which is favorable for the insertion of CO to CHx,and ultimately increases the selectivity of C2oxygenates.
Rh-Mn-Li/SiO2;CO hydrogenation;C2oxygenate;Calcination temperature
10.3866/PKU.WHXB201112221
O643
∗Corresponding authors.MAO Dong-Sen,Email:dsmao@sit.edu.cn;Tel:+86-21-60877221.LU Guan-Zhong,Email:gzhlu@ecust.edu.cn;
Tel:+86-21-64945020.
The project was supported by the Science and Technology Commission of Shanghai Municipality,China(08520513600),LeadingAcademic
Discipline Project of Shanghai Education Committee,China(J51503),and Shanghai Special Fund for OutstandingYoung Teachers,China(yyy10083).
上海市科委(08520513600),上海市教委重点学科建设(J51503)和上海市优秀青年教师专项基金(yyy10083)资助项目
