染料敏化太阳能电池用琼脂糖基磁性聚合物电解质的电化学性能
2012-11-30郭学益易鹏飞王惟嘉
郭学益 易鹏飞 王惟嘉 杨 英
(中南大学冶金科学与工程学院,长沙410083)
染料敏化太阳能电池用琼脂糖基磁性聚合物电解质的电化学性能
郭学益 易鹏飞 王惟嘉 杨 英*
(中南大学冶金科学与工程学院,长沙410083)
以琼脂糖为聚合物基质,N-甲基吡咯烷酮为溶剂,磁性纳米粒子四氧化三铁为无机纳米颗粒添加剂制备了用于染料敏化太阳能电池(DSSC)的磁性聚合物电解质.通过研究不同小分子表面活性剂,聚乙二醇(PEG200)、曲拉通(Triton X-100)、乙酰丙酮和三者混合的表面活性剂对掺杂有1%(w)Fe3O4的磁性聚合物电解质离子电导率的影响,发现PEG200的加入可有效提高琼脂糖基磁性聚合物电解质的离子电导率.同时,对不同PEG200浓度添加下的电解质进行离子电导率测试研究发现:当PEG200加入量为61.8%(w)时,电解质具有最佳的离子电导率(2.88×10-3S·cm-1);对染料敏化太阳能电池进行电化学交流阻抗谱(EIS)测试的结果表明:染料敏化太阳能电池的电子寿命和复合电阻随着PEG200浓度的增加是先增大后减小,最大的电子寿命和复合电阻出现在PEG200浓度为68.3%(w)处.
磁性聚合物电解质;琼脂糖;纳米Fe3O4;PEG200;染料敏化太阳能电池
1 引言
染料敏化太阳能电池(DSSC)是一种新型的太阳能电池,这种电池工艺简单,原材料丰富,制作成本低(仅为硅太阳能电池的1/5-1/10),能耗少,在大面积工业化生产中具有较大的优势.1-3同时部分材料可以得到充分的回收,对保护环境具有重要的意义.
电解质在染料敏化太阳能电池中主要起再生染料和传输空穴的作用,并且对电池体系的热力学和动力学特性以及电池的光电性能有很大影响.4目前得到光电转化效率最高的是液体电解质,光电转化效率可达10%-12.7%,2,5但液态电解质存在着有机溶剂易挥发、封装难、易泄漏及长期稳定性差等问题,使其很难广泛应用和商业化.6使用聚合物电解质是解决液态电解质密封和稳定性等问题的有效途径之一.聚合物电解质有着较低的蒸汽压,与纳米电极和对电极之间有良好的收缩和填充性能,并有较高的离子导电率和良好的热稳定性.7因此它被广泛地运用在染料敏化太阳能电池中.Lan等8采用PAA-PEG作为聚合物固体基质得到效率为5.25%的电池;Wu等9研究开发一种新的热塑型准固态聚合物电解质体系用于DSSC,其效率可达到7.22%.
在聚合物体系中添加无机纳米颗粒一直以来被认为是提高聚合物电解质体系离子电导率的有效方法.10,11因为无机纳米颗粒的表面活性很大,其表面含有丰富的羟基,这使得它可以与聚合物基质当中的各个成分形成氢键连接而成为电解质体系的固态骨架结构;同时纳米粒子的加入可以显著地增加聚合物的非晶性,有利于离子的传输,提高电解质体系离子电导率.12本文选择磁性纳米Fe3O4颗粒作为琼脂糖聚合物电解质体系的无机添加剂,纳米Fe3O4不同于传统的无机纳米颗粒,由于其本身的磁性,在外加磁场的作用下纳米Fe3O4与聚合物结合所形成的磁性聚合物会产生定向排列,离子电导率将会显著提高,13,14不仅如此,磁场作用下定向排列的磁性聚合物电解质具有比无序聚合物电解质更低的界面电阻以及更好的填充性能.
由于纳米Fe3O4颗粒粒径小,表面能大,易发生团聚,影响它在聚合物中的均匀分散.因此,为了增加纳米Fe3O4颗粒与聚合物的界面结合力,提高纳米Fe3O4颗粒的分散能力,需要对纳米Fe3O4颗粒的表面进行改性,加入表面活性剂能使纳米Fe3O4颗粒的表面能态降低,消除纳米Fe3O4颗粒的表面电荷,提高纳米Fe3O4颗粒与有机相的亲和力,减弱粒子的表面极性,15-18使得纳米Fe3O4颗粒在聚合物体系里保持稳定,不易出现聚沉、团聚,从而有效地提高聚合物电解质的性能.
本文尝试了四种不同的表面活性剂:聚乙二醇(PEG200)、曲拉通(Triton X-100)、乙酰丙酮和三者混合的表面活性剂.将其加入1%(w)的磁性纳米Fe3O4颗粒掺杂的琼脂糖基聚合物电解质中,通过电化学性能的测试找到最适合此体系的表面活性剂.同时改变Fe3O4纳米颗粒掺杂的琼脂糖聚合物电解质中分散剂聚乙二醇(PEG200)的浓度,考察了不同PEG200浓度对磁性聚合物电解质离子电导率及其相应染料敏化太阳能电池电化学性能的影响.
2 实验部分
2.1 实验试剂
TiO2(P25,20-30 nm,Degussa AG),导电玻璃(30 Ω·□-1,FTO),染料(N719,苏州中晟化工有限公司),纳米Fe3O4(99.5%,20 nm,Aladdin Chemistry Co.Ltd);琼脂糖(AG,分子量:3000-5000,生化试剂)、N-甲基吡咯烷酮(NMP,化学纯)、聚乙二醇(PEG200,化学纯)均为上海国药集团化学试剂有限公司产品;碘化锂(LiI,99%,Acros Organics);碘(I2,分析纯,湖南汇虹试剂有限公司);曲拉通(Triton X-100,化学纯,汕头市西陇化工厂);乙酰丙酮(分析纯,天津市福晨化学试剂厂).
2.2 磁性聚合物电解质溶液的制备
根据已有研究结果[3],按多元Logistic回归模型中样本容量的计算方法,利用2013年第五次国家卫生服务调查重庆农村地区的相关数据,失访率为50%,计算样本容量为270例。实际共抽糖尿病患者496例。利用Epidata录入问卷调查数据,数据整理和分析采用统计工具软件Stata 11.0。
2.2.1 不同表面活性剂改性下磁性聚合物电解质溶液的制备
将2%(w)的琼脂糖加入5 gN-甲基吡咯烷酮中在80°C恒温水浴下磁力搅拌4 h,之后加入0.034 g的LiI和0.0018 g的I2到以上体系,在常温下磁力搅拌4 h,制成琼脂糖基聚合物电解质体系.向聚合物电解质体系中加入不同小分子表面活性剂各0.1 mL,分别为空白、PEG200、曲拉通、乙酰丙酮和混合活性剂(0.04 mL PEG200,0.03 mL曲拉通和0.03 mL乙酰丙酮),常温磁力搅拌4 h.最后,加入1%(w)的纳米Fe3O4颗粒,超声分散2 h(KQ-700DE数控超声清洗器,昆山市超声仪器有限公司),得到不同表面活性剂改性的琼脂糖基磁性聚合物电解质溶液.
2.2.2 不同PEG200浓度添加下磁性聚合物电解质溶液的制备
将2%(w)的琼脂糖加入5 g N-甲基吡咯烷酮中在80°C恒温水浴下磁力搅拌4 h,之后加入0.034 g的LiI和0.0018 g的I2到以上体系在常温下磁力搅拌4 h,制成琼脂糖基聚合物电解质体系.然后,向以上溶液体系中加入不同含量的PEG200,分别为0、0.05、0.1、0.15、0.2、0.25 mL(含量分别为0%、35.0%、 52.1%、61.8%、68.3%、72.9%(w,下同),计算公式为: mPEG200/(mAG+mPEG200+mFe3O4),常温磁力搅拌4 h.最后,加入1%的纳米Fe3O4颗粒,超声分散2 h(KQ-700DE数控超声清洗器,昆山市超声仪器有限公司),得到不同含量PEG200改性的琼脂糖基磁性聚合物电解质溶液.
2.3 表征方法
2.3.1 磁性聚合物电解质表面形貌的扫描电镜(SEM)测试
不同PEG200浓度添加下的磁性聚合物电解质的表面形貌是通过JSM-6360LV高低真空扫描电镜(SEM)(日本电子)来观测的.扫描电镜测试下聚合物电解质膜样的制备:在载玻片上滴加配置好的电解质溶液,放入烘箱在80°C下烘4 h.得到电解质膜,放入干燥器中.
2.3.2 磁性聚合物电解质的离子电导率的测试
琼脂糖基聚合物电解质的离子电导率测试是在电化学工作站CHI604D(上海辰华仪器有限公司)上在室温下完成的,频率范围为10 Hz-1 MHz,扰动电压为10 mV.离子电导率测试的样品制备如下:在Pt电极上滴加配置好的聚合物电解质溶液,放入烘箱,80°C下烘烤一定时间至电解质变粘稠,之后将另一块Pt电极盖在上面,用夹子夹紧,放入烘箱80°C下烘2 h.取出放入干燥器中,待测.
离子电导率可以通过以下公式进行计算:

其中,L是聚合物电解质膜的厚度;A是电解质膜接触到铂电极的面积;Rb是聚合物电解质的体电阻.
2.3.3 染料敏化太阳能半电池交流阻抗的测试
为了更直接地了解不同浓度PEG200改性的磁性琼脂糖电解质对染料敏化太阳能电池内部TiO2/电解质界面,以及对光阳极TiO2内部电子输运的影响,我们将一系列磁性聚合物电解质滴加到未敏化的TiO2光阳极上,烘烤后加盖对电极制成未敏化的电池进行电化学交流阻抗测试.我们将未敏化的电池定义为半电池.不同小分子改性的染料敏化太阳能电池的电化学交流阻抗(EIS)测试是在电化学工作站CHI604D上完成,频率范围是0.05-0.1 MHz,所加的扰动电压是10 mV,所加偏压为-0.8 V.交流阻抗样品制备如下:将制备好的聚合物电解质溶液滴加在未敏化的的光阳极上,控制电解质溶液在80°C下烘烤使溶剂挥发,当电解质溶液浓缩成粘稠状时加上Pt电极,用夹子将两部分夹紧.再将此半电池在烘箱中80°C下继续烘烤2 h,取出放入干燥器中,待测.
3 结果与讨论
3.1 不同分散剂改性的磁性聚合物电解质的离子电导率分析
图1所示为不同分散剂对聚合物电解质离子电导率的影响.从图中可以看出,聚合物电解质中乙酰丙酮作为分散剂时,电解质离子电导率最高,为2.52×10-3S·cm-1;其次是添加混合活性剂的电解质,再次为含PEG200的电解质;向聚合物电解质中加入曲拉通会降低其离子电导率.
通过分析三种分散剂的分子结构可知,PEG200为短链分散剂,曲拉通为长链分散剂(C34H62O11).由于熵排斥能的大小主要取决于高分子化合物的链长,链越长,熵排斥能越高,质点越稳定.但链太长却会在粒子表面发生折叠而产生压缩空间位阻层或引起架桥絮凝,19所以PEG200能有效提高电解质的电导而曲拉通会降低其电导;而当乙酰丙酮做为表面活性剂时,我们发现含有乙酰丙酮的聚合物电解质溶液的颜色会从没有加活性剂时的棕红色逐渐变淡至基本无色.产生此现象的原因在于乙酰丙酮会与碘发生类似丙酮与碘的碘化反应,20反应方程式为:

乙酰丙酮的加入使得聚合物电解质中的I2变成I-,电解质中的I-离子增加有利于电子的传输,离子电导率将会提升.而I2的消耗使得溶液的颜色变淡,完全吻合了实验现象.但同时,由于I2的减少,光电反应(I2+e-→I-3)的速度急剧降低,可能导致整个染料敏化太阳能电池的光电循环速度减缓,使其光电性能不理想,因此乙酰丙酮添加的聚合物电解质不适合用于染料敏化太阳能电池.

图1 不同表面活性剂对聚合物电解质离子电导率的影响Fig.1 Effect of different surfactans on ionic conductivity of polymer electrolyte
3.2 不同PEG200浓度下琼脂糖磁性聚合物电解质表面形貌分析
图2是不同含量PEG200改性下的聚合物电解质的扫描电镜(SEM)图,从图中可以看出,当PEG200含量小于61.8%时,电解质表面较为平滑,无明显的大颗粒、孔洞等缺陷,纳米Fe3O4颗粒和PEG200之间的相互作用不明显;但在PEG200含量为61.8%和68.3%时,电解质中出现球状物,可能是由于PEG200与纳米Fe3O4颗粒表面羟基形成氢键作用,包覆于纳米Fe3O4颗粒表面,形成空间位阻作用,阻止纳米颗粒的相互团聚,使电解质有良好的分散性和稳定性.21,22当PEG200含量进一步提升到72.9%时,电解质表面出现孔洞这是由于当PEG200含量较大时,分子链之间相互缠绕,磁性纳米颗粒的分散性降低出现团聚和孔洞,影响了电解质的表面形貌.
3.3 不同PEG200浓度下琼脂糖磁性聚合物电解质离子电导率的分析

图2 不同含量PEG200改性的聚合物电解质的扫描电镜(SEM)图Fig.2 Scanning electron microscopy(SEM)images of polymer electrolyte with different contents of PEG200 wPEG200/%:(a)0,(b)35.0,(c)52.1,(d)61.8,(e)68.3,(f)72.9
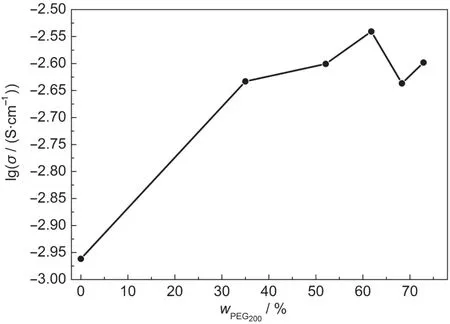
图3 PEG200含量对聚合物电解质离子电导率的影响Fig.3 Effect of different PEG200contents on ionic conductivity of polymer electrolyte
图3所示为聚乙二醇含量对聚合物电解质离子电导率的影响,从图中可以看出,随着聚乙二醇含量的增加,聚合物电解质的离子电导率不断增加,当聚乙二醇含量为61.8%时,其离子电导率到达最大值2.88×10-3S·cm-1.之后随着聚乙二醇含量的增加,离子电导率将会降低并逐渐趋于稳定.出现这样的规律是因为当加入少量PEG200时,纳米Fe3O4表面与PEG200作用,PEG200分子之间的位阻作用有利于纳米Fe3O4的分散,因此随着PEG200浓度增加,磁性粒子在聚合物电解质中的分散性会更好,从而使得聚合物电解质离子电导率增加;当PEG200加入量过大时,如图2所示,PEG200分子链之间会互相缠绕,使得颗粒聚集而沉降,阻碍了纳米Fe3O4分散,从而使得电解质体系的离子电导率降低.
3.4 不同PEG200浓度下的琼脂糖基磁性聚合物电解质染料敏化半电池交流阻抗的分析
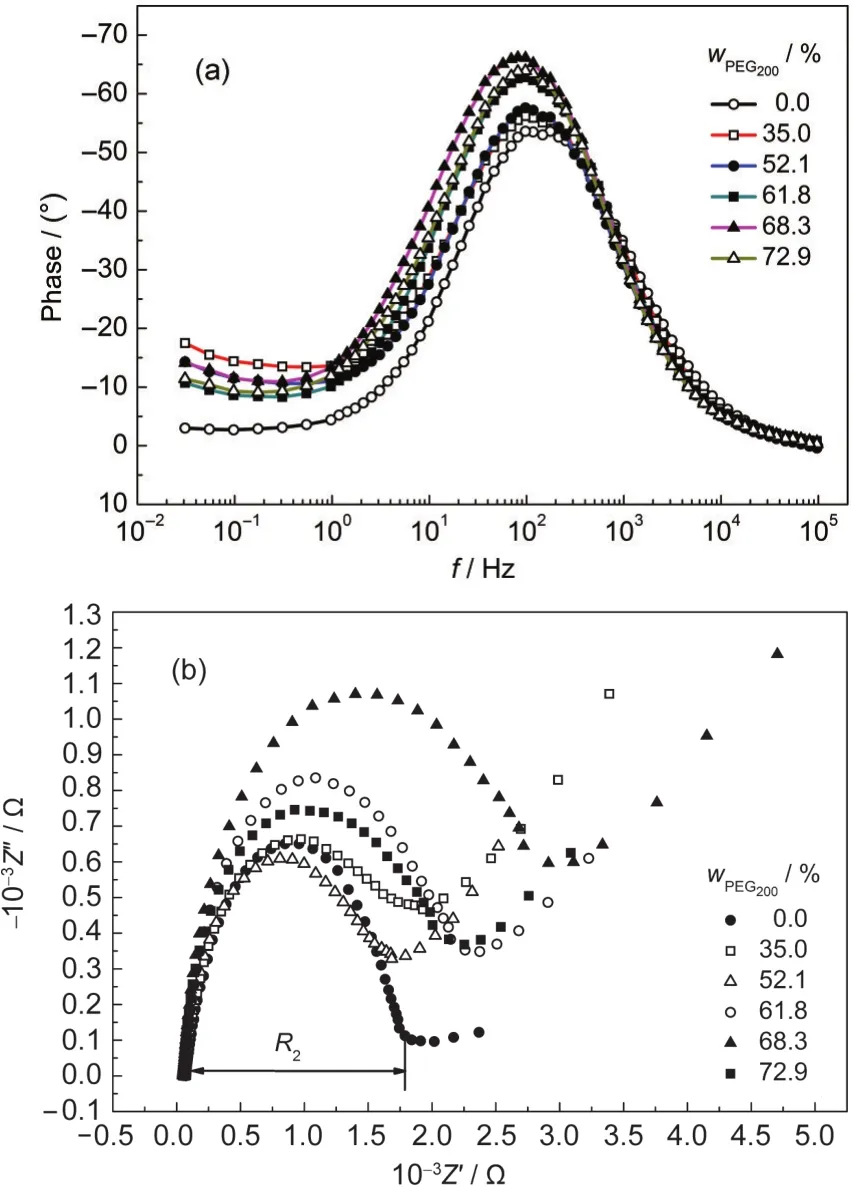
图4 不同含量PEG200改性的聚合物电解质的EIS图Fig.4 EIS of polymer electrolytes with different contents of PEG200(a)Bode plots;(b)Nyquist plots
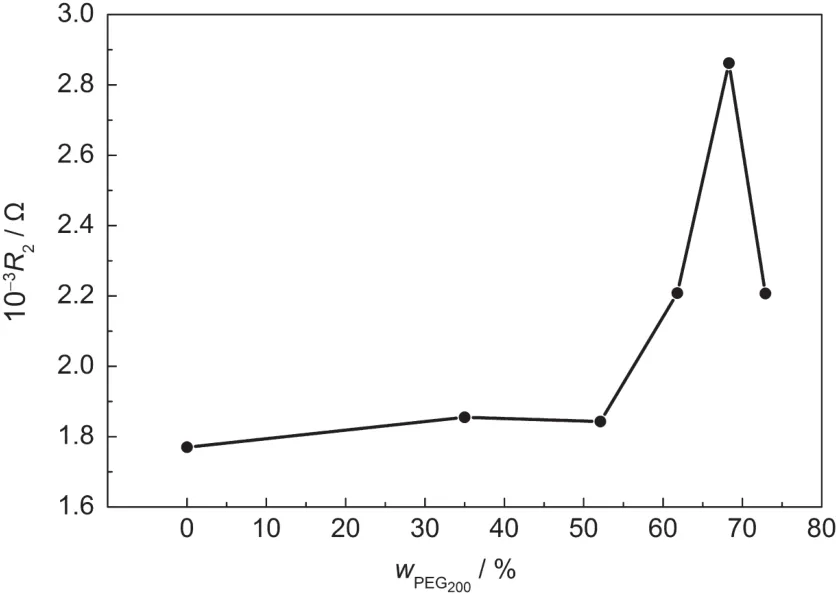
图5 PEG200含量对TiO2/电解质界面电荷复合电阻R2的影响Fig.5 Effect of PEG200contents on combination resistance (R2)of TiO2/electrolyte interface
图4是不同含量聚乙二醇改性的EIS图.从图4 (a)可以看出,不同含量聚乙二醇改性的半电池的Bode图的峰值都集中在约1 Hz-1000 Hz的中频部分,此部分反映的是TiO2/电解质界面的电化学性质.23-25图4(b)中中频部分半圆起止位置所对应的阻抗差值即为TiO2薄膜/电解质界面的复合电阻(R2). R2的大小是用来衡量电子在该界面发生复合反应的难易程度.26-28图5是TiO2/电解质界面电荷复合电阻R2与PEG200浓度的关系图,从图中可以看出随着PEG200浓度的增加TiO2/电解质界面电荷复合电阻R2先增加后减低,这说明TiO2导带电子与I-3之间的电子复合随着PEG200浓度的增加先变得更难然后变容易,从而可能会使DSSC的开路电压先增加后减小.24
根据EIS理论,在Bode图当中(图4(a))中频区域特征峰峰值位频率(ω)的倒数等于电子寿命(τ).29通过ω=τ-1我们可以计算得到TiO2多孔膜当中电子寿命与PEG200浓度的关系图,如图6所示.
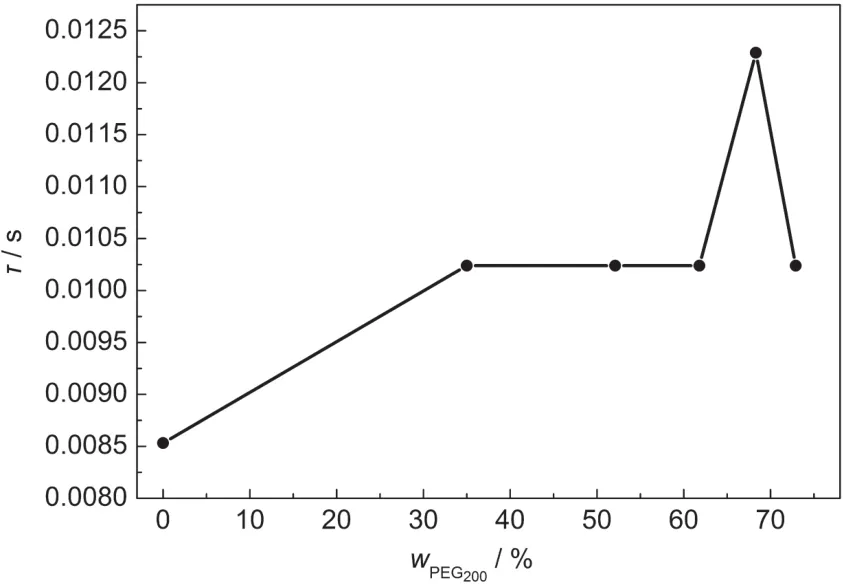
图6 PEG200含量对光阳极中电荷电子寿命的影响Fig.6 Effect of PEG200contents on electron lifetime of electron charges in photoanode
由图4知,随着PEG200浓度的增加,其特征峰峰值频率从PEG200含量0.0%时的117.2 Hz降低到PEG200含量68.3%时的81.38 Hz,再升高到PEG200含量72.9%时的97.66 Hz.从图6中可以看出,随着PEG200加入量的增加,电子寿命先增加后降低,并且当PEG200加入量为68.3%时,电子寿命最高.电子寿命的增加表明TiO2导带的准费米能级增加,从而提高开路电压,30,31可见向磁性聚合物电解质中加入PEG200可能会一定程度上增加其开路电压,提高染料敏化太阳能电池的性能,且最大开路电压可能出现在PEG200含量为68.3%处.
4 结论
考察了纳米Fe3O4颗粒含量为1%(w)时,不同表面活性剂改性的琼脂糖基磁性聚合物电解质的电导性能以及不同PEG浓度添加下琼脂糖磁性聚合物电解质的电化学性能.实验表明,加入不同表面活性剂时,其电解质离子电导率变化趋势为乙酰丙酮>混合表面活性剂>PEG200>无表面活性剂>Triton X-100.但由于乙酰丙酮会与I2发生碘化反应,消耗了电解质中的氧化还原电对,不利于染料敏化太阳能电池的光电转换.我们选用PEG200作为本体系的表面活性剂.在不同浓度PEG200添加下,随着PEG200浓度的增加,聚合物电解质的离子电导率是先增加后降低,最大离子电导率(2.88×10-3S·cm-1)出现在61.8%(w)时;随着PEG200浓度增加染料敏化太阳能半电池的电子寿命和复合电阻均呈现出先增加后降低的趋势,最大值均出现在68.3%(w)处.
(1) OʹRegan,B.;Grätzel,M.Nature 1991,353,737.
(2) Nazeeruddin,M.K.;Kay,A.;Rodicio,I.;Grätzel,M.J.Chem. Soc.1993,115,6382.
(3) Li,J.;Sun,M.X.;Zhang,X.Y.;Cui,X.L.Acta Phys.-Chim. Sin.2011,27,2255.[李 静,孙明轩,张晓艳,崔晓莉.物理化学学报,2011,27,2255.]
(4) Yang,S.M.Dye-Sensitized Nanocrystalline Solar Cells; Zhengzhou University Press:Zhengzhou,2007;pp 113-116. [杨术明.染料敏化纳米晶太阳能电池.郑州:郑州大学出版社,2007:113-116.]
(5)Yella,A.;Lee,H.W.;Tsao,H.N.;Yi,C.;Chandiran,A.K.; Nazeeruddin,M.K.;Diau,E.W.G.;Yeh,C.Y.;Zakeeruddin,S. M.;Grätzel,M.Science 2011,334,629.
(6) Wang,W.J.;Yang,Y.Chemistry 2011,74,144.[王惟嘉,杨 英.化学通报,2011,74,144.]
(7) Kubo,W.;Murakoshi,K.;Kitamura,T.Chem.Lett.1998,12, 1241.
(8) Lan,Z.;Wu,J.;Lin,J.;Huang,M.;Yin,S.;Sato,T. Electrochim.Acta 2007,52,6673.
(9) Wu,J.;Hao,S.;Lan,Z.;Lin,J.;Huang,M.;Huang,Y.;Fang, L.;Yin,S.;Sato,T.Adv.Funct.Mater.2007,17,2645.
(10) Khan,S.A.;Baker,G.L.;Colson,S.Chem.Mater.1996,6, 2359.
(11) Croce,F.;Appetecchi,G.B.;Persi,L.;Scrosati,B.Nature 1998, 394,456.
(12) Han,H.W.;Liu,W.;Zhang,J.;Zhao,X.Z.Adv.Funct.Mater. 2005,15,1940.
(13) Golodnitsky,D.;Livshits,E.;Kovarsky,R.;Peled,E.;Chung,S. H.;Uarez,S.;Greenbaum,S.G.Electrochem.Solid-State Lett. 2004,7,A412.
(14) Livshits,E.;Kovarsky,R.;Lavie,N.;Hayashi,Y.;Golodnitsky, D.;Peled,E.Electrochim.Acta 2005,50,3805.
(15) Yang,Y.;Zhou,C.H.;Xu,S.;Zhang,J.Nanotechnology 2009, 20,105204.
(16) Wang,P.;Zakeeruddin,S.M.;Comte,P.;Exnar,I.;Grätzel,M. J.Am.Chem.Soc.2003,125,1166.
(17) Ma,Y.Z.;Fan,J.L.;Huang,B.Y.Min.Metall.Eng.2003,23, 43. [马运柱,范景莲,黄伯云.矿冶工程,2003,23,43.]
(18) Xu,Y.L.The Function of Surfactant;Chemical Industry Press: Beijing,2000;pp 203-204.[徐燕莉.表面活性剂的功能.北京:化学工业出版社,2000:203-204.]
(19) An,S.H.;Zhang,Z.Z.Foundry Technol.2007,28,1498. [安少华,张振忠.锻造技术,2007,28,1498.]
(20) Zhang,P.M.Advanced Chemistry for Engineering;Hunan Educational Publishing House:Changsha,2002;Vol.2,pp 209-211.[张平民.工科大学化学,下册.长沙:湖南教育出版社, 2002:209-211.]
(21) Zhang,F.;Zhu,H.J.Magn.Mater.Devices 2009,40,27. [张 峰,朱 宏.磁性材料及器件,2009,40,27.]
(22) Liu,J.;Zhang,L.J.;Ye,X.C.Inorg.Chem.Ind.2010,8,28. [刘 甲,张林进,叶旭初.无机盐工业,2010,8,28.]
(23) Fuke,N.;Fukui,A.;Komiya,R.;Islam,A.;Chiba,Y.;Yanagida, M.;Yamanaka,R.;Han,L.Chem.Mater.2008,20,497.
(24)Wang,M.;Lin,Y.;Zhou,X.W.;Xiao,X.R.;Yang,L.;Feng,S. J.;Li,X.P.Mater.Chem.Phys.2008,107,61.
(25)Wang,W.J.;Guo,X.Y.;Yang,Y.Electrochim.Acta 2011,56, 7347.
(26) Adachi,M.;Sakamoto,M.;Jiu,J.;Ogata,Y.;Isoda,S.J.Phys. Chem.B 2006,110,13872.
(27) Wang,Q.;Ito,S.;Grätzel,M.;Fabregat-Santiago,F.;Mora-Sero,I.;Bisquert,J.;Bessho,T.;Imai,H.J.Phys.Chem.B 2006,110,25210.
(28) Gao,R.;Ma,B.B.;Wang,L.D.;Shi,Y.T.;Dong,H.P.;Qiu,Y. Acta Phys.-Chim.Sin.2011,27,413.[高 瑞,马蓓蓓,王立铎,史彦涛,董豪鹏,邱 勇.物理化学学报,2011,27,413.]
(29) Wang,Q.;Moser,J.E.;Grätzel,M.Electrochim.Acta 2002,47, 4213.
(30) He,J.;Benkö,G.;Korodi,F.;Polívka,T.;Lomoth,R.; Åkermark,B.;Sun,L.;Hagfeldt,A.;Sundström,V.J.Am. Chem.Soc.2002,124,4922.
(31) Zhang,Z.P.;Zakeeruddin,S.M.;OʹRegan,B.;Humphry-Baker, R.;Grätzel,M.J.Phys.Chem.B 2005,109,21818.
September 15,2011;Revised:December 12,2011;Published on Web:December 30,2011.∗
.Email:muyicaoyang@hotmail.com;Tel:+86-731-88877863.
Electrochemical Properties of an Agarose-Based Magnetic Polymer Electrolyte in Dye-Sensitized Solar Cells
GUO Xue-Yi YI Peng-Fei WANG Wei-Jia YANG Ying*
(School of Metallurgical Science and Engineering,Central South University,Changsha 410083,P.R.China)
In order to enhance the dispersion of Fe3O4nanoparticles in polymer electrolytes for dyesensitized solar cell(DSSC)applications,the ionic conductivity of the polymer electrolytes with different small molecular surfactants was studied.The surfactants used were polyethylene glycol(PEG200),Triton X-100,acetyl acetone,and mixture of these three active agents at 1%(w)doping concentration of Fe3O4nanoparticles in electrolyte.Comparison of the electrochemical properties of Fe3O4-doped polymer electrolytes containing different surfactants showed that PEG200was suitable for modifying Fe3O4nanoparticles to disperse in agarose-based polymer electrolytes.When the mass fraction of PEG200was 61.8%(w),the electrolyte had excellent conductivity(2.88×10-3S·cm-1).Electrochemical impedance spectra (EIS)revealed that when the concentration of PEG200increased,the electron lifetime and combination resistance of a dye-sensitized solar cell increase initially and then decreasd.The longest electron lifetime and the largest combination resistance were achieved when the concentration ofPEG200was 68.3%(w).
Magnetical polymer electrolyte;Agarose;Nano-Fe3O4;PEG200;Dye-sensitized solar cell
10.3866/PKU.WHXB201112302
O646
The project was supported by the National Natural Science Foundation of China(61006047).
国家自然科学基金(61006047)资助项目
