复健片对MCAO大鼠脑梗死周围组织RhoA表达的影响*
2012-11-29胡怀强周永红王树才曹秉振
胡怀强,周永红,王树才,曹秉振
(1.中国人民解放军济南军区总医院神经内科,济南 250031;2.青岛大学医学院,青岛 266071)
脑梗死后脑组织损伤不但将神经元间的联系破坏,而且还会导致细胞的变性和死亡,其后果往往是灾难性的。在脑科学迅速发展的今天,没有人再会怀疑损伤的成年大脑神经元能够萌芽这个结论,如何改善神经元及支持神经再生的微环境,能否有效解除神经再生抑制效应已成为中枢神经再生的关键[1]。Rho/ROCK信号通路在转导髓磷脂相关抑制因子引起肌动蛋白细胞骨架重组、生长锥塌陷及抑制神经突起延伸过程中起着关键作用,已成为神经损伤发生的重要病理机制[2]。研究表明[3],山东省名中医药专家王新陆教授所创的复健片可以诱导中枢神经系统产生有利的微环境促进神经再生,并显著抑制Nogo-A表达,促进脑梗死后的神经发生。本研究首次通过给予复健片,观察局灶性脑缺血模型大鼠梗死周围脑组织中Rho/ROCK信号通路的关键因子RhoA变化,探讨其促进神经再生的作用机制。
1 材料和方法
1.1 动物和分组 成年SPF级雄性SD大鼠60只,体质量250~300 g,由山东大学实验动物中心提供,实验动物生产许可号:SCXK(鲁)20090001(山东省科学技术厅发),实验动物质量合格证号:鲁动质号0005215(山东省实验动物管理委员会发),检疫后备用,自由摄食进水。颗粒大鼠饲料,由济南康大饲料与山东省实验动物中心联合生产,许可证号:鲁饲准字364号。实验过程中动物饲养及取材均遵守实验动物管理和保护的有关规定。实验动物购买后,在实验室内预适应饲养1周,1周后按随机数字表法随机分为:正常对照组、假手术组、模型组和药物组共4个组,正常对照组、假手术组各10只,模型组和药物组各20只。
1.2 药物与试剂 复健片,主要药物为何首乌、草决明、桑寄生、海马、淫羊藿等,由山东鲁信药业有限公司生产,批号:2011040101,并按照成人剂量的20倍[9 g/(kg·d)]将其制成水溶液,浓度为0.9 g/mL(即1 mL/100 g),置于4℃冰箱中备用。兔抗大鼠RhoA多克隆抗体,由Sigma-Aldrich公司提供。
1.3 大脑中动脉阻塞(MCAO)模型的制备 在Longa EZ等[4]报道的方法基础上改良后行MCAO术制作局灶性脑缺血模型。MCAO模型成功的判断标准采用Longa EZ评分标准[4]:0分,无神经缺损表现;1分,对侧前爪不能充分伸展;2分,向外侧转圈;3分,行走时向对侧倾倒;4分,不能行走,意识丧失。动物清醒后进行神经功能评分,1~3分者为纳入标准,0分和4分者剔除。
1.4 给药方法 于造模成功24 h后给药,药物组灌胃给予复健片水溶液10 mL/kg,余各组分别灌胃给予10 mL/kg剂量的蒸馏水,每日1次,并于取材当天停药。固体饲料和水自由摄取。
1.5 标本制备 在取材的各时间点,3.5%水合氯醛腹腔注射麻醉后,4%多聚甲醛磷酸缓冲液(PBS)灌注固定取脑,然后将其浸于4%多聚甲醛中后固定。常规脱水浸蜡包埋,予正中隆起水平在切片机上行4 μm连续冠状切片。
1.6 免疫组织化学染色 切片常规脱蜡至水;30%双氧水(H2O2)1份+蒸馏水10份混合,室温10 min以灭活内源性酶,蒸馏水洗3次;热修复抗原:将切片浸入0.01 mmol/L枸橼酸盐缓冲液(pH6.0),电炉加热至沸腾后断电,间隔10 min后,反复1次,自然冷却后用PBS(pH7.2~7.6)洗涤2次;滴加5%牛血清白蛋白(BSA)封闭液,室温20 min,甩去多余液体,不洗;滴加兔抗鼠 RhoA 一抗(1∶100),4℃过夜,PBS(pH7.2~7.6)洗 2 min×3 次;滴加生物素化山羊抗兔IgG,37℃20 min。PBS(pH7.2~7.6)洗2 min×3次;滴加试剂 SABC,37 ℃ 20 min,PBS(pH7.2~7.6)洗5 min×4次;二氨基联苯胺(DAB)显色:使用DAB显色试剂盒,室温显色,镜下控制反应时间,蒸馏水洗涤;)脱水,透明,封片,显微镜观察。免疫组织化学染色阴性对照用生物素化山羊抗兔IgG代替一抗,其余步骤同上,以检查RhoA免疫反应的特异性。
1.7 图像分析 免疫组织化学染色方法检测切片在统一放大倍数下,随机选10个视野,运用HPIAS-1000高清晰度彩色病理图文报告分析系统进行分析,记录平均阳性细胞数。
1.8 统计学方法 数据用SAS 8.1版统计软件计量资料均采用均数±标准差(±s)表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
免疫组织化学观察复健片对不同时相MCAO大鼠RhoA表达的影响,结果见表1及图1-4。
结果显示,脑梗死后1周时正常对照组和假手术组大鼠脑内的RhoA呈低表达状态,两者之间差异无统计学意义。大鼠脑梗死后脑内的RhoA表达增高,与正常对照组比较差异有统计学意义(P<0.01),说明脑梗死后神经再生抑制相关因子开始表达。药物组与模型组比较显示,药物组大鼠脑组织中RhoA表达虽然较正常对照组增多,但较模型组明显减少,两者之间差异有统计学意义(P<0.05),说明复健片可抑制RhoA在脑梗死后的表达。
表1 免疫组织化学观察复健片对不同时相MCAO大鼠RhoA 表达的影响(±s,A 值)Tab.1 Effect of Fujian tablet on the expression of RhoA in MCAO rats at different phase observed with immunohistochemistry(±s,A 值)
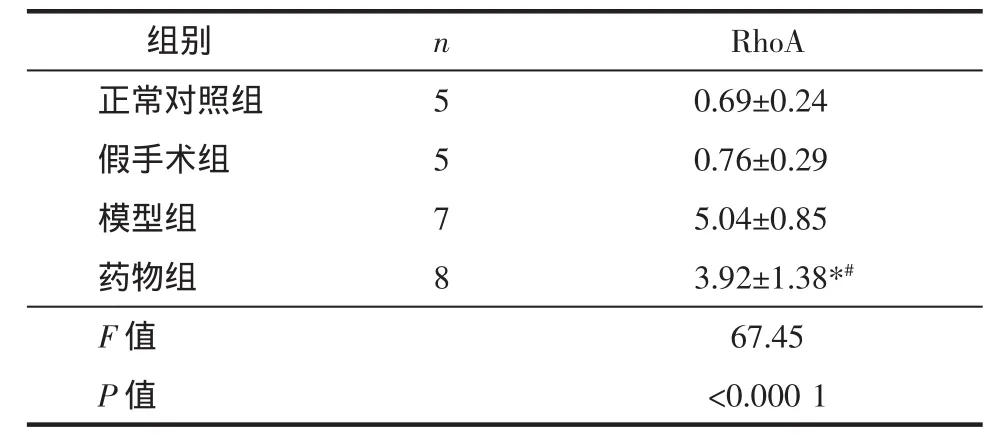
表1 免疫组织化学观察复健片对不同时相MCAO大鼠RhoA 表达的影响(±s,A 值)Tab.1 Effect of Fujian tablet on the expression of RhoA in MCAO rats at different phase observed with immunohistochemistry(±s,A 值)
注:与正常对照组比较,*P<0.0001;与模型组比较,#P<0.05;说明在药物组对RhoA的抑制作用优于模型组,复健片对RhoA有较强的抑制作用。
组别 n RhoA正常对照组 50.69±0.2450.76±0.2975.04±0.858假手术组模型组药物组F值P值3.92±1.38*#67.45<0.0001
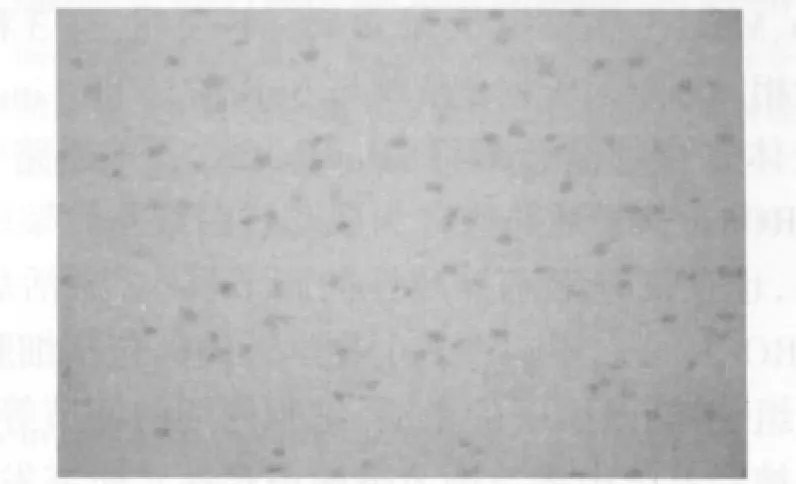
图1 正常对照组RhoA(10×40)Fig.1 RhoA of normal control group(10×40)

图2 假手术组RhoA(10×40)Fig.2 RhoA of sham operation group(10×40)
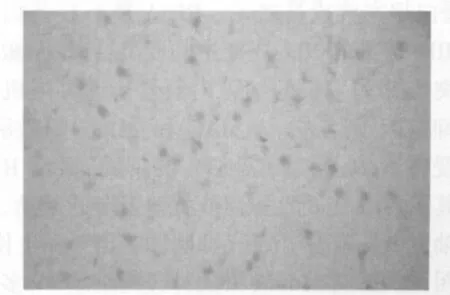
图3 模型组 RhoA(10×40)Fig.3 RhoA of model group(10×40)

图4 药物组RhoA(10×40)Fig.4 RhoA of medicine group(10×40)
3 讨论
近年来研究表明抑制因素在神经再生过程中扮演着更为重要的角色,迄今中枢神经系统髓磷脂相关的3种主要轴突再生抑制因子已被鉴定,包括Nogo、MAG、OMgp[5]。大量文献资料表明,这 3 种髓磷脂相关抑制因子完全依赖与NgR/P75NTR/Lingo-1膜受体复合物结合激活Rho/ROCK信号通路[6-7]。Rho/ROCK信号通路被称为肌动蛋白细胞骨架的调节器,也是细胞形态异质性的调节器[8]。激活后的Rho/ROCK可以影响许多生物学行为,包括细胞骨架的组装、转录因子的激活、细胞周期的调节等,在中枢神经系统中参与调节突触可塑性。研究发现,在神经发育过程中,Rho/ROCK信号通路参与生长锥的塌陷、抑制轴突发展和短期包绕细胞体等[9]。Rho/ROCK通路参与从轴突生长抑制因子到生长锥的肌动蛋白细胞骨架信号换能过程[10]。因此,Rho/ROCK信号通路在转导髓磷脂相关抑制因子引起肌动蛋白细胞骨架重组、生长锥塌陷及抑制神经突起延伸过程中起着关键作用,已成为神经损伤发生的重要病理机制[11]。由此可见,阻断Rho/ROCK信号通路可促进轴突再生及神经功能恢复[12]。
Rho蛋白为小分子鸟苷酸结合蛋白,具有三磷酸鸟苷酸(GTP)酶活性,其分子量为20~30 kDa,是Ras蛋白超家族成员之一。RhoA是小G蛋白超家族中Rho家族的Rho亚族中的成员。RhoA激活抑制轴突出芽和生长的细胞内信号传递可能机制为髓鞘抑制因子(Nogo-A、MAG和OMgp)的激活,作用于受体NgR,通过P75NTR的帮助,激活RhoA,通过其下游的Rho激酶调节肌动蛋白的活动,继而引起轴突生长锥的崩溃[13],抑制轴突出芽和生长。实验证明,在RhoAV14-转染的神经元细胞中,多数细胞只有光秃秃的树突主干,树突棘的密度明显降低甚至是缺如,即使是存在的树突棘也发生了明显的形态学改变,树突棘的长度明显缩短。实验发现,在苯丙酮尿症小鼠模型中,小鼠脑部浦肯野细胞上的RhoA表达量增加,神经元细胞的树突分支明显减少,树突与树突棘的长度也显著缩短。表明RhoA信号转导通路在神经元树突分支方面发挥重要作用[14]。
脑缺血损伤后,肝肾阴亏,络脉闭塞、神明失司、神机失用,导致神经功能受损,在临床实践中通过中药补益肝肾,使肝主升发疏泄藏血、肾藏精生髓功能正常,肝肾之精血不衰,封藏疏泄有度,则易损区神经生长因子作用增强、抑制因子作用解除,在一定程度上可维持脑内环境稳定以及细胞间相互作用与突触联系相对恒定,诱导神经干细胞增殖和定向分化,促进神经再生,使神经功能得以重建和恢复。正如唐容川所言:“益肾生精,化为髓,而藏之于脑中。”因此,滋补肝肾是促进中枢神经再生的重要方法[15]。复健片临床治疗脑梗死的有效方剂,由何首乌、桑寄生、草决明、海马、淫羊藿组成,此方针对脑梗死“肝肾阴虚为本”的病机特点而设,旨在滋补肝肾。方中重用何首乌为君,本品补肝肾、益精血,性虽微温而不燥,又无一般滋阴药滋腻生湿、困脾碍胃之弊,因此重用以滋补肝肾、补精益髓。复配桑寄生、草决明为臣,助何首乌滋补肝肾之功。桑寄生质厚而柔,不寒不热,取其补肾养血、益肝肾、强筋骨之功效,且偏走于肢体筋脉,可治疗脑梗死之肢体强急拘挛或筋骨羸弱瘫软诸症;草决明既能补肝肾,又能清肝热,且得木性而气浮,能引肾水上注于头面。海马、淫羊藿均能温补肾元,稍稍佐之,一取阳中求阴之旨,以助君臣药滋补肝肾;二取其温性来防止滋阴药过于滋腻;三能借其温性令药气开通经络,使气血宣行而无壅滞。以上诸药合用,一则靶向明确,二则燮理阴阳,三则肝肾并补,四则峻缓适宜,并具有补中寓行,寓调于补,调补结合,滋而不腻的特点。研究结果表明,药物组大鼠脑组织中RhoA表达虽然较正常对照组增多,但较模型组明显减少,两者之间差异有统计学意义,说明复健片可抑制RhoA在脑梗死后的表达。表明复健片可通过抑制神经生长负性调控因子的表达,而对脑梗死后的神经发生过程有促进作用。
[1]Zeng JS,Li H,Hong H.The synaptic reconstruction and expression of inhibitory protein in the thalamus and striatum after experimental cerebral infaction in rats[J].Chin J Clin Rehabi,2002,6(17):2534-2535.
[2]Mueller BK,Mack H,Teusch N.Rho kinase,a promising drug target for neurological disorders[J].Nat Rev Drug Discov,2005,4(5):387-398.
[3]胡怀强,周永红,马学盛,等.复健片对大鼠脑梗死后不同时点Nogo-A 表达的影响[J].中国实验动物学报,2010,18(2):118-121.
[4]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebra artery occlusion without craniectomy in rats[J].Stroke,1989,20:84-91.
[5]Mehta NR,Lopez PH,Vyas AA,et al.Gangliosides and Nogo receptors independently mediate myelin-associated glycoprotein inhibition of neurite outgrowth in different nerve cells[J].J Biol Chem,2007,282(38):27875-27886.
[6]Ding J,Li QY,Yu JZ,et al.Fasudil,a Rho kinase inhibitor,drives mobilization of adult neural stem cells after hypoxia/reoxygenation injury in mice[J].Mol Cell Neurosci,2010,43(2):201-208.
[7]Alabed YZ,Grados-Munro E,Ferraro GB,et al.Neuronal responses to myelin are mediated by rho kinase[J].J Neurochem,2006,96(6):1616-1625.
[8]Numano F,Inoue A,Enomoto M,et al.Critical involvement of Rho GTPase activity in the efficient transplantation of neural stem cells into the injured spinal cord[J].Mol Brain,2009,2(1):37.
[9]Gopalakrishnan SM,Teusch N,Imhof C,et al.Role of Rho kinase pathway in chondroitin sulfate proteoglycan-mediated inhibition of neurite outgrowth in PC12 cells[J].J Neurosci Res,2008,86(10):2214-2226.
[10]Yang P,Wen HZ,Zhang JH.Expression of a dominantnegative Rhokinase promotes neurite outgrowth in a microenvironment mimicking injured central nervous system[J].Acta Pharmacol Sin,2010,31(5):531-539.
[11]Mueller BK,Mack H,Teusch N.Rho kinase,a promising drug target for neurological disorders[J].Nat Rev Drug Discov,2005,4(5):387-398.
[12]Kubo T,Yamashita T.Rho-ROCK inhibitors for the treatment of CNS injury[J].Recent Pat CNS Drug Discov,2007,2(3):173-179.
[13]Teng FY,TangB L.Why doNogo/Nogo-66 receptor gene knock outs result in inferior regeneration compared to treatment with neutralizing agents?[J].J Neurochem,2005,94(4):865-874.
[14]Zhang YJ,Zhang HW,Yuan XB,et al.Differential effects of phenylalanine on Rac1,Cdc42,and RhoA expression and activity in cultured cortical neurons[J].Pediatric Research,2007,62(1):8-13.
[15]胡怀强,周永红,王新陆.试论滋补肝肾是促进中枢神经再生的重要方法[J].天津中医药,2009,26(4):296-298.