采用不同处理方法检测蜂群的清理能力
2012-11-28苏松坤汪理想陈大福戴双进陈盛禄
苏松坤 汪理想, 潘 娇 刘 芳 陈大福 戴双进 陈盛禄
(1 浙江大学动物科学学院,杭州 310058;2 福建农林大学蜂学学院,福州 350002)
随着社会的进步,蜜蜂对人类的价值越来越被重视,其授粉作用的不可替代性及相应蜂产品的营养价值也使得人们越来越关注养蜂业的发展,病虫害一直是威胁养蜂业发展的最大问题。利用抗生素等化学药品在一定程度上控制住疾病,但长期使用却削弱了蜜蜂的抵抗力,增强病原的耐药性,迫使人们不得不加大使用剂量,如此形成恶性循环,危害了环境也造成蜂产品药物残留。随着人们对食品质量要求的不断提高及环保意识的不断增强,不使用杀虫剂和抗生素的自然态抵御蜜蜂病虫害的方法越来越受到人们重视。
蜜蜂的卫生行为指其能够检查、咬开封盖房并清除已染病害的蜜蜂虫蛹。已有的卫生行为测试即是通过检测蜂群对冷冻致死封盖子的清除能力,来评估蜂群对染病封盖子的清除能力[1]。早年美国就开始培育抗病和抗螨的蜜蜂品系,他们发现,清巢能力强的蜜蜂品系很少患美洲幼虫腐臭病或白垩病,蜂螨也少。这类蜜蜂品系能发现并迅速移走患病或被蜂螨感染的幼虫,移除病原体从而限制疾病的传播。卫生行为是一种隐性性状,只有蜂王和雄蜂均来自具有卫生行为的蜂群时,后代工蜂才能表现出卫生行为。1990年白垩病在江浙一带发生后迅速蔓延到全国各地,严重危害了我国养蜂业,广大蜂农也因此迫切希望能够选育出既高产又能抗白垩病的蜂种。有研究表明,不同品种、品系的蜜蜂,甚至同一品种、品系内的不同蜂群,其抗白垩病能力、工蜂发现病虫时间的早、晚及清除病虫的能力等特征都存在着遗传特性上的差异,而这些特征又都和蜂群的抗白垩病能力密切相关。
蜜蜂具有卫生行为包括两个过程,即打开封盖和移走病虫、死虫或者受伤幼虫。有研究比较了具有卫生行为的蜂群和不具有卫生行为的蜂群对针扎致死封盖子在一个小时内的死虫被清除量,结果显示具有卫生行为的蜂群和不具有卫生行为的蜂群在清除死虫的数量上存在极显著差异(P<0.01)[2]。
Rothenbuhler提出蜜蜂的卫生行为是由基因控制的,u代表打开封盖子,r代表清除不正常幼虫,当亲本基因为uu/rr时,蜜蜂就同时具有打开封盖房和清除不正常幼虫的行为[3]。具有卫生行为的蜜蜂消除了病菌的感染和减弱了疾病在蜂群的传播,同时能够自我治愈。那些能够在很短时间内移除死亡封盖子的蜂群就被认为具有卫生行为,那些表现出患病特征和在巢脾上有死亡的幼虫则被认为不具有卫生行为。具有卫生行为的蜂群移除死亡幼虫的效率明显高于不具有卫生行为的蜂群,只要经过适当的选择就有可能获得具有很高卫生行为的蜂群[4,5]。有研究者已论证多种信号会诱发蜜蜂对死亡幼虫的清理,如嗅觉探测、健康幼虫和被感染或死亡幼虫的表面温度[6,7]。通过患美洲幼虫腐臭病的蜂群或对蜂群注射幼虫芽孢杆菌来使蜂群患幼虫腐烂病来研究蜜蜂的卫生行为[8]。此外,有研究证实氰化物杀死封盖子幼虫或者针扎致死出现血淋巴,增加蜜蜂清除死亡幼虫的速率,引起了蜜蜂的清理行为[9]。
冰冻致死的封盖子经常被用来调查蜂群的卫生行为。用液氮使巢脾迅速处于冰冻状态,极短时间内杀死封盖子。杀死封盖子的方法不同,蜜蜂对其清除的速率就不同。判断蜂群的卫生行为应该将杀死的封盖子在放入实验蜂群后不同的时间段测验。杀死的封盖子日龄不同,实验结果也会有所区别。冰冻致死的封盖子及时放回蜂群和过几天后再放回蜂群,蜜蜂会有不同的清除速率,前者会更快。
研究表明,具有卫生行为的蜂群可以抵御多种蜜蜂病虫害的危害。白垩病是蜂群的常患病害之一,在同一蜂场中可能同时存在患病群与健康群,健康蜂群对白垩病有较强的抵抗能力。同时,由于白垩病对蜂群的影响很大,因此疾病抵抗能力蜂种的选育就显得极为重要。本研究在不同的处理条件下,观察不同蜂群的清理行为,研究清理能力与抵抗白垩病之间的关系,为判断蜂群的清理能力及抗病育种提供依据。
1 材料与方法
1.1 实验器材
特制的巢础切块机、冰柜、智能恒温恒湿箱、液氮、大头针、蒸馏水。
1.2 实验蜂群
所选蜂场为浙江大学华家池实验蜂场,五群健康的蜂群及六群群势基本一致的蜂群(每箱四脾,其中两个为封盖子脾),其中三群为患白垩病的蜂群,三群为健康的蜂群。
1.3 实验一:封盖子脾在不同处理下的死亡情况
将A、B、C、D、E五个蜂群,每群用特制的巢脾切块机切出八块大小完全一致的6.5*3.5cm的封盖子块,分别在经水泡2 h、水泡5 h、水泡24 h、-20℃冰冻2 h、-20℃冰冻4 h、针扎、液氮、空白环境处理后,放在一个有透气的小纸箱里面,然后把所有的小封盖子脾放在34.5℃、70%湿度的智能恒温恒湿培养箱里面,每隔一天(24 h)观察记录一次封盖子的出房情况,连续观察12 天。
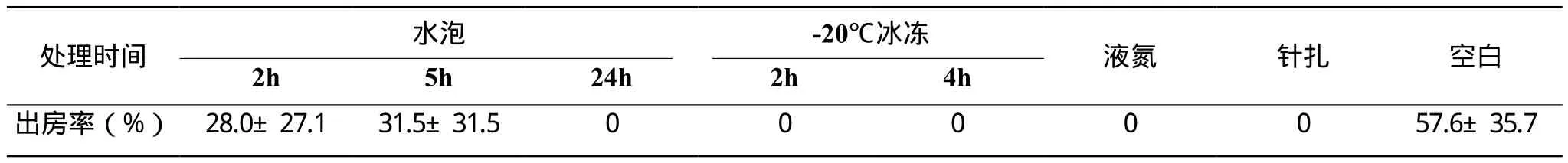
表1 不同条件处理下封盖子脾的出房率
1.4 实验二:白垩病患群与健康蜂群清理能力检测
三群患白垩病蜂群和三群健康蜂群,在保证群势基本一致的情况下每群用特制的巢脾切块机切出四块6.5×3.5 cm的小封盖子脾,分别在经水泡24 h、-20℃冰冻24 h、液氮、针扎处理后,放回原群,每隔24 h观察记录一次封盖子的剩余数目。连续观察三次。
1.5 数据统计分析方法
t检验用来统计分析不同处理方法的差异显著性。
2 结果与分析
2.1 实验一结果
试验一的结果表明,分别经水泡24 h、-20℃冰冻2 h、-20℃冰冻4 h、液氮冷冻和针扎处理后,所有封盖子均未能成功出房,而水泡2 h、水泡5 h和空白处理组均有蜜蜂出房,详见表1。
从表1可以看出,空白对照组的封盖子出房率最高,但也仅仅刚过半数;水泡2h和水泡5h处理后的封盖子出房率之间不存在显著差异(P=0.86>0.05)但是其出房率均显著低于空白对照组,当水泡时间延长到24h时,封盖子全部死亡(即出房率为零);此外,三种-20℃冰冻条件(2 h, 4 h, 24 h)、液氮冷冻及针扎处理后的封盖子出房率均为零。由此得知,水泡24h及以上、冰冻、液氮冷冻、针扎等处理方法均可用于后续的蜂群清理能力检测试验。
2.2 实验二结果
试验二研究的是实验组与对照组在24h、48h、72h内蜜蜂对实验封盖子的清理百分比。其中,分析实验处理后共三次观察统计得到的封盖子剩余量发现:实验处理后24h内,实验与对照蜂群对经水泡处理的封盖子清理能力才存在显著差异,对冰冻处理后后的封盖子清理能力呈差异极显著,而对液氮和针扎处理的封盖子并无显著差异(见图1);处理后48h及72h内,蜂群只对经水泡24h处理的封盖子清理能力存在显著差异,对其他三种处理后的封盖子清除效果无显著差异(见图2,3)。
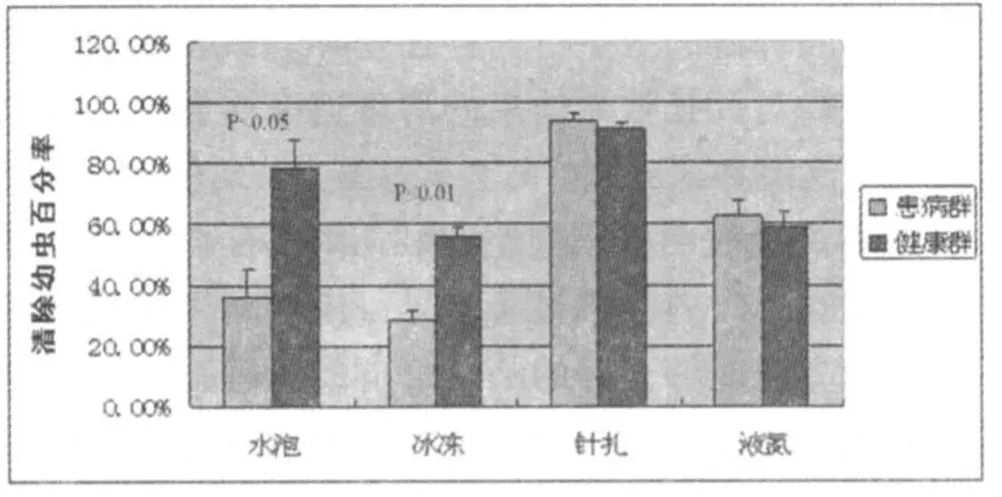
图1 24h内不同方法对幼虫的清除率
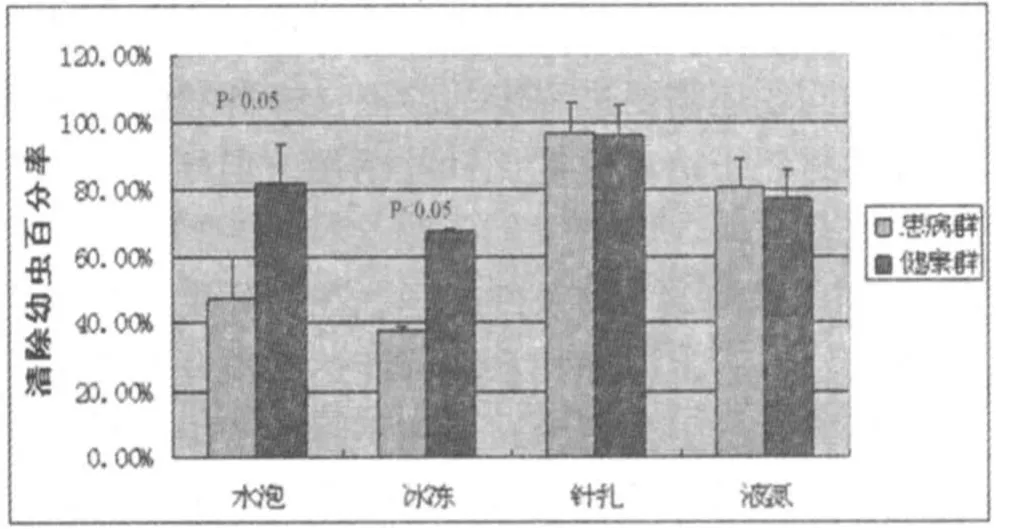
图2 48h内蜜蜂对幼虫的清除率
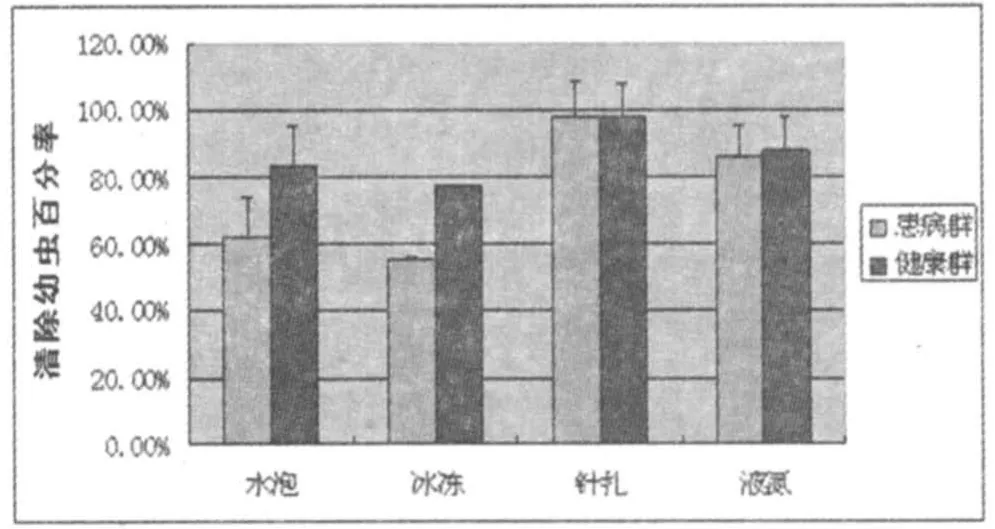
图3 72h内蜜蜂对幼虫的清除率
由以上三个图可以得知,采用水泡24h或冰冻24h处理封盖子脾并在24h或48小时内统计蜜蜂对幼虫的清除率的方法可以筛选具有卫生行为的蜂群,并用于培育具有抗白垩病性状的新蜂种。
3 讨论
试验一保证了使用二中所有的处理结果都是一样,那就是封盖子幼虫的死亡。试验二的结果显示,蜜蜂对经过针扎致死的幼虫清理速率明显高于其它组,实验组与对照组结果差异不显著,利用针扎处理不能很好的判断蜂群的卫生行为。
根据 Büchler 的研究结果,蜜蜂在17.3 h内移除50%的针扎致死的封盖子。而我们的试验显示,蜜蜂在24h内移除了94%的针扎致死的封盖子幼虫,说明不同蜂群的卫生行为存在差异。试验结果还显示,蜜蜂对针扎致死幼虫的清理速率明显高于液氮组、水泡组和冰冻组。
本试验表明,水泡组在48 h内都存在差异,冰冻组在24小时内存在显著差异,说明利用水泡24和冰冻的方法能够很好的凸显蜂群的清理行为,其他学者也认为冰冻实验能够很好的鉴定蜂群的卫生行为[10]。Spivak and Gilliam[11]和 Spivak and Reuter[1]曾用液氮处理实验封盖子脾,能够直接把封盖子杀死,液氮组在三个时间段内都没有显著性的差异,相关的问题还需要进一步的验证,蜂群对经过液氮处理的封盖子清理速度比针扎组慢,但经过72 h后基本完全清理。
利用水泡24 h的条件处理,在实际生产中更为方便,在实验上冰冻和水泡都能达到很好的效果,能判断蜂群的卫生行为;但在实际生产中,利用水泡处理能够随时随地进行,且差异显著持续的周期长(48 h),冰冻组为24 h。利用此方法,在抗病育种上我们能够快速简便的选择出清理能力强的抗病蜂群。
[1]Spivak M, Reuter G S.Honey bee hygienic behavior.Am.Bee J.1998,138: 283-286.
[2]Morais M M, Francoy T M, Pereira R A, De Jong D and Gonlves L S.Africanized honey bees are efficient at detecting, uncapping and removing dead brood.Genetics and Molecular Research, 2009, 8:718-724.
[3]Rothenbuhler W C.Behaviour genetics of nest cleaning in honeybees.I.Responses of four inbred lines to disease killed brood.Anim.Behav.1964, 12: 578-583.
[4]PalaioM A , Figini E E, Ruffinengo S R , et al..Changes in population of Apis mellifera L.selected for hygienic behaviour and its relation to disease tolerance.Apidologie.2000, 31: 471-478.
[5]Lapidge KO, ldroyd B , Spivak M.Seven suggestive quantitative trait loci influence hygienic behavior of honey bees.Naturwissenschaften.2002, 89: 565-568.
[6]Arathi H S, Ho G and Spivak M.Inefficient task partitioning among nonhygienic honeybees, Apis mellifera L, and implications for disease transmission.Anim.Behav.2006,72: 431-438.
[7]Gramacho K P , Gonçalves L S, Rosekranz P.Temperaturmessungen an lebender und abgetöteter (Nadeltest) Bienenbrunt (Apis mellifera).[Temperature measurements of living and killed (“pintest”) honey bee brood (Apis mellifera)].Apidologie.1997,28: 205-207.
[8]Spivak M , Reuter G S.Resistance to American foulbrood disease by honey bee colonies Apis mellifera bred for hygienic behavior.Apidologie.2001,32: 555-565.
[9]Spivak M, Downey D L.Field assays for hygienic behavior in honey bees (Apidae: Hymenoptera).J.Econ.Ent.1998, 91: 64-70.
[10]Gramacho K P, Gonçalves L S, Rosenkranz P et al..Influence of body fluid from pin-killed honey bee pupae on hygienic behavior.Apidologie.1999, 30: 367-374.
[11]Spivak M, Gilliam M.Hygienic behaviour of honey bees and its application for control of brood diseases and varroa.Part II.Studies on hygienic behaviour since the Rothenbuhler era.Bee World.1998,79: 169-186.
