我国质量风险管理在GSP实施中的应用
2012-11-28施能进罗文华吴锦邓在春
施能进,罗文华,吴锦,邓在春
(1.浙江医药高等专科学校,浙江宁波315010;2.宁波大学附属医院,浙江宁波 315020)
我国质量风险管理在GSP实施中的应用
施能进1*,罗文华1,吴锦1,邓在春2#
(1.浙江医药高等专科学校,浙江宁波315010;2.宁波大学附属医院,浙江宁波 315020)
目的:为药品经营企业在《药品经营质量管理规范》(GSP)实施中的质量风险管理提供参考。方法:采用风险评估、风险控制、风险审核的步骤和方法,运用风险排列和过滤工具,结合GSP实施中进货环节的实例对质量风险管理进行探析。结果与结论:药品经营企业需要树立正确的质量风险管理意识,运用恰当的管理工具,建立管理体系,以有效管理GSP实施中的质量风险。
药品经营企业;质量风险管理;药品经营质量管理规范;应用
我国2010版《药品生产质量管理规范》(GMP)已经将质量风险管理(QRM)引入其中,要求药品生产企业对质量风险进行评估,其所采用的方法、措施、形式及形成的文件应当与存在风险的级别相适应。由于QRM贯穿着产品的整个生命周期,因此在药品流通环节的《药品经营质量管理规范》(GSP)实施过程中,QRM也必将融入其中。目前新版GSP的征求意见稿(食药监安函[2011]106)已经公布,QRM的内容也载入其中:“药品批发企业应当在药品流通全过程中采用前瞻或回顾的方式,对质量风险进行评估、控制、沟通、审核。”因此,QRM在GSP实施中的应用是大势所趋。然而,QRM对药品经营企业还是一个新概念,如何在GSP实施中建立QRM体系,使其质量管理的理念由被动的应付GSP检查变为主动的辨别风险、评估风险并对风险进行控制和回顾,这的确是药品经营企业今后质量管理的难点。本文将对此作重点研究,探析药品经营企业实施有效QRM的具体步骤和方法。
1 QRM的定义
美国FDA最早在2002年发布了“21世纪cGMP——一种基于风险的方法”,首次提出了QRM(Quality risk management)的概念,对QRM系统性的论述来源于人用药注册技术国际协调会议2005年发布的《质量风险管理》第Q9号技术文件(ICH Q9),2008年3月作为欧盟GMP附录20正式生效。我国2010版GMP对于QRM的定义是:在整个产品生命周期中采用前瞻或回顾的方式,对质量风险进行评估、控制、沟通、审核的系统过程[1]。
2 QRM流程[2]概述
QRM是一个不断循环的系统性工程,QRM主要分为风险评估、风险控制、风险审核3个过程,具体流程详见图1。

图1 质量风险管理流程图Fig 1 Flow chart of quality risk management
流程中风险沟通存在于QRM的任何一个环节,其中各种风险管理工具的使用也为QRM提供了科学的依据和有效的方法。
3 QRM在GSP实施中的应用
药品质量风险是在药品生命周期内有关质量方面危害发生的概率和严重程度二者的结合,其存在于从前体化合物筛选、临床试验、新药审批、药品生产、上市后的销售、使用直至撤出市场的整个生命周期[3]。药品经营过程中的质量风险是指在药品购进与验收、药品保管与养护、出库与运输、药品销售和售后服务等环节发生的药品质量方面危害的可能性和严重性的结合。本文结合药品经营企业GSP实践,就药品经营企业如何开展QRM作如下探讨。
3.1 建立药品经营企业的QRM体系
QRM是一个系统工程,因此在药品经营企业中实施QRM必须全盘考虑,建立QRM的组织机构、人员、制度、流程、响应体系,将企业原有的质量管理体系进一步充实和完善。
3.1.1 QRM组织机构的建立。由药品经营企业发文,专门成立QRM组,制定工作职责,在原有质量管理机构职责上补充QRM的内容,管理组织机构见图2。
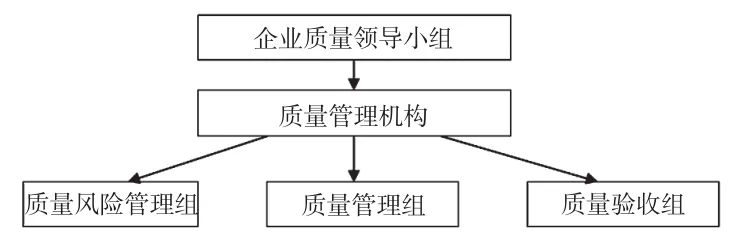
图2 管理组织机构图Fig 2 Chart of quality management organization
3.1.2 QRM的人员与培训。由药品经营企业发文,任命QRM组的组长及成员,组长必须有一定的药品经营企业质量管理经验(最好有风险管理的背景),符合现行GSP实施细则第九条的学历和职称要求,能够对质量风险采取前瞻和回顾的方式进行有效管理[4]。QRM组成员隶属于质量管理人员,必须参加相关的培训和继续教育,建立培训档案;QRM组成员也是直接接触药品的人员,每年必须参加体检并建立健康档案。企业高层特别是企业质量领导小组的负责人(企业质量副总)必须高度重视QRM,对QRM工作进行指导和监督。
3.1.3 建立药品经营企业QRM文件。企业根据实际情况,由QRM组成员起草以下QRM文件。①药品企业QRM规程:根据企业实际情况阐述QRM的目的、使用范围、职责、具体流程及QRM所使用的工具。②年度QRM计划:制定年度QRM目标,即可接受的风险范围和QRM工作内容、进度,规划和指导本年的QRM工作。③质量风险评估及评估报告:辨别和分析药品采购、贮存、出库与运输、销售和服务方面存在的风险,建立风险等级,对存在的风险进行评估,形成风险评估报告。④质量风险处理指导文件:根据评估报告,建立不同质量风险的处理方法和措施。⑤QRM年度回顾和审核文件:采用前瞻和回顾的方式,对一年中的QRM工作进行相关数据记录和汇总,对高风险点进行重点记录,对于质量风险的趋势和有效控制进行前瞻性预测,以指导下一年的QRM工作。
3.2 风险排列和过滤(Risk ranking and filtering,RRF)工具的应用
RFF是QRM工具的一种,是将风险因素进行排列和比较,对每种风险作多重定量和定性评价,权衡因素并确定最后风险得分[5]。该工具比较适合评估和分析系统性风险,对药品经营企业中QRM比较适合。笔者将药品经营企业的质量风险按照其发生的可能性和严重性各分为5个级别:可能性级别分别为几乎不发生(<0.5%)、发生可能性低(0.5%~1%)、发生可能性中等(2%~5%)、发生可能性高(6%~10%)、发生可能性非常高(>10%),评分分别为1、2、3、4、5;严重性级别分别为基本没有、损失可以忽略不计,严重性较低、对企业损失小(<1 000元),严重性中等、造成一定损失(1 000~10 000元),严重性高、造成较大损失(10 000~50 000元)和严重性非常高、损失非常大(>50 000元),评分分别为1、2、3、4、5。
根据发生风险的可能性和严重性,用可能性的分值×严重性的分值=质量风险评分,建立质量风险矩阵,见图3。质量风险评分1~5:低风险,考虑风险接受;6~12:中等风险,需要降低风险;15~25:高风险,马上采取措施,降低风险或者转移风险。
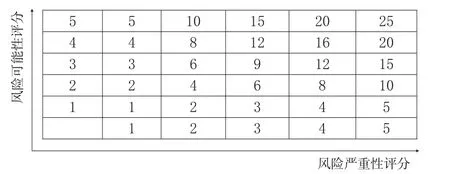
图3 质量风险矩阵评分Fig 3 Scoring chart of quality risk matrix
3.3 GSP实施中药品进货环节的QRM举例
3.3.1 风险识别。风险识别就是通过对药品进货环节中各种影响药品质量的因素和信息进行分析,找出容易发生质量风险的关键点,发现潜在的风险源。可以通过分析以往的历史数据和经验、召开购进与验收人员的质量风险研讨会、参考专家或学者的意见进行风险识别。根据笔者在GSP方面的实践经验和分析,药品进货环节主要有以下几个风险因素:①首营企业和首营品种的审核;②合法销售人员资格的审核;③签订具有质量条款的进货合同。
3.3.2 风险分析。风险分析就是选择合适的QRM工具对识别出的风险因素进行估计,测算出该风险因素发生的可能性和严重性大小,并根据标准评分。笔者选用RRF工具,对药品进货环节的3个风险因素进行评分,可能性评分分别为3、2、1;严重性评分分别为5、4、5。
3.3.3 风险评价。风险评价是指根据预先确定的风险标准,对已经确认并分析的风险进行评价,根据该风险因素发生的可能性和严重性,确定风险的级别。进货环节3个风险因素的风险评分分别为15、8、5,风险级别分别为高风险、中等风险、低风险。
3.3.4 风险控制。风险控制的目的在于将风险降低到可以接受的水平,风险控制的实施一般包括风险降低和风险接受2个部分。所谓风险降低,是针对风险评估中确定的风险,当其质量风险超过可接受水平时,所应采取的降低风险的措施,包括降低风险的严重性和可能性。在实施风险降低措施过程中,有可能将新的风险引入系统,因此应当在措施实施后重新进行风险评估,以确认和评价风险是否发生新变化。所谓风险接受,是指在实施了降低风险的措施之后,风险降低到可以接受的水平,承受风险带来的损失。对于药品进货环节中的3个风险因素,必须采取不同的风险控制措施,并对采取措施后的风险进行重新评估,具体风险控制措施见表1。

表1 药品进货环节的质量风险控制措施Tab 1 Quality risk control measures of drug purchase links
3.3.5 风险沟通。风险沟通是QRM人员及时将相关的风险情况、控制措施与企业其他人员或者药监部门进行分享和沟通,以使风险管理更有效地实施。如,在药品进货环节采取的这些风险控制措施需与购进人员、企业质量管理机构的负责人及企业高层进行及时地沟通和汇报,保证措施的及时、有效实施。
3.3.6 风险审核。风险审核是对风险管理的评审和总结,它虽是一次风险管理工作的最后阶段,但也是风险管理工作的又一次重启,风险管理是持续性的质量管理过程。药品经营企业应该建立定期回顾检查机制,定期召开QRM会议,回顾已经确认的可控风险,前瞻性发现新的风险,撰写年度QRM总结,通过不断的循环往复,使流通环节的药品质量风险始终处于可控状态。
综上所述,本文为我国药品经营企业在GSP实施中的有效QRM提供了具体的方法和步骤,药品经营企业必须看清形势,未雨绸缪,树立正确的QRM意识,选用恰当的QRM工具,建立自身的QRM体系,尽快将QRM融入药品经营与管理的实践中去,提升企业的药品质量管理水平。(浙江医药高等专科学校校级科研项目ZPCSR2012013)
[1] 国家食品药品监督管理局.药品生产质量管理规范(2010年修订)(卫生部令第79号)[EB/OL].http://www.sda.gov.cn/WS01/CL0053/58500.html.2011-02-11.2011-11-10.
[2]ICH.ICHQ9:Quality Risk Management[EB/OL].http://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Quality/Q9/Step4/Q9_Guideline.pdf.2005-11-09.2011-11-09.
[3] 李 钧,李志宁.药品质量风险管理[M].第1版.北京:中国医药科技出版社,2011:1-2.
[4] 国家食品药品监督管理局.GSP实施细则(国药管市[2000]526号)[EB/OL].http://www.sda.gov.cn/WS01/CL0844/19432.html.2000-11-16.2011-11-11.
[5]赖婉枫,解馨.“质量风险管理”在GMP管理过程中的应用[J].中国食品药品监管,2010(6):60.
Application of Quality Risk Management in the Implementation of GSPin China
SHI Neng-jin,LUO Wen-hua,WU Jin
(Zhejiang Pharmaceutical College,Zhejiang Ningbo 315010,China)
DENG Zai-chun
(The Affiliated Hospital of Ningbo University,Zhejiang Ningbo 315020,China)
OBJECTIVE:To provide reference for quality risk management in the implementation of GSPof drug trading enterprises.METHODS:According to the step and methods of risk assessment and risk control as well as risk review,the tools of risk ranking and filtering were used to study quality risk management by the example of the implementation of GSP in drug purchase links.RESULTS&CONCLUSIONS:The drug trading enterprises should have the right consciousness of quality risk management and use the reasonable tools of quality risk management to manage the quality risk during the implementation of GSPefficiently by building the system of quality risk management.
Drug trading enterprises;Quality risk management;GSP;Application
R95
C
1001-0408(2012)41-3844-03
DOI 10.6039/j.issn.1001-0408.2012.41.02
2011-11-15
2012-01-02)
