心脏放射影像检查的收益与危害
2012-11-27崔燕海杨向太郑君惠
崔燕海,杨向太,郑君惠
广东省人民医院暨广东省医学科学院a.放射科;b.导管室,广东 广州 510080
0 前言
据美国资料,公众由于医疗检查所受辐射从1982~2007年增长了6倍;2006年整个医疗检查方面,常规透视、X线摄片及介入透视等非治疗性的辐射量占25%,CT占49%,核医学占26%;2006年心脏CT检查辐射剂量占CT总辐射剂量从以前的4.7%上升到12.1%,2005年核医学心脏检查辐射剂量则从57%上升到85%[1-3]。最近5年,先进的影像设备迅速发展,使得受检个体单一部位检查的辐射剂量明显降低,但应用人群迅速扩大。以冠状动脉CTA为例,2006年64-MSCT设备的辐射剂量平均为14~20 mSv,2011年更先进的CT设备辐射剂量仅为1~3 mSv,其应用也逐渐向高危人群筛查扩展[4-6]。
1 心脏影像检查的平均辐射剂量
普通X线摄片机、血管造影机、CT、SPECT和PET均属于放射性成像设备,前3者放射源为X线,后两者放射源为放射性核素,各种设备对于辐射剂量的计量表示方法不尽相同,多以照射量或吸收剂量为基础。有效剂量用来评价发生辐射损伤随机效应的几率,单位为西沃特(Sv),它以人群的平均值为评价基础,并不区分年龄、性别、肥胖等因素,因此,有效剂量不能准确地描述特定个体的辐射剂量,它反映的是人群的平均概念。各种影像设备进行心脏检查时的有效剂量[7],见表1。
2 电离辐射的生物学效应评估及心脏影像检查的致癌风险
关于辐射致癌风险有两项大型的流行病学研究:日本原子弹爆炸幸存者平均接受剂量为29 mSv,致癌风险为2%,基于15个国家40万放射工人的平均接受剂量为19.4 mSv,致癌风险为2%。涉及医疗照射的较著名研究是关于X线照射与儿童肿瘤关系的牛津调查,人均接受剂量为10 mSv,致癌风险为39%。另外的研究显示接触CT检查后,所有受检人群恶性肿瘤的发生率为0.07%,如果根据研究模型按照年龄、性别分别计算,则60岁男性的恶性肿瘤发生率为1/1911,60岁女性的发生率则高达1/750[8]。
小于100 mSv被认为是低剂量辐射,其致癌风险评估多采用线性无阈值模型,即在低剂量条件下,致癌风险与射线剂量呈线性关系。但线性无阈值模型也存在缺陷,并不被所有研究机构所接受。美国放射学会关于放射剂量与致癌风险相关性报告指出,1~10 mSv心脏影像检查的致癌风险为0.01%,10~100 mSv致癌风险为0.1%。目前,BEIRⅦ模型(美国科学院第7次关于电离辐射生物学效应的报告)被用于评估冠状动脉CTA、钙化积分及心肌灌注成像的辐射致癌风险,它是基于100000例样本得出的报告,综合考虑了年龄、性别及射线剂量因素。年轻人较老年人对射线敏感,女性较男性敏感,老年人低剂量的钙化积分扫描的辐射致癌风险<0.01%,而对年轻女性未采用低剂量扫描方法进行冠状动脉CTA扫描的辐射致癌风险为1%[1]。

表1 心脏影像检查时患者平均接受的辐射剂量
3 心脏影像辐射风险评估存在的不足
线性非阈值模型应用于低剂量辐射下的致癌风险评估不够准确[8]。首先,有效剂量的计算对于个体而言是不准确的。其次,在DNA作用方面,已知低剂量辐射状态下生物体有适应性保护(防御性上调)现象,其与放射性损伤发生双向性作用;多次低剂量辐射的生物学结果也可能不同,例如初次辐射可能仅引起DNA受损,再次辐射才引起癌变。另外,基于正常人群的风险评估模型应用于患者可能不够准确,尤其患者还可能受到其他多种伴发疾病的影响,导致机体抗辐射能力下降。BEIRⅦ模型本身是建立在大量假设的基础之上,其年龄、性别、人种均有限定,对于超出其范围的个体评估可能不准确。
4 辐射剂量管理原则与心脏影像检查降低辐射剂量的方法
ALARA(As Low As Reasonably Achievable)理论作为剂量控制的原则被放射界普遍接受,ALARA是指采用最低的放射剂量来获得合适的图像质量以用于准确诊断。ALARA并不意味着简单降低剂量,因为图像质量与辐射剂量是一对矛盾体,剂量太低会造成图像质量下降导致误诊或需要重新检查,如果重复检查则剂量可能会更高。因此,心脏成像中实行低剂量管理需要在确保诊断可靠性和避免群体危害性这二者之间寻求一个平衡点。各种心脏影像设备降低辐射剂量的具体方法[7,9-11],见表2。
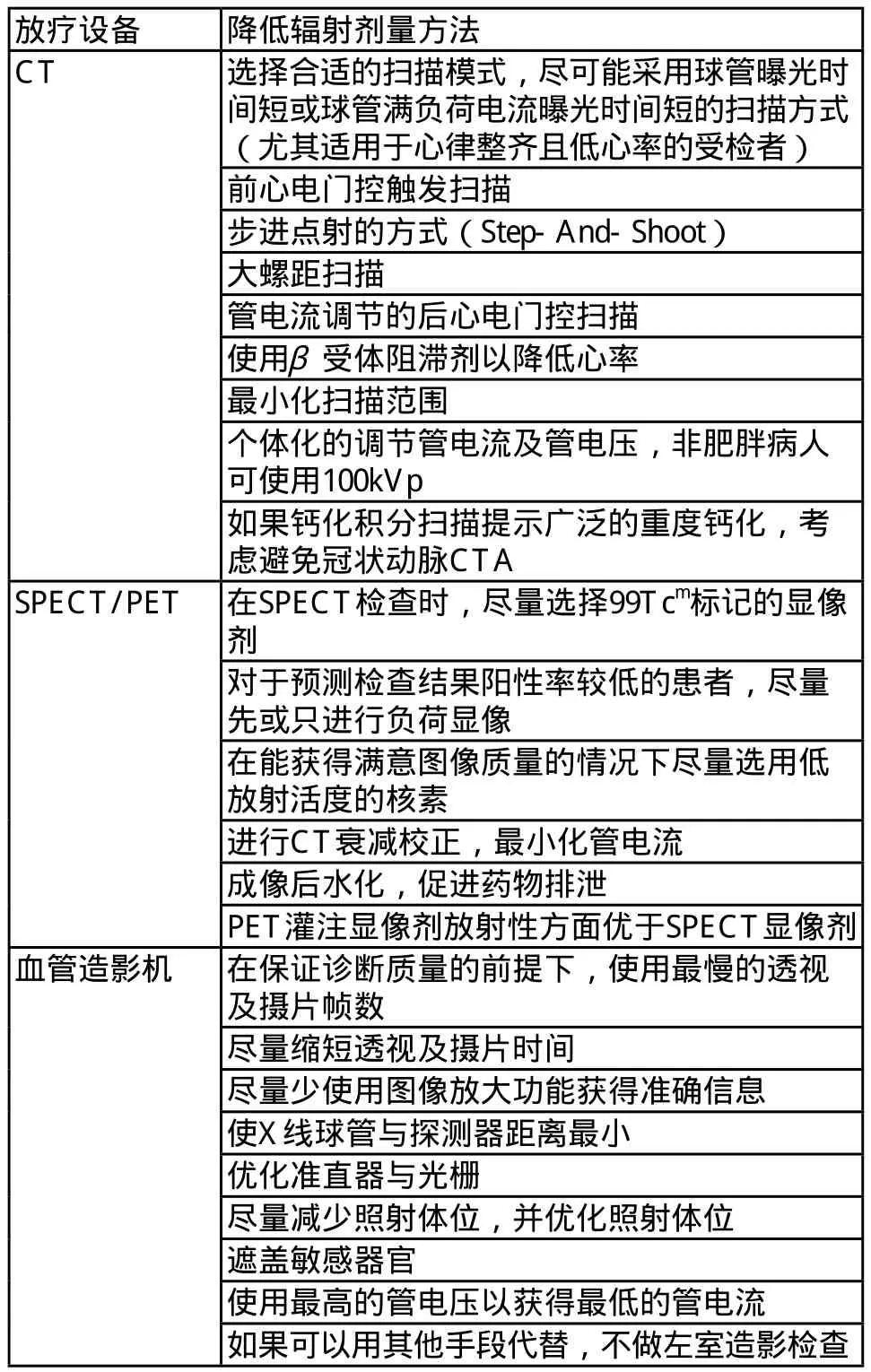
表2 心脏成像时降低辐射剂量的方法
5 如何权衡心脏影像检查风险与收益
在临床实践中,是否采取以及采取何种心脏影像检查不能只考虑患者接受的辐射剂量及相关的致癌风险,还需要考虑经检查后患者可能的收益,如确诊或排除冠心病后患者获得的更有针对性的治疗,引起患者生活质量及生存期的提高及因未做检查的漏诊、误诊风险。对于患者个体是否进行心脏影像检查要综合考虑。例如,50~60岁无症状的男性10年内因冠心病死亡的风险为0%~10%,而他们经历低辐射剂量的前门控心电触发冠状动脉CTA检查后10年内引发癌症致死的风险仅为0.02%[12-13]。值得注意的是:目前在美国和欧洲,对于无症状人群是不推荐进行冠状动脉CTA检查的,给予CLASSIII评价;关于钙化积分扫描(1~3 mSv):中度冠心病风险者(即患病风险10%~20%/10年)给予CLASSIIa(即应用合理)评价,轻中度冠心病风险者(即患病风险6%~10%/10年)给予CLASSIIb(即应用可能合理)评价。对于有症状的患者,其进行心脏影像检查收益更要远远大于辐射风险[14-17]。另外,辐射致癌的潜伏期多为10年以上,远较冠心病发病潜伏期短。考虑到50%的心肌梗塞之前并没有冠心病症状,而且由于设备的进步,目前前瞻性心电触发的冠状动脉CTA剂量可以仅为1~3 mSv,相当于以前的钙化积分剂量,因此,我们认为对于无症状的冠心病高危人群,如果所在单位具有能够进行辐射剂量仅为1~3 mSv的冠状动脉CTA设备,那么进行冠状动脉CTA检查无疑是具有巨大收益的。关于具有电离辐射的心脏影像检查可能的风险与收益情况,见表3。
综上所述,心脏影像检查的辐射剂量属于低剂量范畴,根据流行病学资料,具有一定的致癌风险,但风险极小。对于受检个体的剂量及致癌风险无法做到准确评估。在进行心脏影像检查时应采用ALARA原则,尽量优化检查方案与检查方法,降低辐射剂量。对于无症状的冠心病高危人群及有症状的患者而言,考虑到其巨大的致病、致死风险,不应该把因影像检查而产生的辐射风险当成重要问题来考虑。
[1]Committee to assess health risks from exposure to low levels of ionizing radiation,nuclear radiation studies board,division on earth life studies,national research council of the national academies.Health risks from exposure to low levels of ionizing radiation:BEIR VII phase 2[M].Washington:The National Academies Press,2006.
[2]Ilan Gottlieb,Joao AC Lima.Should all high-risk patients be screened with computed tomography angiography?[J].Circulation,2008,117(10):1318-1332.
[3]Dill T,Deetjen A,Ekinci O,et al.Radiation dose exposure in multislice computed tomography of the coronaries in comparison with conventional coronary angiography[J].Int J Cardiol,2008,124(3):307-311.
[4]Sandra SH,Paul Schoenhagen.Cardiovascular imaging with computed tomography:responsible steps to balancing diagnostic yield and radiation exposure[J].J Am Coll Cardiol Img,2010,3(5):536-540.
[5]Qin J,Liu LY,Fang Y,et al.320-detector CT coronary angiography with prospective and retrospective electrocardiogram gating in a single heartbeat: comparison of image quality and radiation dose[J].Br J Radiol,2012,85(1015):945-951.
[6]郑钧正.不断追求医学影像质量与患者辐射剂量的优化匹配[J].中国医疗设备,2010,25(9):6-9.
[7]Einstein AJ,Knuuti J.Cardiac imaging:does radiation matter?[J].Eur Heart J,2012,33(5):573-578.
[8]Warren KL,Ludwig EF,Ronald DN,et al.Low-level ionizing radiation from noninvasive cardiac imaging: can we extrapolate estimated risks from epidemiologic data to the clinical setting?[J].J Am Coll Cardiol Img,2010,3(5):517-524.
[9]Compagnone G,Campanella F,Domenichelli S,et al.Survey of the interventional cardiology procedures in Italy[J].Radiat Prot Dosimetry,2012,150(3):316-324.
[10]Signorotto P,del Vecchio A,Montorfano M,et al.Dosimetric data and radiation risk analysis for new procedures in interventional cardiology[J].Radiat Prot Dosimetry,2010,142(2-4):201-208.
[11]Fetterly KA,Mathew V,Lennon R,et al.Radiation dose reduction in the invasive cardiovascular laboratory:implementing a culture and philosophy of radiation safety[J].JACC Cardiovasc Interv,2012,5(8):866-873.
[12]Leslee JS,Stephan Achenbach,Y Chandrashekhar,et al.Imaging modalities and radiation:benefit has its risks[J].J Am Coll Cardiol Img,2010,3(5):550-552.
[13]Thomas CG,Raymond JG.Weighing the risks and benefits of cardiac imaging with ionizing radiation[J].J Am Coll Cardiol Img,2010,3(5):528-535.
[14]Philip Greenland,Joseph S Alpert,George A Beller,et al.2010 ACCF/AHA guideline for assessment of cardiovascular risk in asymptomatic adults[J].J Am Coll Cardiol,2010,56(25):50-103.
[15]Bart SFerket,Tessa SS Genders,Ersen BC,et al.Systematic review of guidelines on imaging of asymptomatic coronary artery disease[J].JACC,2011,57(15):1591-1600.
[16]Chow BJ,Small G,Yam Y,et al.Incremental prognostic value of cardiac computed tomography in coronary artery disease using CONFIRM:coronary computed tomography angiography evaluation for clinical outcomes:an international multicenter registry[J].Circ Cardiovasc Imaging,2011,4(5):463-472.
[17]李宏毅,刘宇静,黄志聪.X线影像诊断设备辐射剂量的危害与防护[J].中国医疗设备,2008,23(9):58-59.
