p38MAPK介导的Fas/FasL凋亡信号通路在大鼠抗GBM肾炎中的作用①
2012-11-27王晓天李向阳秦苏萍李小翠尤红娟汤仁仙
王晓天 李向阳 秦苏萍 李小翠 尤红娟 汤仁仙
(徐州医学院病原生物学与免疫学教研室,徐州221002)
大鼠抗肾小球基底膜(GBM)肾炎是利用异体抗大鼠GBM抗体诱导后产生的具有典型的人类新月体性肾炎病理变化的动物模型[1]。此肾炎模型病程的早、中期,肾小球内大量的T细胞、巨噬细胞浸润,肾小球内皮细胞明显增多;病程晚期,肾小球细胞明显减少、纤维化、硬化,最终丧失正常肾功能[1-3]。研究发现,肾小球内细胞数减少与细胞凋亡密切相关[4]。
大量研究表明,丝裂原活化蛋白激酶(MAPK)家族成员p38MAPK在人类新月体性肾小球肾炎发病过程中起到了很重要的作用。目前,研究的热点主要集中在参与炎症反应方面,而对于其是否参与了肾小球细胞凋亡研究很少。p38MAPK调控细胞凋亡的机制非常复杂[5-9],其中p38 MAPK可通过增强Fas/FasL表达促进细胞的凋亡[7]。为此,本实验利用大鼠抗GBM肾炎模型,运用工具药p38MAPK特异性阻断剂SB203580处理该模型,通过观察肾组织中 p-p38MAPK、p38MAPK、FasL、Fas、Caspase-3蛋白表达,肾小球细胞凋亡以及肾组织病理学变化的情况,探讨p38MAPK介导的Fas/FasL通路在大鼠抗GBM肾炎发病机制中发挥重要作用,为临床防治人类新月体性肾炎提供实验理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 正常健康SD大鼠25只,体重180~220克,由徐州医学院实验动物中心提供。
1.1.2 主要试剂 兔抗大鼠GBM血清(本实验室制备并保存);尿蛋白定量测试盒、血肌酐测试盒及血尿素氮测试盒(南京建成生物工程研究所);兔抗大鼠p-p38MAPK多克隆抗体(Santa Cruz公司);羊抗大鼠p38MAPK多克隆抗体(Santa Cruz公司);兔抗大鼠 Fas多克隆抗体(Santa Cruz公司);兔抗大鼠FasL多克隆抗体(Santa Cruz公司);兔抗大鼠active-Caspase-3多克隆抗体(Sigma公司),SB203580(Promega公司);大鼠免疫组化检测试剂盒(北京中杉金桥生物技术有限公司);TUNEL试剂盒(美国Roche公司)。
1.2 方法
1.2.1 复制大鼠抗GBM肾炎模型及动物分组[10]正常SD大鼠10只,实验前在本实验室饲养4天,以适应环境。在此期间单笼收集大鼠24小时尿,测24小时尿蛋白含量,采血收集血清测血肌酐(Scr)和血尿素氮(BUN)含量,所有大鼠的上述指标均无异常。大鼠随机分为两组,肾炎模型组和正常对照组各5只。肾炎模型组大鼠一次性尾静脉注射兔抗大鼠GBM血清;正常对照组大鼠尾静脉注射等量正常兔血清,剂量均为1 ml/100 g[10]。肾炎模型组于实验前1周足垫皮内注射正常兔血清进行预免疫。分别于实验的第2、7、14、21和28天,收集24小时尿液检测24小时尿蛋白含量,心脏采血收集血清检测血肌酐和血尿素氮含量,取肾皮质用于免疫印迹检测。在整个实验过程中肾炎模型组和正常对照组大鼠均未见死亡。
1.2.2 腹腔注射阻断剂SB203580及动物分组 正常SD大鼠15只,实验前在本实验室饲养4天,以适应环境,并检测24小时尿蛋白含量、血肌酐和血尿素氮含量均无异常。复制大鼠抗GBM肾炎模型。随机将大鼠分为三组,每组5只,阻断剂SB203580组于注射兔抗GBM血清后3小时腹腔注射阻断剂SB203580,1 mg/1 kg,隔天注射一次(SB203580 先溶于DMSO配成10 mmol/L的溶液,注射时用无菌生理盐水将其配制成DMSO体积分数为10%的溶液)[11,12];溶媒组大鼠注射等体积的 DMSO 及无菌生理盐水混合物;肾炎模型组不做任何处理。分别于实验第2、7、14天收集24小时尿液检测24小时尿蛋白含量,心脏采血收集血清检测血肌酐和血尿素氮含量。于第14天处死大鼠,取肾皮质,一部分用于HE染色观察肾组织病理改变,一部分用于免疫印迹、免疫组化及TUNEL凋亡检测。
1.2.3 生化指标检测 分别于不同时间点,收集大鼠24小时尿和血清样本,采用考马斯亮蓝法(CBB法)测24小时尿蛋白含量;采用苦味酸除蛋白法测血肌酐含量,二乙酰一肟法测血尿素氮含量。
1.2.4 肾组织病理学检查 SD大鼠经2%戊巴比妥钠麻醉后,取小块肾皮质用多聚甲醛固定后,石蜡包埋,制成切片后行HE染色,光镜观察肾小球体积大小、肾小球内细胞数、新月体形成及肾小管内蛋白管型等情况。
1.2.5 TUNEL法检测肾小球凋亡细胞 按照TUNEL试剂盒说明书进行肾组织切片常规脱蜡水化,蛋白酶K孵育,3%过氧化氢阻断内源性过氧化物酶,封闭滴加TUNEL反应液,37℃孵育60分钟,以标记溶液代替TUNEL反应液作为阴性对照,荧光显微镜观察结果。荧光显微镜下,点状绿色荧光即为阳性细胞。
1.2.6 蛋白免疫印迹检测 取肾皮质组织匀浆、离心,BCA法测定蛋白浓度,进行蛋白定量。SDSPAGE分离后,转移至硝酸纤维素膜,封闭。加1∶1 000一抗4℃过夜,再加1∶1 000二抗室温孵育,显色。用ImageJ软件分析,以待检测指标与GAPDH灰度值的比值来表示其相对含量。
1.2.7 免疫组织化学检测 SD大鼠经2%戊巴比妥钠麻醉后,取小块肾皮质用多聚甲醛固定后,梯度酒精脱水,石蜡包埋,切片,贴片。切片脱蜡,梯度酒精脱水,消除内源性辣根过氧化物酶活性。PBS洗后用血清封闭,一抗4℃过夜,PBS洗3遍,辣根过氧化物酶标记的二抗,37℃孵育30分钟,PBS洗3遍,DAB显色,镜检控制显色时间。然后苏木素复染、梯度酒精脱水、二甲苯透明、中性树脂封片,光镜下观察。
2 结果
2.1 动物分组生化指标变化情况 复制大鼠抗GBM肾炎模型,将大鼠分为两组:肾炎模型组和正常对照组。分别于实验的第2、7、14、21和28天采集尿液和血液做生化指标检测。结果可示(表1):肾炎模型组大鼠24小时尿蛋白量于第2天开始升高,14天达高峰,后逐渐下降,但仍高于正常对照组(P<0.05);血肌酐和血尿素氮于第2天开始升高,并随着病程进展持续上升,各时间点均明显高于正常对照组(P<0.05),这些皆与我们以前的实验结果相一致,表明大鼠抗GBM肾炎模型复制成功[1,4]。
继之,应用p38MAPK阻断剂SB203580处理大鼠肾炎模型,并将大鼠分为三组:肾炎模型组、溶媒组和SB203580组,分别于第2、7、14天做生化指标检测。结果显示(表2),SB203580组第7、14天时24小时尿蛋白量明显减少,血肌酐、血尿素氮水平显著降低。肾炎模型组和溶媒组生化指标无明显改变,与SB203580组比较差异有显著性(P<0.05)。
2.2 动物分组p-p38MAPK、p38MAPK、FasL、Fas、Caspase-3蛋白的表达情况 在成功复制动物模型的基础上,分别于第2、7、14、21和28天,取肾皮质检测 p-p38MAPK、p38MAPK、FasL、Fas、Caspase-3 在不同时间点的表达水平。免疫印迹结果(图1)显示:肾炎模型组大鼠肾组织p38MAPK磷酸化水平于第2天就明显高于正常对照组,此后一直维持在较高水平,与正常对照组相比差异有显著性(P<0.05);而p38MAPK蛋白表达量各时间点与正常对照组相比无明显变化。FasL、Fas蛋白表达量于第2天开始升高,第14天达到高峰,第21天有所下降,但仍高于正常对照组(P<0.05)。Caspase-3是重要的凋亡效应因子,正常情况下,Caspase-3蛋白酶以无活性的前体形式定位在胞浆中,只有当细胞凋亡时才被切割激活为有活性的Caspase-3。因此,用抗active-Caspase-3抗体作免疫印迹分析,检测胞浆中切割后Caspase-3的活性片段,由图1可知,Caspase-3活性于第2天开始升高,第21天达到高峰,与正常对照组相比差异有显著性(P<0.05)。
表1 肾炎模型组和正常对照组大鼠各时间点生化指标(±s,n=5)Tab.1 Biochemical indexes of nephritic group and normal control group in rats(±s,n=5)

表1 肾炎模型组和正常对照组大鼠各时间点生化指标(±s,n=5)Tab.1 Biochemical indexes of nephritic group and normal control group in rats(±s,n=5)
Note:1)P<0.05 vs normal control group.
Time(day) Groups 24 h urinary protein(mg/24 h)Scr(μmol/L)BUN(mmol/L)2 Nephritic group 5.85±0.391) 68.98±2.041) 5.75±0.371)04±0.59 Normal control group 4.96±0.42 60.15±4.75 5.09±0.51 7 Nephritic group 8.27±1.371) 84.76±4.961) 6.41±0.441)Normal control group 5.15±0.97 61.58±5.36 5.18±0.49 14 Nephritic group 26.48±2.431) 99.89±6.031) 7.06±0.621)Normal control group 5.10±1.03 63.37±4.92 5.02±0.51 21 Nephritic group 29.52±2.811) 129.96±6.371) 8.76±0.531)Normal control group 5.37±1.18 64.52±5.75 5.21±0.48 28 Nephritic group 24.31±2.371) 152.37±5.411) 9.91±0.721)Normal control group 5.04±0.94 62.15±4.78 5.
表2 SB203580组、肾炎模型组及溶媒组大鼠各时间点生化指标(±s,n=5)Tab.2 Biochemical indexes of SB203580 group,Nephritic group and Solvent group in rats(±s,n=5)
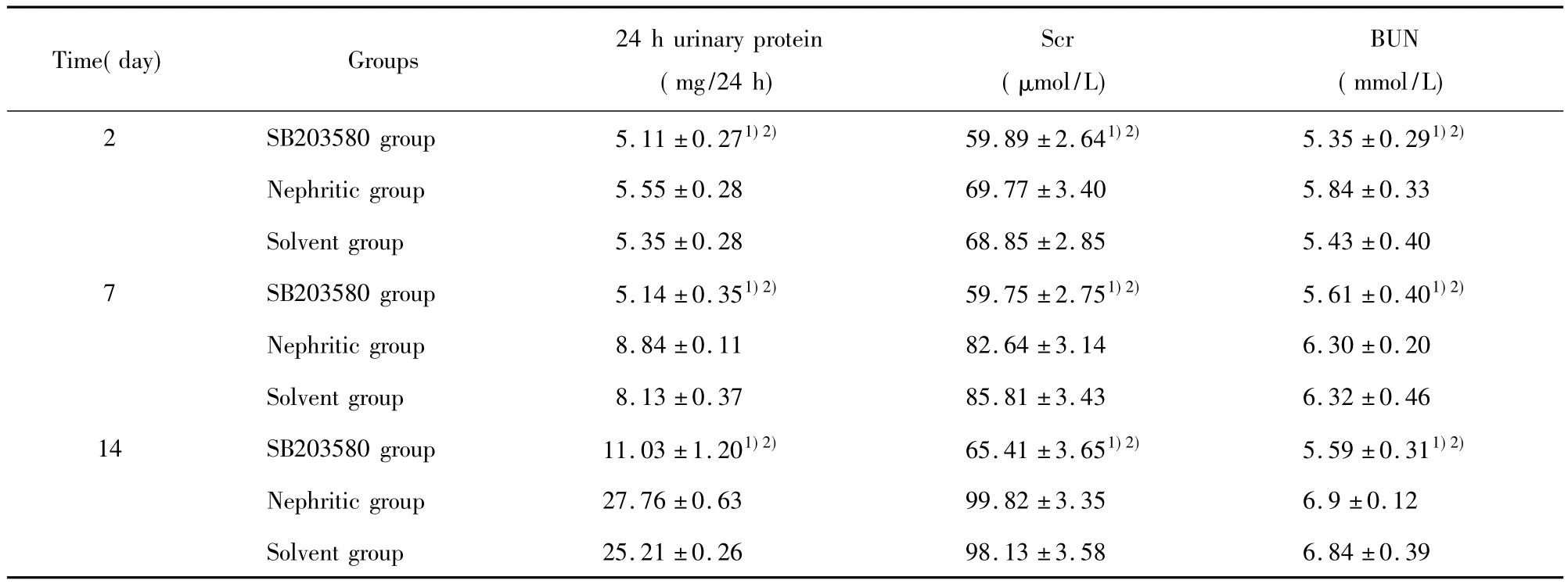
表2 SB203580组、肾炎模型组及溶媒组大鼠各时间点生化指标(±s,n=5)Tab.2 Biochemical indexes of SB203580 group,Nephritic group and Solvent group in rats(±s,n=5)
Note:1)P<0.05 vs Nephritic group,2)P<0.05 vs Solvent group.
Time(day) Groups 24 h urinary protein(mg/24 h)Scr(μmol/L)BUN(mmol/L)2 SB203580 group 5.11±0.271)2) 59.89±2.641)2) 5.35±0.291)2)39 Nephritic group 5.55±0.28 69.77±3.40 5.84±0.33 Solvent group 5.35±0.28 68.85±2.85 5.43±0.40 7 SB203580 group 5.14±0.351)2) 59.75±2.751)2) 5.61±0.401)2)Nephritic group 8.84±0.11 82.64±3.14 6.30±0.20 Solvent group 8.13±0.37 85.81±3.43 6.32±0.46 14 SB203580 group 11.03±1.201)2) 65.41±3.651)2) 5.59±0.311)2)Nephritic group 27.76±0.63 99.82±3.35 6.9±0.12 Solvent group 25.21±0.26 98.13±3.58 6.84±0.

图1 肾炎模型组和正常对照组各时间点肾组织p-p38MAPK、p38MAPK、FasL、Fas和Caspase-3蛋白表达Fig.1 The expression of p-p38MAPK,p38MAPK,FasL,Fas and Caspase-3 in nephritic group and normal control group
随后,应用免疫印迹及免疫组织化学方法检测了肾炎模型第14天时p38MAPK阻断剂SB203580对以上蛋白表达的影响。结果可示,SB203580明显抑制了肾炎模型第14天时肾组织中p38MAPK的磷酸化水平、FasL、Fas的表达以及Caspase-3的活性,而SB203580对肾组织中p38MAPK蛋白的表达无影响(见图2~4)。
2.3 动物分组肾组织病理学反应 本实验室以前的结果显示肾炎模型组大鼠尾静脉注射兔抗大鼠GBM血清后2天[4],肾小球内细胞数稍有增多;14天肾小球内细胞数明显增多,细胞型新月体形成,肾小管内可见大量蛋白管型,间质大量炎性细胞浸润。可见,14天时是肾炎模型组大鼠病理学反应较为严重的时期,因此,本实验选择第14天观察SB203580是否可减轻肾炎大鼠病理学反应。结果显示(图5):肾炎模型组及溶媒组大鼠肾小球内细胞数明显增多,间质淋巴细胞浸润,肾小管内可见大量蛋白管型;而SB203580组,炎症细胞浸润较肾炎模型组明显减少,肾小管内未见蛋白管型。

图2 SB203580组、肾炎模型组及溶媒组第14天肾组织 p-p38MAPK、p38MAPK、FasL、Fas和Caspase-3蛋白表达Fig.2 The expression of p-p38MAPK,p38MAPK,FasL,Fas and Caspase-3 in SB203580 group,Nephritic group and Solvent group on the 14th day

图3 SB203580组、肾炎模型组及溶媒组大鼠第14天肾组织FasL表达情况(免疫组织化学,10×40)Fig.3 The FasL expression of SB203580 group,Nephritic group and Solvent group in rats on the 14th day(p-v two steps,10×40)
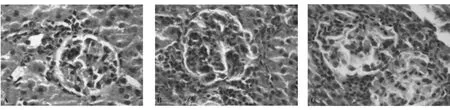
图5 SB203580组、肾炎模型组及溶媒组大鼠第14天肾组织病理学观察(HE,10×40)Fig.5 The pathological changes of SB203580 group,Nephritic group and Solvent group in rats on the 14 th day(HE,10×40)

图6 SB203580组、肾炎模型组及溶媒组大鼠第14天细胞凋亡情况(TUNEL,10×20)Fig.6 The apoptosis of SB203580 group,Nephritic group and Solvent group in rats on the 14 th day(TUNEL,10×20)
2.4 动物分组肾组织细胞凋亡情况 我们以前的实验结果显示,肾炎模型组大鼠肾小球内凋亡细胞数第2天开始升高,于14天达高峰,21天有所减少,但仍维持较高水平[4]。因此,本实验选择14天观察SB203580对肾炎大鼠肾小球内凋亡细胞数的影响。TUNEL结果(图6)可示:肾炎模型组及溶媒组大鼠肾小球、肾小管和肾间质部位可见大量凋亡细胞,镜下呈绿色荧光。SB203580组肾小球、肾小管和肾间质部位也可见凋亡细胞,但数量较模型组及溶媒组明显减少。
3 讨论
大鼠抗GBM肾炎模型是研究人类新月体性肾炎发病机制的常用动物模型,此模型病程的早、中期,肾小球内大量的免疫细胞浸润,肾小球内皮细胞明显增多;至病程晚期,肾小球内细胞明显减少,肾小球纤维化,最终肾功能完全丧失。我们以前的实验表明病程晚期肾小球细胞明显减少与细胞凋亡密切相关,证实细胞凋亡参与了抗GBM肾炎的发病机制,加重了肾炎病变[4]。
研究发现,p38MAPK是诱导细胞凋亡的重要物质之一,炎症细胞如巨噬细胞、中性粒细胞和T淋巴细胞的激活可诱导p38 MAPK的磷酸化,磷酸化的p38 MAPK转位到细胞核,使转录因子(ATF-2、c-Jun、NF-κB)活化,从而调节多种基因的转录和表达,调控细胞的增殖、分化和凋亡[13]。而有关内容目前在人类新月体肾小球肾炎发病机制中少见报道。大量文献显示[5-9],p38 MAPK经多条途径调控细胞凋亡,其中p38 MAPK可通过增强Fas/FasL表达促进细胞的凋亡[7]。此外,我们以前的研究[4]发现,在大鼠抗GBM肾炎中,肾小球细胞凋亡、新月体形成及病程进展与Fas/FasL诱导的细胞凋亡密切相关。因此,大鼠抗GBM肾炎模型中,p38MAPK是否可以诱导肾小球细胞凋亡以及是否可经Fas∕FasL通路诱导,从而加重肾炎病变,是本实验研究的重点。
为了证实以上观点,我们首先成功复制了大鼠抗GBM肾炎模型,并分别于实验的第2、7、14、21和28天取肾组织检测 p-p38MAPK、p38MAPK、FasL、Fas、Caspase-3的表达水平。免疫印迹结果显示:肾炎模型组p38MAPK磷酸化水平于第2天就明显高于正常对照组,此后逐渐上升,一直维持在较高水平,而肾炎模型组p38MAPK蛋白表达量各时间点与正常对照组相比无明显变化;FasL、Fas蛋白表达量于第2天开始升高,第14天达到高峰,第21天有所下降;Caspase-3活性于第2天开始升高,第21天达到高峰。可见,p38MAPK磷酸化水平与FasL、Fas表达,Caspase-3激活趋势基本一致。据此,我们推测:Fas/FasL通路的激活与p38MAPK的活化密切相关。
为了进一步证实这一点,我们选用了p38MAPK的特异性阻断剂SB203580作为工具药检测其对大鼠抗GBM肾炎的作用。SB203580是吡啶咪唑芳基杂环类化合物,与p38MAPK竞争性结合ATP位点,使p38MAPK失去与ATP结合的能力,从而高效抑制p38MAPK的磷酸化,使其失去激酶活性,最终实现对p38MAPK通路的抑制。SB203580于注射兔抗GBM血清后3小时腹腔注射,此后隔天注射一次,于实验第14天处死大鼠,采集标本进行相关研究。之所以选择第14天作为此次研究的重点,是由于pp38MAPK、FasL、Fas的表达以及各项生化指标在第14天明显增高,且肾小球细胞凋亡数于第14天达高峰[4]。
阻断剂SB203580应用后,结果显示:SB203580能够明显减少第7、14天时24小时尿蛋白,降低血肌酐、血尿素氮的水平;第14天时,SB203580抑制了大鼠肾炎模型中 p-p38MAPK、FasL、Fas、Caspase-3的表达;炎症细胞浸润明显减少,肾小管内未见蛋白管型;肾小球、肾小管和肾间质部位凋亡细胞数量明显减少。究其原因,可能是大鼠抗GBM肾炎模型建立后,炎症细胞的激活诱导p38 MAPK磷酸化,磷酸化的p38MAPK转位到细胞核,使转录因子ATF-2、c-Jun活化,从而促进Fas/FasL的表达增加[14];FasL与靶细胞表面的Fas结合,进而启动Caspase级联反应,导致肾组织中细胞大量凋亡,致使病程后期肾小球内细胞数进行性减少,最终加剧了肾小球纤维化,肾功能减退。
总之,通过本实验研究,一方面证实了p38MAPK参与了大鼠抗GBM肾炎的发生发展如炎症反应、细胞凋亡等,并能通过Fas/FasL信号通路诱导细胞凋亡;另一方面其阻断剂SB203580能够减轻大鼠抗GBM肾炎的病理反应,降低生化指标,这均为临床进一步阐明人类新月体性肾小球肾炎的发病机制提供了实验依据,且为防治人类新月体性肾炎提供了新的思路。
1 汤仁仙,王迎伟,黄 瑞et al.大鼠抗GBM肾炎模型的建立及不同病期的生化指标和肾组织病理学观察[J].徐州医学院学报,2003;23(1):9-13.
2 Lou Y H.Anti-GBM glomerulonephritis:a T cell-mediated autoimmune disease? [J].Arch Immunol Ther Exp,2004;52(2):96-103.
3 Schadde E,Kretzler M,Banas B et al.Expression of chemokines and their receptors in nephrotoxic serum nephritis[J].Nephrol Dial Transplant,2000;15(7):1046-1053.
4 张媛媛,苏海燕,秦苏萍et al.Fas/FasL诱导细胞凋亡在大鼠抗肾炎中的作用[J].中国现代医学杂志,2010;20(14):2122-2127.
5 Cannell I G,Kong Y W,Johnston S J et al.p38 MAPK/MK2-mediated induction of miR-34c following DNA damage prevents Myc-dependent DNA replication[J].Proc Natl Acad Sci USA,2010;107(12):5375-5380.
6 Lamy V,Bousserouel S,Goss F et al.Lupulone triggers p38 MAPK-controlled activation of p53 and of the TRAIL receptor apoptotic pathway in human colon cancer-derived metastatic cells[J].Oncol Rep,2011;26(1):109-114.
7 Liu W H,Cheng Y C,Chang L S.ROS-mediated p38alpha MAPK activation and ERK inactivation responsible for upregulation of Fas and FasL and autocrine Fas-mediated cell death in Taiwan cobra phospholipase A(2)-treated U937 cells[J].J Cell Physiol,2009;219(3):642-651.
8 So K S,Oh J E,Han J H et al.Induction of apoptosis by a stilbene analog involves Bax translocation regulated by p38 MAPK and Akt[J].Arch Pharm Res,2008;31(4):438-444.
9 Li T,Feng Z,Jia S et al.Daintain/AIF-1 promotes breast cancer cell migration by up-regulated TNF-α via activate p38 MAPK signaling pathway[J].Breast Cancer Res Treat,2011;131(3):891-898.
10 孙 伟,秦苏萍,李小翠et al.抗大鼠肾小球基底膜肾炎模型建立方法的改进[J].中华医学研究杂志,2008;8(3):193-197.
11 刘永芳,刘先义,刘志刚et al.p38丝裂原活化蛋白激酶在肠缺血再灌注损伤大鼠炎性反应中的作用[J].中华麻醉学杂志,2007;27(9):839-841.
12 臧 颖,陈秋英,李玉莹et al.NF-KappaB、p38MAPK和JNK通路在运动神经损伤引起的大鼠病理性疼痛中的作用及机制[J].中山大学学报,2009;30(6):645-651.
13 Obata T,Brown G E,Yaffe M B.MAP kinase pathways activated by stress:the p38 MAPK pathway[J].Crit Care Med,2000;28(4):N67-N77.
14 Liu W H,Chang L S.Piceatannol induces Fas and FasL up-regulation in human leukemia U937 cells via Ca2+/p38alpha MAPK-mediated activation of c-Jun and ATF-2 pathways[J].Int J Biochem Cell Biol,2010;42(9):1498-1506.
