水中游离二氧化碳与碳酸盐零共存现象研究
2012-11-25宋树成郭如侠
宋树成,郭如侠
(河北省张家口水文水资源勘测局,河北 张家口075000)
1 概述
1.1 现行碳酸盐的测定方法
在水质化验中,水中碳酸盐的测定方法为酸碱滴定法,根据SL83—94《中华人民共和国水利行业标准》,原理为:水样用标准酸溶液滴定至规定的pH值,其终点由加入的酸碱指示剂在该pH值时颜色的变化来判断,即当滴定至酚酞指示剂由红色变为无色时,溶液pH值即为8.3,指示水中氢氧根离子已被中和,碳酸盐均变为重碳酸盐,根据盐酸的使用量即可计算出碳酸盐的含量[1]。
1.2 现行游离二氧化碳的测定方法
在水质化验分析中,现行的水中游离二氧化碳的测定采用SL80—94《中华人民共和国水利行业标准》,该方法属于碱滴定法,原理为:利用游离二氧化碳能定量与氢氧化钠发生如下反应:
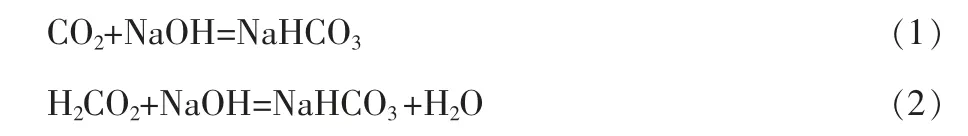
当其达到终点时,溶液的pH值约为8.3,选择酚酞作为指示剂,用氢氧化钠溶液滴定水中游离二氧化碳,根据氢氧化钠的标准溶液消耗量,计算出游离二氧化碳的含量[1]。
1.3 问题的提出
由于碳酸盐和游离二氧化碳的测定原理是同一种方法的正反两种应用,在原则上,用pH值即可以判定碳酸盐或游离二氧化碳的存在:当溶液pH值大于8.3时[2],溶液中有碳酸盐的存在,而当溶液pH值小于8.3时,溶液中有游离二氧化碳存在。在实际操作中,这两种物质的滴定均以酚酞作指示剂来进行滴定终点判定:当滴加酚酞后,溶液产生粉色,则说明溶液中存在碳酸盐,滴定为无色为止;当滴加酚酞后,溶液不产生红色,则说明溶液中存在游离二氧化碳[2],滴定为刚刚出现粉色为止。于是在实际检测操作中,游离二氧化碳和碳酸盐便不会同时出现,而是二者必有其一。而笔者在两年多的检测实践中,却发现应该有游离二氧化碳和碳酸盐同时不存在的现象发生,称之为“游离二氧化碳和碳酸盐的零共存现象”,所谓“零共存现象”,实际上是用现行方法测定碳酸盐和游离二氧化碳的结果经过合理性检验后出现的数据处理现象。本文就此现象加以分析研究。
2 合理性检验依据
由于pH值、碳酸盐和游离二氧化碳存在内在的约束关系,当对某一溶液测定完这3项时,通常要进行一个合理性检验:当溶液中测出碳酸盐时,所测pH值是否大于8.3,或者当溶液中测出游离二氧化碳时,所测溶液pH值是否小于8.3时。这里有两个关键问题需要明确:滴定终点pH值8.3是怎么来的,滴定终点的判定是否合理。
2.1 滴定终点的由来
pH值8.3为碳酸盐和游离二氧化碳滴定的终点,这是由酸碱平衡所决定的,以下加以简单推导。
在分析化学中,碳酸盐(CO32-)属于二元弱碱,我们常用强酸HCl溶液进行滴定。
CO32-是HCO3-的共轭碱,根据酸碱平衡理论,CO32-的pKb1=3.75,pKb2=7.62,平衡关系如下:
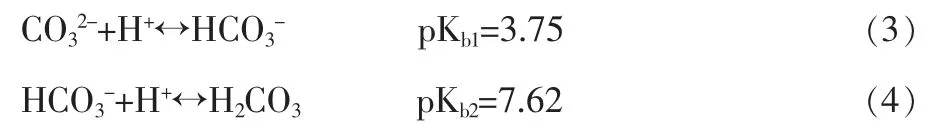
式中 Kb1为CO32-的第1步平衡常数;Kb2为CO32-的第2步平衡常数。
由上述可以看出,CO32-的中和滴定是分步完成的,先被中和生成HCO3-,根据酸碱平衡理论,便可得出第1步反应的化学计量点的[H+]值为:

从而求得相应的pH值为:pH1=8.32。
在实际操作中,即以pH值等于8.3作为碳酸盐的测定终点。
2.2 滴定终点的判定
现行对游离二氧化碳和碳酸盐的滴定终点均采用酚酞的变色进行判定,酚酞是分析化学中常用的指示剂,为无色的二元弱酸,有在不同酸碱度下变色的特性,其变色机理为:当溶液中的pH值渐渐升高时,酚酞先给出一个质子H+,形成无色的离子;接着再给出第2个质子H+并发生结构的改变,成为具有共轭体系醌式结构的红色离子。当溶液成为较浓的强碱性溶液时,又进一步转变为羧酸盐式离子,而使溶液褪色[2]。酚酞结构变化的过程是可逆的,当溶液pH值变小时,平衡开始向反方向移动,酚酞则变成了无色分子。
在水质化验中,当溶液的pH<8.2,酚酞为无色,溶液8.2≤pH≤10时,酚酞逐渐由无色变为红色;当溶液的pH>10时,酚酞为红色,这个过程称为酚酞的“变色范围”。下面对酚酞的变色范围加以简单推导。
酚酞的“变色范围”可以由指示剂在溶液中的平衡移动来解释。现用HIn表示酚酞指示剂,整个“变色范围”可以简单地表示如下:

达到平衡时它的指示剂常数KHIn为:

可以变形为:

方程(8)中,[In-]代表碱式颜色的深度,[HIn]代表酸式颜色的深度。从式(8)可以看出,两者浓度的比值是由指示剂常数KHIn和溶液的酸度[H+]两个因素决定的,而KHIn在一定温度下为常数,所以酚酞颜色的变化就取决于溶液中的[H+]了。当[In-]与[HIn]两者相等时,KHIn等于[H+],此时的溶液为中间色;当[In-]与[HIn]的比值为10/1时,人眼能勉强辨认出酸色;当[In-]与[HIn]的比值大于10/1时,目力就看不出酸色了。因此变色范围的一边为:
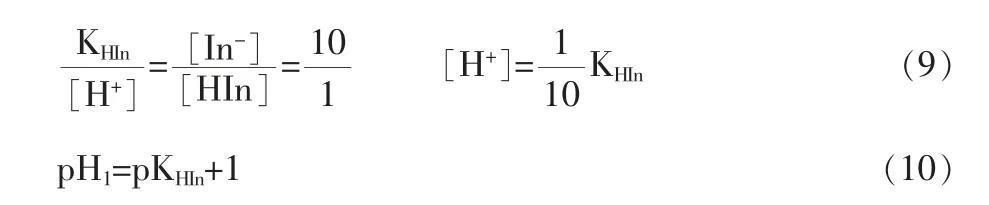
25 ℃时,酚酞的pKHIn为9.1,则

同理也可以求得,当[In-]与[HIn]的比值为1/10时,人眼能勉强辨认出碱色,变色范围的另一边为:

通过以上分析可以看出,酚酞的变色范围应该为8.1~10.1,然而实际的变色范围仍依靠人眼的观察测定出来,说明实际测定出来的变色范围受主观因素影响,主要因为人眼对于颜色的敏感程度不同,所以造成各种书刊报道的范围不同,多数认为是8~10,也有认为是8.2~10,个人认为,酚酞的变色范围发生在碱性区域内,在计算pH1时,[In-]与[HIn]的比值应该在稍大于1/10时,就看不出碱色了,由此推算,pH1也应该稍大于8.1,酚酞的变色范围是8.2~10[3]。
2.3 测定方法的商榷
由上述分析可知,当溶液的pH值大于8.2时,酚酞便开始出现粉色,只是由于各种溶液具体离子的影响及加入量的不同,颜色的深浅不一,明显程度有所不同,在实际检测中,也发现此种现象的存在。
在实验室水质化验中,通过3a时间对张家口市部分地区地表水、地下水、饮用水等各类水样进行实际检测分析中发现,当pH值介于8.2~8.3之间时,酚酞也出现变色现象,说明当pH值介于8.2~8.3之间时也能滴定出碳酸盐,与标准方法产生矛盾,见表1。
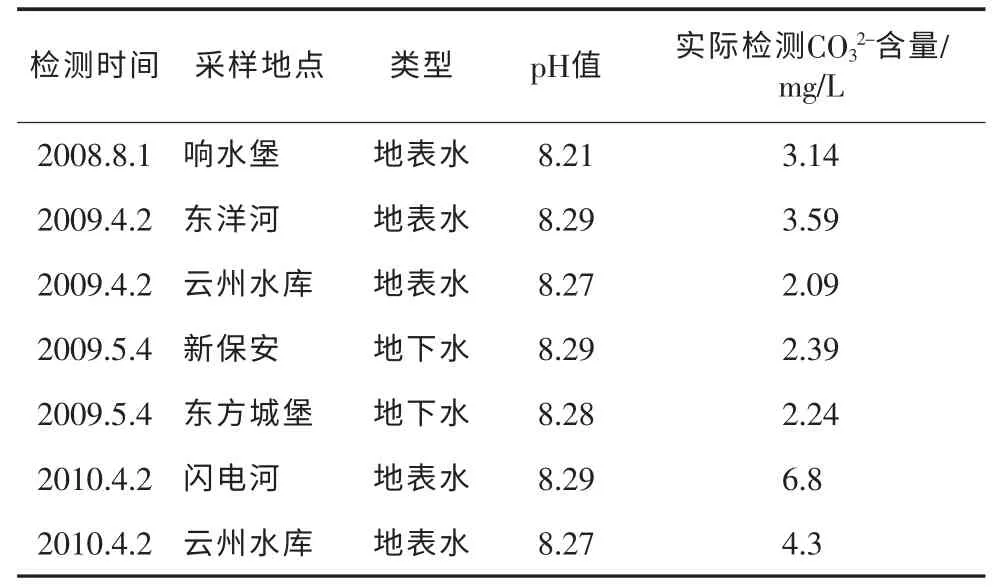
表1 张家口市部分地区部分水样pH值与CO32-实际检测值对比
问题出现在指示剂的选择上。两种物质的现行测定方法均以酚酞作为指示剂,由上述分析可知酚酞的变色范围为8.2~10,与标准方法中分析得到的临界值8.3便有了出入,这就是当溶液pH值介于8.2~8.3之间时也能滴定出碳酸盐来的原因。
3 零共存现象
3.1 常规数据处理方案
当pH值介于8.2~8.3时,根据CO32-的酸碱平衡理论,及SL83—94《中华人民共和国水利行业标准》中的碱度测定的酸滴定法,是不应该有CO32-出现的,这时应该有游离二氧化碳的存在,但是按照现行标准的测定方法,用酚酞作指示剂,却能看到粉色,即能滴定出CO32-,而滴不出游离二氧化碳。当出现这种现象时,常规的数据处理方案是:把pH值改大,即承认碳酸盐的存在。理由是认为用pH计测量溶液pH值时,存在一定的测量误差,所测pH值不甚精确,从而导致矛盾的出现。
3.2 “零共存”概念的提出
从上述分析可知,矛盾的出现是有理论依据的,并不是由pH值的测量误差所导致。
事实上,这时滴定出的CO32-并非溶液中实际存在的CO32-,而是由于指示剂选择不当造成的误差;真实情况应该是存在少量游离二氧化碳,但同样由于指示剂选择的原因,而未能检出。这样,在检测数据处理时,就应该把检出的CO32-量(误差值)舍掉,于是就出现这样的现象:游离二氧化碳和碳酸盐以“零”的形态共存,笔者称之为“零共存现象”。这种现象一般只发生在溶液的pH值介于8.2~8.3时,这种现象实际上是检测数据合理性检查的处理结果。
另外,由于选择酚酞作为指示剂,当滴定CO32-时,终点应该在pH值等于8.3,而实际终点停在pH值等于8.2处,这样就导致所测CO32-比实际值偏大;当滴定游离二氧化碳时,由于同样的原因,所测值比实际值偏小,以至于当pH值介于8.2~8.3时,测不出游离二氧化碳值。
4 结论及建议
4.1 结论
(1)当pH>8.3时,检测数据有CO32-而游离二氧化碳为零;当pH≤8.2时,检测数据有游离二氧化碳而CO32-为零;当8.2<pH≤8.3时,检测数据CO32-和游离二氧化碳均为零,即游离二氧化碳与碳酸盐零共存。
(2)用现行标准检测方法,所测CO32-值偏大,游离二氧化碳值偏小。
(3)酚酞的变色范围为8.2~10,所以现行的SL83—94《中华人民共和国水利行业标准》中的描述“当滴定至酚酞指示剂由红色变为无色时,溶液pH值即为8.3”不准确。在室温情况下,碳酸根被滴定的终点为pH值8.3左右,具体数值与水中的其他离子的存在及水温有一定关系,用酚酞指示剂作为判定CO32-被完全中和为HCO3-有所不妥。
4.2 改进意见
为了克服上述缺点,建议应该把SL83—94《中华人民共和国水利行业标准》 中规定的酚酞试剂换成甲酚红和百里酚蓝混合指示剂,由于其变色时pH值为8.3,pH值≤8.3时,颜色为玫瑰红,当pH值>8.3时,呈现清晰的紫色,终点变色比较明显,监测数据会更准确些。
当溶液pH值介于8.2~8.3时,溶液中本不应该存在CO32-,但用现行的方法却能测得CO32-的量,这时应该把所测得的CO32-数据舍掉,使游离二氧化碳和CO32-“零共存”。
[1]SL80—94,游离二氧化碳的测定(碱滴定法)[S].
[2]华东理工大学分析化学教研组.分析化学[M].北京:高等教育出版社,1994.
[3]汪葆浚.中和法[M].北京:人民教育出版社,1964.
[4]郭如侠.地下水中碱度测定方法研究[J].安徽农业科学,2010,38(2).
