西洋参茎叶化学成分及生物利用度的研究
2012-11-24邱楠楠刘金平李平亚
邱楠楠,刘金平,艾 民,李平亚*
1吉林大学再生医学科学研究所,长春130021;2长春大学,长春130022
西洋参茎叶化学成分及生物利用度的研究
邱楠楠1,刘金平1,艾 民2,李平亚1*
1吉林大学再生医学科学研究所,长春130021;2长春大学,长春130022
应用多种色谱技术进行分离纯化,从西洋参茎叶中分离得到10个化合物,经理化性质和光谱数据分析鉴定分别为:拟人参皂苷RT4(1)、拟人参皂苷RT5(2)、24(R)-Ocotillol苷元(3)、20(S)-人参皂苷Rh1(4)、20 (S)-人参皂苷Rg1(5)、20(S)-人参皂苷Rg2(6)、20(S)-人参皂苷Rh2(7)、20(R)-人参皂苷Rh2(8)、20(S)-人参皂苷Rg3(9)、拟人参皂苷F11(10)。化合物1和3为首次从西洋参茎叶中分离得到。首次建立和认证了20 (S)-人参皂苷Rg3肌内注射的生物利用度的测定方法,采用本文方法测定犬肌注20(S)-人参皂苷Rg3的生物利用度为96.7%,为20(S)-人参皂苷Rg3的新药开发提供了临床前药代动力学依据。
西洋参茎叶;化学成分;20(S)-人参皂苷Rg3;肌内注射;生物利用度
西洋参(Panax quinquefolium L.),为五加科人参属多年生宿根草本植物,是闻名于世的珍贵药用植物。其性寒凉、味微苦,具有益肺阴、清虚热、生津止渴之功效。西洋参原产于北美洲的原始森林,我国自20世纪80年代起大面积引种并获得成功。研究表明,西洋参的主要活性成份为四环三萜类皂苷[1],并且皂苷类成分在西洋参茎叶部位的含量明显高于根部,为了综合利用西洋参资源,国内外学者开始了对西洋参地上部分(茎、叶)的主要活性成份―西洋参茎叶皂苷的研究。本文从吉林省抚松产西洋参茎叶中提取分离得到了20(S)-人参皂苷Rg3等三萜皂苷类成分10种。
20(S)-人参皂苷Rg3具有抗癌生物活性[2-5]。李平亚,等[6]报道了20(S)-人参皂苷Rg3合成工艺成熟、质量标准可控,在抗癌、抗病毒方面具有很强的生物活性,毒性较低,具备了良好的成药性。刘继华,等[7]发现20(S)-人参皂苷Rg3在脏器中的含量分布为肺>脾>心>肾>肝。有关20(S)-人参皂苷Rg3肌内注射的生物利用度未见报道,因此,本实验首次采用Beagle犬的肌内给药和静脉给药不同给药途径对犬肌内注射20(S)-人参皂苷Rg3的生物利用度进行研究,为开发20(S)-人参皂苷Rg3创新药物提供科学依据。
1 材料与仪器
1.1 材料
柱色谱硅胶(300~400目)、薄层色谱硅胶(GF254)均为青岛海洋化工厂生产,所用试剂均为分析纯;西洋参茎叶为吉林省抚松县大自然生物工程有限公司惠赠;20(S)-人参皂苷Rg3自制,纯度98.5%;Beagle犬由长春高新医学动物实验研究中心提供。
1.2 仪器
DRX-500型核磁共振仪,美国 Bruker公司生产;XT4-100B显微熔点测定仪,上海荆和分析仪器有限公司生产;1525型高效液相色谱仪,美国Waters公司生产;高效液相色谱仪LC-10ATVP,日本岛津公司生产;SEDEX 75蒸发光散射检测器,法国生产;N-2000色谱数据工作站,浙江大学智能信息工程研究所生产;旋涡混合器,上海精科实业有限公司生产;800型离心沉淀器,上海手术器械厂生产;分析天平,上海天平仪器厂生产;KQ-50B型超生波清洗器,昆山市超声仪器有限公司生产;Strata C18-E固相萃取柱,法国迪马公司生产。
2 实验方法
2.1 提取分离
取干西洋参茎叶2 kg,以70%的乙醇回流提取,提取液经浓缩后,用氯仿萃取3次,合并提取液,回收溶剂得氯仿层(8 g)。水层经大孔吸附树脂柱,依次用水、70%乙醇、95%乙醇洗脱,分别收集洗脱液。70%乙醇洗脱液经减压浓缩,真空干燥,得到156 g总皂苷。总皂苷经反复硅胶柱层析,以氯仿∶甲醇40∶1~1∶1进行洗脱、分离。结合制备薄层、重结晶等方法得到化合物3(32 mg)和化合物10(27 mg);柱层析洗脱至10∶1,结合制备HPLC得到化合物4(120 mg)、化合物7(96 mg)和化合物8(50 mg);柱层析洗脱至8∶1,结合制备HPLC得到化合物1(12 mg)和化合物2(11.5 mg);柱层析洗脱至6∶1,结合制备HPLC得到化合物6(22 mg),结合C-18反相柱层析,得到化合物5(16 mg)和化合物9 (31 mg)。
2.2 20(S)-人参皂苷Rg3肌内注射的生物利用度研究
2.2.1 测定方法的建立和认证
本实验严格按照《化学药品临床前药代动力学研究指导原则》[8]研究“20(S)-人参皂苷Rg3”肌内注射的生物利用度。采用高效液相-蒸发光散射检测法(HPLC/ELSD)[9]进行血浆样品的测定。
2.2.1.1 犬血浆样品处理方法
取犬血浆2 mL,加入甲醇8 mL,震荡混匀,离心10 min(3000 rpm),分取上清液,加蒸馏水10 mL,经Strata固相萃取柱萃取,先以70%甲醇4 mL洗脱,再以甲醇2 mL洗脱,收集甲醇部分,于40℃水浴中氮气吹干,残渣以100 μL色谱甲醇溶解,吸取10 μL进样检测。
2.2.1.2 特异性试验
取犬空白血浆2.0 mL,另取一份空白血浆加入一定量20(S)-人参皂苷Rg3及内标物Rh2对照品,并取给药后犬血浆2.0 mL,照“血浆样品处理方法”项下操作,分别吸取10 μL,进样检测。
2.2.1.3 标准工作曲线
配制20(S)-人参皂苷Rg3的甲醇溶液,其浓度分别为50、100、300、600、1200 ng/mL,内标物人参皂苷Rh2的浓度为600 ng/mL,分别吸取各个浓度的标准品溶液2.0 mL,N2气下挥干甲醇,残渣加入色谱甲醇100 μL,吸取10 μL,依照高效液相色谱法测定。系统条件:ODS色谱柱(4.6 mm×250 mm);流动相:甲醇—水(86.5∶13.5);流速:1.0 mL/min;检测器:蒸发光散射检测器,雾化室温度:50℃;灵敏度为10;载气:N2,压力:3.4 Bar。
2.2.1.4 犬血浆样品测定的校正工作曲线
准确吸取20(S)-人参皂苷Rg3的对照品溶液和人参皂苷Rh2的对照品溶液一定量,于N2下挥干甲醇,加入空白犬血浆2.0 mL,制成含20(S)-人参皂苷Rg3的浓度为50、100、300、600、1200ng/mL,内标物人参皂苷Rh2浓度为600 ng/mL的标准液,照“犬血浆样品处理方法”项下操作,残渣加色谱甲醇100 μL溶解,吸取10 μL进样检测。
2.2.1.5 精密度、稳定性与回收率实验
取犬空白血浆2.0 mL,加入20(S)-人参皂苷Rg3对照品,使其浓度分别为80、200、1000 ng/mL;内标物人参皂苷Rh2对照品,使其浓度为600 ng/ mL,照“血浆样品处理方法”项下操作,进行日内精密度、日间精密度、稳定性和回收率实验。
2.2.2 犬肌注20(S)-人参皂苷Rg3的生物利用度研究
2.2.2.1 肌内注射20(S)-人参皂苷Rg3的血药浓度测定
犬5条,分别肌注20(S)-人参皂苷Rg30.5 mg/ kg,并于给药后0.083、0.167、0.333、0.5、1.0、1.5、2.0、4.0、6.0 h从前腿静脉取血5 mL,置含有肝素的塑料离心管中,离心10 min(3000 rpm),取血浆样品2 mL进行检测。
2.2.2.2 静脉注射20(S)-人参皂苷Rg3的血药浓度测定
犬5条,分别静脉注射20(S)-人参皂苷Rg30.5 mg/kg,并于给药后0.083、0.167、0.333、0.5、1.0、1.5、2.0、4.0、6.0 h从前腿静脉取血5 mL,置含有肝素的塑料离心管中,离心10 min(3000 rpm),取血浆样品2 mL进行检测。
3 结果与讨论
3.1 化合物结构鉴定
化合物1 白色粉末(MeOH),易溶于甲醇、乙醇。TLC检测,10%硫酸乙醇溶液显紫色。Liebermann-Burchard反应阳性,Molish反应阳性。10%硫酸水解检出葡萄糖;50%醋酸部分水解未检出糖。1H NMR(500 MHz,C5D5N)δ:2.08(3H,s),1.62 (3H,s),1.45(3H,s),1.31(3H,s),1.27(3H,s),1.22(3H,s),1.06(3H,s),0.76(3H,s)为甲基质子信号,δ5.05(1H,d,J=7.5Hz)为糖端基质子信号。13C NMR(125 MHz,C5D5N)δ:39.54(C-1),27.99 (C-2),78.29(C-3),40.44(C-4),61.57(C-5),78.60(C-6),45.13(C-7),41.05(C-8),50.38(C-9),39.67(C-10),32.54(C-11),70.88(C-12),49.14(C-13),52.24(C-14),31.73(C-15),25.80 (C-16),49.50(C-17),17.79(C-18),17.20(C-19),87.09(C-20),27.01(C-21),32.71(C-22),28.70 (C-23),88.45(C-24),70.02(C-25),26.60(C-26),29.02(C-27),32.22(C-28),16.36(C-29),17.91 (C-30),106.07(C-6-glc-1'),75.49(C-6-glc-2'),80.19(C-6-glc-3'),71.86(C-6-glc-4'),79.74(C-6-glc-5'),63.11(C-6-glc-6')。其波谱数据与文献[10]报道的拟人参皂苷RT4数据基本一致,故鉴定化合物1为拟人参皂苷RT4。
化合物3 无色针晶(MeOH),mp.211~213℃,易溶于甲醇、乙醇。TLC检测,10%硫酸乙醇溶液显紫色,Liebermann-Burchard反应阳性,Molish反应阴性。1H NMR(500 MHz,C5D5N)δ:0.90(3H,s),0.95(3H,s),1.10(3H,s),1.25(3H,s),1.25(3H,s),1.42(3H,s),1.46(3H,s),1.97(3H,s)为甲基质子信号。4个连氧碳上的氢质子信号:δ3.50(1H,dd,J=11.5,5.0 Hz),3.71(1H,dt,J=10.5,5.0 Hz),3.94(1H,dd,J=8.5,7.0 Hz),4.40(1H,m)。13C NMR(125 MHz,C5D5N)δ:39.42(C-1),28.11(C-2),78.41(C-3),40.39(C-4),61.94(C-5),67.73(C-6),47.46(C-7),41.12(C-8),50.47 (C-9),39.26(C-10),32.45(C-11),71.19(C-12),49.42(C-13),52.14(C-14),31.82(C-15),28.80 (C-16),48.37(C-17),17.16(C-18),17.77(C-19),86.72(C-20),26.98(C-21),31.71(C-22),25.48 (C-23),85.63(C-24),70.37(C-25),27.13(C-26),27.62(C-27),31.91(C-28),16.47(C-29),18.33 (C-30)。其波谱数据与文献[11]报道的24(R)-Ocotillol苷元数据基本一致,故鉴定化合物3为24(R)-Ocotillol苷元。
3.2 20(S)-人参皂苷Rg3肌内注射的生物利用度的测定方法的建立和认定结果
3.2.1 特异性实验结果
结果表明,血浆中待测物为原形药物,并且血浆中内源性物质不干扰检测,20(S)-人参皂苷Rg3的保留时间为11.0 min左右,Rh2的保留时间为22.9 min左右,对照品前后均无杂质峰干扰。结果分别见图1~3。最低检测限度为50 ng/mL。
图3 加入Rg3、Rh2对照品的犬血浆样品图谱Fig.3 The blank dogs plasma spiked with ginsenoside Rg3and Rh2
3.2.2 标准工作曲线的绘制结果
以20(S)-人参皂苷Rg3浓度的对数为横坐标,以20(S)-人参皂苷Rg3和Rh2峰面积的对数之比为纵坐标,进行线性回归,所得标准工作曲线的回归方程为:y=0.4612+0.1923x,r=0.997。结果表明,20(S)-人参皂苷Rg3在50~1200 ng/mL的浓度范围内线性关系良好,最低检测限度为50 ng/mL。
3.2.3 犬血浆样品测定的校正工作曲线绘制结果
以20(S)-人参皂苷Rg3浓度的对数为横坐标,以20(S)-人参皂苷Rg3和Rh2峰面积的对数之比为纵坐标,进行线性回归,所得标准工作曲线的回归方程为:Y=0.5048+0.1905X,r=0.996。结果表明,20(S)-人参皂苷Rg3在浓度为50~1200 ng/mL范围内,线性关系良好,最低检测限为50 ng/mL。
3.2.4 精密度、稳定性与回收率实验结果
精密度、稳定性与回收率实验结果表明,方法的日内精密度,日间精密度和回收率均符合要求,仪器的稳定性也符合要求。结果见表1。

表1 精密度、回收率与稳定性实验结果Table 1 Precision,recovery and stability test of ginsenoside Rg3in dogs plasma
总之,采用高效液相-蒸发光散射检测法(HPLC/ELSD)[13]对血浆样品进行测定,该方法经标准曲线(校正曲线)制备,方法学认证考察,表明该方法符合新药药代动力学试验的技术要求。
3.3 犬肌注20(S)-人参皂苷Rg3的生物利用度研究结果
3.3.1 肌内注射20(S)-人参皂苷Rg3的血药浓度测定结果
通过犬肌内注射20(S)-人参皂苷Rg3的血药浓度测定结果,绘制犬肌内给药后的血药浓度—时间曲线,见图4。
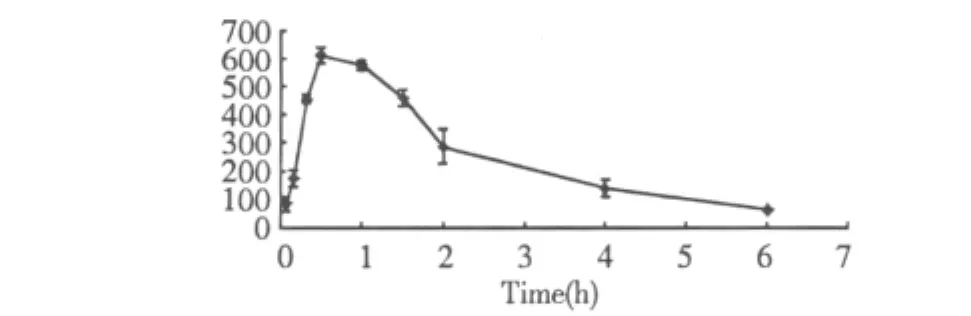
图4 犬肌注给药后的血药浓度-时间曲线Fig.4 The plasma concentration versus time curve after dogs were intramuscular injection given 20(S)-ginsenoside-Rg3
3.3.2 犬肌注给药的药代动力学参数
将肌注给药后各个时间点的血药浓度测定主数据经“3P87”药代动力学程序拟合,判断肌注给药后,20(S)-人参皂苷Rg3在犬体内的药代动力学模型为一室模型。药代动力学参数结果见表2。
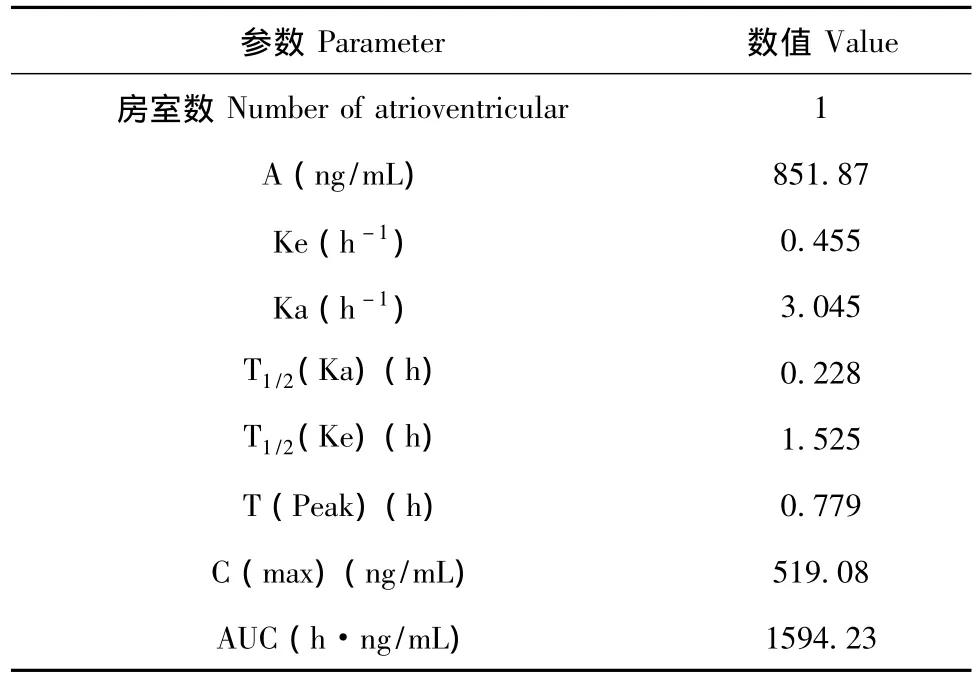
表2 犬肌注给药的药代动力学参数Table 2 Pharmacokinetic parameters of dogs were intramuscular injection given 20(S)-ginsenoside-Rg3
3.3.3 静脉注射20(S)-人参皂苷Rg3的血药浓度测定结果
通过犬静脉注射20(S)-人参皂苷Rg3的血药浓度测定结果,绘制犬静脉注射后的血药浓度—时间曲线,见图5。
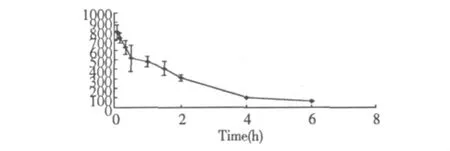
图5 犬静脉注射给药后的血药浓度-时间曲线Fig.5 The plasma concentration versus time curve after dogs were intravenous injection given 20(S)-ginsenoside-Rg3
3.3.4 犬静脉注射给药的药代动力学参数
将静注给药后各个时间点的血药浓度测定主数据经“3P87”药代动力学程序拟合,判断静注给药后,20(S)-人参皂苷Rg3在犬体内的药代动力学模型为一室模型。药代动力学参数结果见表7。

表3 犬静注给药的药代动力学参数Table 3 Pharmacokinetic parameters of dogs were intravenous injection given 20(S)-ginsenoside-Rg3
本实验对犬给药进行20(S)-人参皂苷Rg3的生物利用度研究中,其药代动力学特征可归纳如下:犬肌注人参皂苷20(S)-人参皂苷Rg30.5 mg/kg后,血药浓度—时间曲线测定主数据经“3P87”药代动力学程序拟合,结果表明其药代动力学模型均为一室模型。其药代动力学参数为:T1/2(ke)为0.455 h,T(peak)为0.779 h,C(max)为519.1 ng/mL,AUC为1594.2 h·ng/mL;犬静注20(S)-人参皂苷Rg30.5 mg/kg后,血药浓度—时间曲线测定主数据经“3P87”药代动力学程序拟合,结果表明其药代动力学模型均为一室模型。其药代动力学参数为:T1/2(ke)为 1.557 h,V(c)为 0.00136 L/kg,CL为0.000607 L/(kg·h),AUC为1648.1 h·ng/mL。犬肌注20(S)-人参皂苷 Rg3的生物利用度为96.7%。证明20(S)-人参皂苷Rg3肌内注射的生物利用度较高,肌内注射是合适的给药途径。
4 结论
本文通过对西洋参茎叶进行提取分离,得到10个化合物。鉴定分别为:拟人参皂苷RT4(1)、拟人参皂苷RT5(2)、24(R)-Ocotillol苷元(3)、20(S)-人参皂苷Rh1(4)、20(S)-人参皂苷Rg1(5)、20(S)-人参皂苷Rg2(6)、20(S)-人参皂苷Rh2(7)、20(R)-人参皂苷Rh2(8)、20(S)-人参皂苷Rg3(9)、拟人参皂苷F11(10)。化合物1和3为首次从西洋参茎叶中分离得到。
首次建立和认证了20(S)-人参皂苷Rg3肌内注射的生物利用度的测定方法。首次利用犬的肌内注射和静脉注射的模型,研究了20(S)-人参皂苷Rg3肌内注射的生物利用度。证明20(S)-人参皂苷Rg3肌内注射的生物利用度较高,肌内注射是合适的给药途径。为开发20(S)-人参皂苷Rg3肌内注射剂提供了科学依据。
1 Bao JC(鲍建材).Studieds on ginseng saponins constituents of Panax quinquefolium L..Ginseng Res(人参研究),2004,(1):7-9.
2 Mochizuki M,Yoo YC,Matsuzawa-K,et al.Inhibitory effect of tumor metastasis in mice by saponis,ginsenoside-Rb2,20 (R)and 20(S)-ginsenoside-Rg3,ofredginseng.Biol Pharm Bull,1995,18:1197-1202.
3Xu TM(许天敏),Cui MH(崔满华),Gu LP(谷丽萍),et al.Inhibitory effects of 20(S)-ginsenoside-Rg3on ovarian cancer growth.Chin J Pract Obstet Gynecol(中国实用妇科与产科杂志),2007,23:108-110.
4 Chen D(陈迪),Cui JS(崔俊生),Liu XX(刘学峡),et al.Study on Hela cell apoptosis induced by 20(S)-ginsendoside Rg3in cervical cancer.Chin J Lab Diagn(中国实验诊断学),2008,12:463-466.
5 Zhao WJ(赵文杰),Chen D(陈迪),Ni JS(倪劲松),et al.Study on PC-3M cell apoptosis induced by 20(S)-ginsendoside Rg3in prostate carcincma.Chin Pharm Bull(中国药理学通报),2009,25:235-238.
6 Li PY(李平亚),Zhao WJ(赵文杰),Wu JX(吴家祥),et al.Semi-synthetic methods and drug use of 20(S)-ginsenoside-Rg3(20(S)-人参皂苷Rg3的半合成方法及其药物用途).CN98103433.0,2002-10-9.
7 Liu JH(刘继华).Studies on Pharmacokinetics of 20(S)-ginsenoside Rg3.Changchun:Jinlin University(吉林大学),PhD.2003.
8 Zheng XY(郑筱萸).The Guiding Principles of Chemical Pharmacokinetic Study(化学药品临床前药代动力学研究指导原则).Beijing:China Medical Science and Technology Press,2002.
9 Lu J(鲁静),Tang J(汤俊).Application of HPLC/ELSD on quantitative determination of Pseudoginsenoside F11 in Radix Panacis quinquefolii.Chin J Pharm Anal(药物分析杂志),1999,19:241-243.
10 Zou K,Zhu S,Tohda C,et al.Dammarane-type triterpene saponins from Panax japonicus.J Nat Prod,2002,65:346-351.
11 Dou DQ(窦德强).Ocotillone ginsenoside from Leaves of Panax ginseng.J Chin Pharm Sci(中国药学),2002,11: 119-121.
12 Liu CD(刘昌达).Research on the chemical constituents of flower buds of Panax quiquefolium L..Shenyang:Shenyang Pharmaceutical University(沈阳药科大学),PhD.2008.
13 Wang BX(王本祥).Studieds on ginseng(人参的研究) .Tianjin:Science and Technology Press,1985.
14 Liu JP(刘金平).Studieds on isolation,structure modification and pharmacological activities of saponins from the leavesand stems ofPanax quiquefolium L.cultivated in China.Shenyang:Shenyang Pharmaceutical University(沈阳药科大学),PhD.2003.
Chemical Constituents and Bioavailability of Saponins from the Leaves and Stems of Panax quinquefolium L.
QIU Nan-nan1,LIU Jin-ping1,AI Min2,LI Ping-ya1*1Institute of Frontier Medical Science of Jilin University,Changchun 130021,China;2Chang Chun University,Changchun 130022,China
Ten compounds were isolated from saponins from the leaves and stems of Panax quinquefolium L.by various column ehromatographic techniques.They were elucidated on the basis of physicochemical property and spectral data (TLC,1H and13C NMR).They were determined as psuedo-ginsenoside-RT4(1),psuedo-ginsenoside-RT5(2),24(R)-Ocotillol(3),20(S)-ginsenoside-Rh1(4),20(S)-ginsenoside-Rg1(5),20(S)-ginsenoside-Rg2(6),20(S)-ginsenoside-Rh2(7),20(R)-ginsenoside-Rh2(8),20(S)-ginsenoside-Rg3(9)and psuedo-ginsenoside-PF11(10).Compounds 1 and 3 were extracted and separated from the leaves and stems of Panax quinquefolium L.for the first time.The bioavailability of intramuscular 20(S)-ginsenoside-Rg3in dogs were determined and certificated for the first time.In this way,the bioavailability of intramuscular 20(S)-ginsenoside-Rg3in dogs was determined,which was 96.7%.The results provided the preclinical pharmacokinetics basis for the research and development of 20(S)-ginsenoside-Rg3injection.
Panax quinquefolium saponins from leaves and stems;isolation;20(S)-ginsenoside-Rg3;intramuscular injection;bioavailability
1001-6880(2012)10-1393-06
2011-11-11 接受日期:2012-03-08
*通讯作者 Tel:86-431-85619803;E-mail:lipy@jlu.edu.cn
R284.1;Q946
A
