滇牡丹内生真菌PR20的鉴定及次生代谢产物的研究
2012-11-24苗翠苹翟英哲玄其存陈有为吴少华
苗翠苹,胡 娟,翟英哲,宋 飞,玄其存,陈有为,吴少华
云南大学云南省微生物研究所西南微生物多样性教育部重点实验室,昆明650091
滇牡丹内生真菌PR20的鉴定及次生代谢产物的研究
苗翠苹,胡 娟,翟英哲,宋 飞,玄其存,陈有为,吴少华*
云南大学云南省微生物研究所西南微生物多样性教育部重点实验室,昆明650091
根据形态学特征和18S rDNA序列分析,将滇牡丹根中分离得到的内生真菌菌株PR20鉴定为高大毛壳Chaetomium elatum。利用柱色谱层析方法从该菌株的发酵产物中分离到5个化合物,通过理化性质及波谱数据分析,分别鉴定为7-羟基-4,6二甲基苯酞(1)、苔黑酚(2)、苔色酸(3)、间羟基苯甲酸(4)和次黄嘌呤核苷(5),以上化合物均为首次从滇牡丹内生真菌中分离获得。
滇牡丹;高大毛壳;7-羟基-4,6二甲基苯酞;苔黑酚;苔色酸
植物内生真菌在植物组织中普遍存在,并具有丰富的物种多样性。一方面,它们是一类相对未开发的新资源,很有可能是新物种和新基因的丰富资源,而新基因和新物种通常又意味着产生新的天然产物[1]。另一方面,内生真菌与宿主植物之间存在着非常复杂的关系,能产生与宿主植物相同或相似的具有生理活性的次生代谢产物[2]。近年来,学者们对药用植物内生真菌的研究非常活跃,国内外的相关报道越来越多。
我们曾报道了云南省嵩明县滇牡丹植物内生真菌的分离、形态鉴定以及抗菌活性的筛选[3]。本文对具有抗菌活性的内生真菌菌株PR20进行了鉴定及其次生代谢产物的研究,通过形态学特征并结合18S rDNA序列分析,确定该菌株为毛壳菌属的高大毛壳Chaetomium elatum,利用柱色谱层析方法从该菌株的发酵产物中分离获得了5个化合物,根据理化性质及波谱数据分析,分别鉴定为7-羟基-4,6二甲基苯酞(1)、苔黑酚(2)、苔色酸(3)、间羟基苯甲酸(4)和次黄嘌呤核苷(5)。
1 材料
1.1 菌株来源
菌株PR20于2007年9月从滇牡丹的根中分离得到,现保存于云南大学云南省微生物研究所。
1.2 培养基
马铃薯葡萄糖培养基(PDA):去皮马铃薯200 g煮沸30 min过滤,葡萄糖20 g,琼脂12 g,加水定容至1000 mL,pH自然。查氏培养基:蔗糖30 g,硝酸钠3 g,硫酸镁0.5 g,氯化钾0.5 g,硫酸亚铁0.01 g,磷酸氢二钾1 g,琼脂12 g,水1000 mL。PDB培养基:去皮马铃薯200 g煮沸30 min过滤,葡萄糖20 g,加水定容至1000 mL,pH自然。
2 方法
2.1 菌株PR20的形态学特征
菌落形态特征:采用点植培养法,从斜面上蘸取极少量孢子以三点式接种于PDA培养基上,置于28℃恒温箱中培养5~7 d后,观察菌落的大小、表面纹饰、质地、边缘、菌落颜色等。
显微形态特征:采用插片培养法,将无菌的盖玻片以30~45°斜插入PDA培养基中,然后接种培养数天,插片盖在滴有蒸馏水的载玻片上于光学显微镜观察其孢子形态、产孢结构等特征。
2.2 18SrDNA序列分析
采用CTAB法[4]提取基因组DNA。用18S rDNA序列通用扩增引物 5'-GTAGTCATATGCTTGTCTC-3'和5'-TCCGCAGGTTCACCTACGGA-3'对菌株18S rDNA进行扩增。PCR反应体系如下:10× PCR Buffer+5 μL、100 μM each dNTP Mix 4 μL、0.25 μM正反向引物各1 μL、DNA模板1 μL、TaqDNA聚合酶0.3 U,用ddH2O补足至50 μL。反应程序为: 94℃预变性4 min,94℃变性1 min、56℃退火1 min和72℃延伸1 min,共30个循环。PCR扩增产物用1%琼脂糖凝胶电泳分离和纯化后,由上海生工测序部完成测序工作。将获得的18S rDNA序列数据经人工检验核定后,提交到GenBank中,利用NCBI数据库中Blastn(http://www.ncbi.nlm.nih.gov/BLAST/)对其进行相似序列检索,利用Clustal X软件[5]对获得的相似序列进行多序列比对以及相似性分析,采用邻接法用MEGA4.0软件[6]进行系统发育树的构建。
2.3 代谢产物的分离纯化
从PDA斜面培养基上挑取菌丝接种于装有50 mL PDB培养基的三角瓶中,28℃、200 r/min恒温振荡培养24 h后制成种子液,按2%的接种量将种子液接种至装有140 mL发酵培养液的500 mL锥形瓶中,28℃、200 rpm恒温振荡培养7 d后,经过滤,分别收集菌体和发酵液,共发酵10 L。发酵液在45℃下减压浓缩至2 L,用等体积乙酸乙酯萃取6次,萃取液减压浓缩干燥后得提取物约6 g,菌丝体用甲醇浸泡超声提取4次,收集滤液,浓缩蒸干得到菌体提取物约15 g,经过TLC检测比较,将发酵液萃取物和菌体提取物合并后经硅胶柱层析,用氯仿-甲醇(10∶0~6∶4)梯度洗脱,得到10个组分(Fr.1~Fr.10)。Fr.2经硅胶柱层析(石油醚-丙酮6∶1)和Sephadex LH-20凝胶柱层析(甲醇)分离得到化合物1(10 mg);Fr.3经硅胶柱层析(石油醚-乙酸乙酯8∶2)和Sephadex LH-20凝胶柱层析(甲醇)分离得到化合物2(25 mg);Fr.4经硅胶柱层析(石油醚-乙酸乙酯7∶3)和反向RP-18柱层析(甲醇-水8∶2)分离得到化合物3(44 mg);Fr.5经硅胶柱层析(氯仿-甲醇95∶5)和Sephadex LH-20凝胶柱层析(甲醇)分离得到化合物4(4 mg);Fr.7经硅胶柱层析(氯仿-甲醇5∶1)分离得到化合物5(7 mg)。
3 结果
3.1 菌株PR20形态学特征
菌株PR20在PDA培养基上菌落生长较快,28℃培养7 d后,菌落直径约7 cm,灰白色,生长极为松散,四周菌丝匍匐状,边缘整齐。子囊壳表生,从菌落中心开始产生,子囊壳浅色成熟后变为橄榄绿色。在查氏培养基上菌落生长较慢,28℃培养10 d后,菌落直径约7 cm,中间突起,菌落灰白色,边缘整齐,子囊壳产生较慢。在光学显微镜下,菌株PR20菌丝交织,透明有隔。子囊壳球形,子囊壳壁膜质,呈不透明暗黑色,易破裂,表面着生两种附属丝,顶生附属丝下部直,顶部螺旋状卷曲,褐色,侧生附属丝直,渐细,褐色。子囊孢子褐色,椭圆形,柠檬形,壁厚,两侧平滑,两端突起。产生厚垣孢子,在菌丝上间生或顶生。从形态上来看PR20属于毛壳菌属。
3.2 基于18S rDNA序列的系统发育分析
经PCR扩增后获得的菌株PR20的18S rDNA序列长1709 bp,该序列与高大毛壳(序列号为M83257)在同一分支上,同源性为100%。
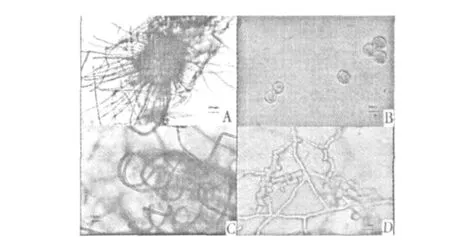
图1 菌株PR20的显微形态特征Fig.1 The morphological features of strain PR20

图2 基于18S rDNA序列构建的菌株PR20与相关种之间的系统发育树Fig.2 Phylogenetic tree based on the 18S rDNA sequences of strain PR20 and related strains downloaded from Gen-Bank
综合菌株PR20形态学特征和18S rDNA序列分析结果,本研究将菌株PR20鉴定为高大毛壳(Chaetomium elatum)。
3.3 化合物的结构鉴定
化合物1 无色针晶 (MeOH)。1H NMR (CDCl3,500 MHz)δ:7.65(1H,s,7-OH),7.17 (1H,s,H-5),5.18(2H,s,H-3),2.24(3H,s,6-Me),2.19(3H,s,4-Me);13C NMR(CDCl3,125 MHz)δ:173.6(s,C-1),152.9(s,C-7),142.6(s,C-4a),139.2(d,C-5),125.2(s,C-6),122.8(s,C-4),110.3(s,C-7a),70.2(t,C-3),16.9(q,6-Me),14.8(q,4-Me)。以上数据参照文献[7]确定该化合物为7-羟基-4,6二甲基苯酞(7-hydroxy-4,6-dimethyl-phthalide)。
化合物2 无色针晶(MeOH)。1H NMR (CD3OD,500 MHz)δ:6.13(2H,s,H-2,6),6.05 (1H,s,H-4),2.16(1H,s,H-7);13C NMR(CD3OD,125 MHz)δ:159.7(s,C-3),159.7(s,C-5),140.7 (s,C-1),109.0(d,C-2),109.0(d,C-6),101.2(d,C-4),20.2(q,C-7)。以上波谱数据与文献[8]报道一致,确定其结构为苔黑酚(orcinol)。
化合物3 无色针晶(MeOH)。1H NMR (CD3OD,500 MHz)δ:6.18(1H,s,H-5),6.13 (1H,s,H-3),2.47(3H,s,H-8);13C NMR(CD3OD,125 MHz)δ:175.4(s,C-7),167.3(s,C-4),164.1 (s,C-2),145.7(s,C-6),112.7(d,C-5),106.0(s,C-1),101.9(d,C-3),24.6(q,C-8)。以上波谱数据与文献[8]报道基本一致,确定其结构为苔色酸(orsellinic acid)。
化合物 4 无色晶体 (CHCl3)。1H NMR (CD3OD,500 MHz)δ:7.50(1H,d,J=7.1 Hz,H-6),7.45(1H,s,H-2),7.27(1H,t,J=7.1 Hz,H-5),7.01(1H,d,J=7.6 Hz,H-4);13C NMR (CD3OD,125 MHz)δ:170.5(s,C-7),159.0(s,C-1),133.5(s,C-3),130.9(d,C-5),122.4(d,C-4),121.5(d,C-6),117.7(d,C-2)。以上波谱数据与文献[9]报道基本一致,确定其结构为间羟基苯甲酸(m-hydroxybenzoicacid)。
化合物5 白色粉末。1H NMR(DMSO-d6,500 MHz)δ:12.37(1H,s,6-OH),8.34(1H,s,H-2),8.07(1H,s,H-8),5.88(1H,d,J=5.5 Hz,H-1'),5.47(1H,s,2'-OH),5.19(1H,s,3'-OH),5.07(1H,s,5'-OH),4.49(1H,s,H-2'),4.14 (1H,s,H-3'),3.95(1H,s,H-4'),3.67(1H,d,J= 11.4 Hz,H-5'a),3.50(1H,d,J=11.3 Hz,H-5' b);13C NMR(DMSO-d6,125 MHz)δ:156.9(s,C-6),148.5(s,C-4),146.2(d,C-8),139.0(d,C-2),124.8(s,C-5),87.9(d,C-1'),86.0(d,C-4'),74.5(d,C-2'),70.7(d,C-3'),61.7(t,C-5')。以上波谱数据与文献[10]报道基本一致,确定其结构为次黄嘌呤核苷(inosine)。
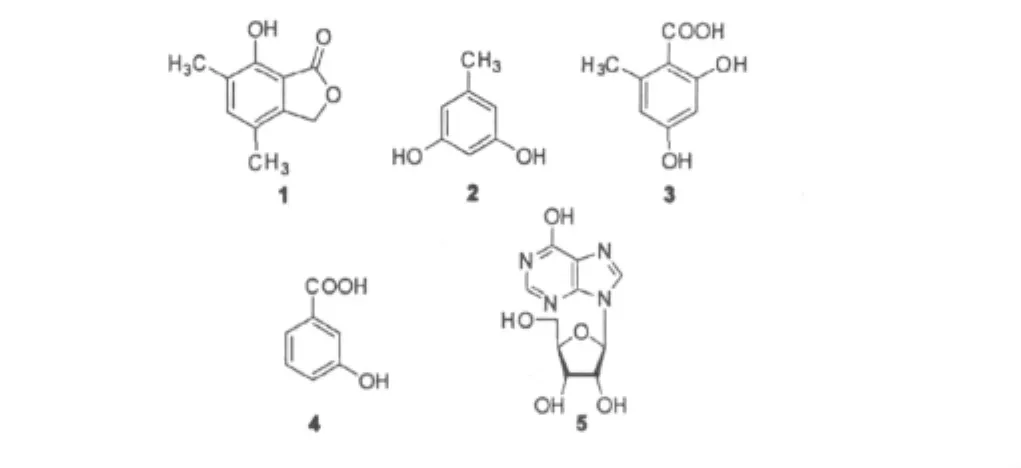
图3 化合物1~5的结构Fig.3 Structures of compounds 1-5
4 讨论
本文根据菌株的形态特征和18S rDNA序列分析,将分离自滇牡丹植物的内生真菌菌株PR20鉴定为高大毛壳(Chaetomium elatum)。从该菌株的发酵产物中分离获得了5个化合物,均为首次从滇牡丹内生真菌中分离获得。7-羟基-4,6二甲基苯酞最早分离自唐菖蒲青霉(Penicillium gladioli)[11]。苔黑酚和苔色酸广泛存在于地衣中,也曾经从烟曲霉(Aspergillus fumigatus)[12]和粉红粘帚霉(Gliocladium roseum)[13]的发酵产物中获得过,我们曾报道过从一株附球菌属(Epicoccum sp.)印楝内生真菌的代谢产物中分离到这两个化合物[7],表明该类苯酚衍生物较广泛地存在于不同种类的丝状真菌中。上述3个化合物均为首次从毛壳菌属真菌中分离得到。
1 Sun JQ(孙剑秋),Guo LD(郭良栋),Zang W(臧伟),et al.Recent research advance in endophytic fungi of medicinal plant and diversity of active substance.Acta Bot Boreal Occident Sin(西北植物学报),2006,26:1505-1519.
2 Li X(李想),Yao YH(姚燕华),Sun GZ(孙光芝),et al.Chemical constituents from marine-derived fungus of Penicillium sp.Nat Prod Res Dev(天然产物研究与开发),2007,19:804-806.
3Miao CP(苗翠苹),Yu Y(余莹),Chen YW(陈有为),et al.Study on isolation of endophytic fungi from Paeonia delavayi and their antimicrobial activity.Chin Pharm J(中国药学杂志),2011,46:738-741.
4 Guo LD,Hyde KD,Liew EY.Detection and taxonomic placement of endophytic fungi within frond tissues of Livistona chinensis based on rDNA sequences.Mol Phylogenet Evol,2001,20:1-13.
5 Thompson JD,Gibson TJ,Plewniak F,et al.The CLUSTAL X windows interface:flexible strategies for multiple sequence alignment aided by quality analysis tools.Nucleic Acids Res,1997,25:4876-4882.
6 Tamura K,Dudley J,Nei M,et al.MEGA4:Molecular evolutionary genetics analysis(MEGA)software version 4.0.Mol Biol Evol,2007,24:1596-1599.
7 Duncanson LA,Grove JF,Zealley J.Infra-red spectroscopy and structural chemistry.Part V.Hydroxyphthalides.J Chem Soc,1953,1331-1333.
8Wang LD(王立东),Wu SH(吴少华),Chen YW(陈有为),et al.Studies on the secondary metabolites of endophytic fungus Epicoccum sp.isolated from Azadirachta indica.Nat Prod Res Dev(天然产物研究与开发),2009,21:916-918.
9 Wen J(温晶),Shi HM(史海明),Zan K(昝珂),et al.Study on chemical constituents of Herba Artemisiae Anomalae.Chin Tradit Herb Drugs(中草药),2010,41:870-873.
10 Chang Q(常琪),Chen DH(陈迪华),Si JY(斯建勇),et al.Study on chemical constituents of Acanthopanax giraldii Harms var.hispidus Hoo.China J Chin Mater Med(中国中药杂志),1993,18:162-164.
11 Raistrick H,Ross DJ.Dihydrogladiolic acid,a metabolic product of Penicillium gladioli machacek.Biochem J,1952,50:635-647.
12 Packter NM.Studies on the biosynthesis of phenols in fungi.Conversion of[14C]orsellinic acid and[14C]orcinol into fumigatol by Aspergillus fumigatus I.M.I.89353.Biochem J,1966,98:353-359.
13 Packter NM,Steward MW.Studies on the biosynthesis of phenols in fungi.Biosynthesis of 3,4-dimethoxy-6-methyltoluquinol and gliorosein in Gliocladium roseum I.M.I.93065.Biochem J,1967,102:122-132.
Identification and Secondary Metabolites of Endophytic Fungus PR20 from Paeonia delavayi
MIAO Cui-ping,HU Juan,ZHAI Ying-zhe,SONG Fei,XUAN Qi-cun,CHEN You-wei,WU Shao-hua*
Key Laboratory of Microbial Diversity in Southwest China,Yunnan Institute of Microbiology,Yunnan University,Ministry of Education,Kunming 650091,China
The fungal strain PR20 isolated from the root of Paeonia delavayi was identified as Chaetomium elatum based on morphological features and 18S rDNA sequence analysis.Five compounds were obtained from the fermentation broth of the strain,and their structures were identified as 7-hydroxy-4,6-dimethyl-phthalide(1),orcinol(2),orsellinic acid (3),m-hydroxybenzoic acid(4)and inosine(5),by means of their physic-chemical properties and spectroscopic methods.All compounds were reported from the endophytic fungus of P.delavayi for the first time.
Paeonia delavayi;Chaetomium elatum;7-hydroxy-4,6-dimethyl-phthalide;orcinol;orsellinic acid
1001-6880(2012)10-1339-04
2011-12-23 接受日期:2012-03-14
国家自然科学基金(20772105,21062027,20502021);云南省应用基础研究基金(2010CD009);云南省中青年学术技术带头人后备人才基金(2008PY028);云南省教育厅科学研究基金(2010Z054);云南大学校基金(2010YB001)
*通讯作者 Tel:86-871-5032423;E-mail:shwu123@126.com
R284.2
A
