宫颈电环切术治疗宫颈病变的疗效观察和随访
2012-11-24邓继红马丽莎李文莉
谭 露,邓继红,马丽莎,李文莉
(昆明市妇幼保健院,云南 昆明 650031)
宫颈癌是妇科恶性肿瘤患者死亡的主要原因之一,且年轻患者有明显上升趋势。近年来宫颈癌防治研究取得了显著进展,明确了高危型人乳头状瘤病毒(HPV)感染是宫颈癌和宫颈上皮内瘤变发生的必要条件[1],近20年来,由于薄层液基细胞学及高危型人乳头瘤病毒检测等先进技术的引进,使宫颈上皮内瘤病变的检出率有很大提高,早期干预宫颈上皮内瘤变可有效预防宫颈癌,所以子宫颈LEEP术作为治疗子宫颈病变也被广泛用于临床,但如何有效判断宫颈上皮内瘤变行宫颈电环切除术治疗后的效果。本文对我院507例CIN患者经LEEP术后进行1年随访。术后HPV感染,病灶持续存在或复发等情况进行分析总结,探讨LEEP术治疗的效果及高危型HPV病毒感染状况与疾病预后的关系。
资料与方法 1.研究对象 1995年1月~2011年6月昆明市妇幼保健医院宫颈疾病门诊就诊患者,严格按宫颈疾病三阶梯的筛查方案明确诊断为CIN的507例患者为治疗对象,宫颈标本病理诊断参照《妇产科学》第7版提出的标准,所有病理切片均由资深病理学专家复核。507例CIN患者,年龄22~59岁。平均33.5岁。其中CIN I级236例,CINII级164例,CINⅢ级 107例。CIN I组定义为低度宫颈上皮内瘤样病变组。CINⅡ组和CINⅢ组定义为高度宫颈上皮内瘤样病变组。所有患者经LEEP治疗,电切功率调到40~50W,电凝功率设为30W,术前用2%碘化钾液标志出病变范围,CIN I(阴道镜检查满意)切除范围达到移行带边界,深度为8~10mm,CIN I阴道镜检查不满意切除范围达到移行带边界。深度为15mm:CIN 11或CINⅢ(阴道镜检查满意或不满意)切除范围达到移行带边界外侧3~5mm,深度为20~25mm。术后随访1年。
2.高危型HPV检测采用宫颈脱落细胞取样器,插入宫颈管刷取细胞,置于标本保存液。高危型HPV-DNA检测采用美国Digene公司第二代杂交捕获HC-Ⅱ的方法,HC-Ⅱ试剂盒购自美国Digene公司。共检测13个高危HPV基因型。包括HPVl6,18,31,33,35,39,45,51,52,58,59 和 68。以每份标本的检测值相对发光单位(RLU)与专用试剂盒中HPV.DNA阳性对照临界值(CO)的比值(RLU/CO)表示宫颈组织细胞HPV-DNA的负荷量,RLU/CO>1为阳性。检验操作流程严格参照试剂盒说明。
3. 随访患者LEEP术后6个月第1次复查HPV病毒,术后12个月第2次复查HPV病毒。对于结果异常的患者行阴道镜检查及宫颈活检。治疗后半年内发现CIN病变存在定义为病变持续存在,治疗1年后发现CIN病变存在定义为复发。共有8例CIN I患者6个月后检测高危型HPV阴性。
4.统计学处理用SPSS 13.0软件包对数据进行统计分析,计数资料比较采用x:检验。P<0.05为差异有统计学意义。
结 果 1.切除组织病理结果 病变程度与LEEP术后组织病理结果的比较,见表1。26例CINⅠ患者LEEP术后升级为CINⅡ,诊断符合率55.08%(130/236)。23例CINⅡ患者术后升级为CINⅢ,8例CINⅢ患者术后发现为浸润癌。高度病变(CINⅡ,CINⅢ)的诊断符合率84.13%(228/271)。
2.术后并发症 术后2例患者有晕厥,出汗,心率减慢等迷走神经刺激反应,行吸氧,平卧1h后好转。术后出血通常发生在4~6d,占69.03%(350/507),血性分泌物持续1~3周。其中8例出血偏多,6例给予纱布压迫止血后好转,2例压迫止血无效,予电灼止血。两月后复查伤口有12例颈管肉芽增生,行电切肉芽,1月后再次复查宫颈均恢复正常。所有患者均未发现宫颈管粘连。
3.术前CIN患者HPV感染情况 各组高危型HPV的阳性率随宫颈病变程度升高而上升,术前病理为CINⅠ,CINⅡ和CINⅢ的3组患者,其高危型HPV感染率分别为32.63%、90.85%和98.13%,前组(低度宫颈上皮内瘤样病变组)与后2组(高度宫颈上皮内瘤样病变组)高危型HPV感染率差异均有统计学意义(P<0.001),见表2。
4.术后随访情况 507例患者中,除8例侵润癌患者外,共499例患者接受了随访,随访时间6月~1年。术后6个月治愈率为94.38%(471/499),有28例病变持续存在,CIN I组术后病变持续存在率低于CIN lI组,CINⅢ组(P<0.001),1年后23例复发病例皆为高度宫颈上皮内瘤样病变组患者,CIN I组术后无复发患者,两者差异有显著性(P<0.001)。高度宫颈上皮内瘤样病变组LEEP术后病变持续存在率、复发率高于低度宫颈上皮内瘤样病变组(P<0.001)。不同程度宫颈上皮内瘤样病变经LEEP术治疗后随访1年高危型HPV感染率皆出现明显下降(P<0.001),但术后6个月和1年高度宫颈上皮内瘤样病变两组LEEP术后高危型HPV感染率皆高于低度宫颈上皮内瘤样病变(P<0.001)。其中4例CIN I病变持续存在者3例高危型HPV持续阳性。24例高度宫颈上皮内瘤样病变持续存在者皆为高危型HPV持续阳性。23例复发病例其高危型HPV检测皆为持续阳性,CIN I、CINⅡ术后病变持续存在患者和复发患者皆行2次LEEP术。CINⅢ术后病变持续存在患者和复发患者20例行冷刀锥切术,4例行全子宫切除术。再次手术治疗正在继续随访中。见表3。

表1 宫颈病变程度与LEEP术后病理结果比较

表2 不同程度宫颈上皮内瘤样病变患者高危型HPV感染率
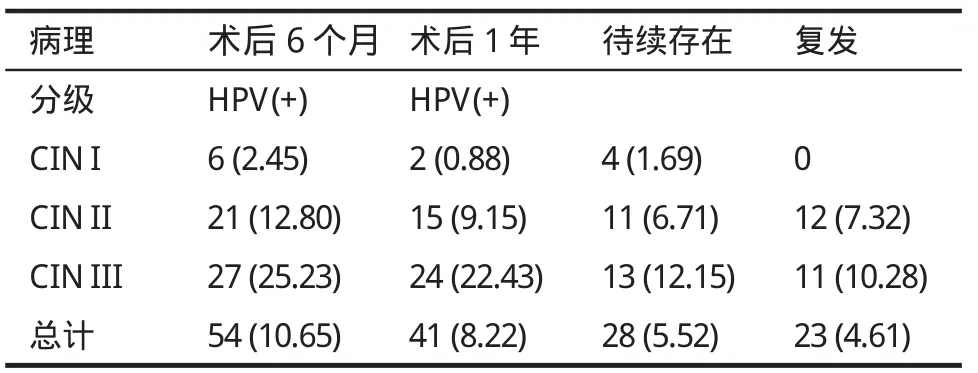
表3 宫颈上皮内瘤样病变患者LEEP后高危HPV感染率和预后例(%)
讨 论 1.LEEP治疗CIN的有效性 90年代以来LEEP被广泛应用于CIN治疗中,尤其是高度CIN的治疗。LEEP在操作过程中主要通过干燥脱水效应、电弧切割效应、喷射凝结效应发挥作用。它操着简单,并发症少,同时能达到诊断和治疗两个目的,且较冷刀锥切而言,切除的正常宫颈组织更少[2]。文献报道其治愈率在92.3%~97.7%[3,4]。本研究随访了499例患者,治愈率为94.38%。,与文献报道相仿,未出现严重并发症,证实了LEEP是一种非常安全有效的治疗CIN手段。
2.CIN I的治疗策略 有研究表明,大部分CIN1即使不治疗,多在较短时间逆转为正常[5]。2001年制定的CIN指南[6]中明确指出,鉴于绝大多数CIN I患者在不治疗的情况下可以自然逆转,推荐的处理方案就是随访观察,在6个月和12月时行宫颈细胞学检查,或者在12个月后进行HPV检测。但本研究发现,阴道镜多点活检诊断为CIN1者,并不能完全排除高度CIN的的存在。本研究对236例CIN I患者进行LEEP治疗,在切除的标本中发现了26例CINⅡ,占11.01%(26/236),与国外报道[7]发现11%CIN I患者可进展为高度病变,1%甚至进展为浸润癌相似。所以认为对CIN I患者,尤其是阴道不满意的CIN I患者,结合年龄、婚育情况、随诊条件等因素,可采取LEEP治疗方案,达到治疗的个体化。
3.高度病变(CINⅡCINⅢ)的治疗策略 高度病变是癌前病变,其进展率较高,当病理组织学证实后应进行积极处理。在CIN治疗指南中[6],HSIL的推荐治疗方案,可行局部切除治疗。包括子宫颈椎形切除或子宫颈电环切术(LEEP),然而,研究发现高度CIN在LEEP治疗后病灶残留及复发率可以高达10%以上,特别是LEEP治疗原位癌,复发率要高于冷刀椎切。故对于CINⅢ不能排除原位癌、高度怀疑原位癌或已诊断为原位癌,以及病灶累及颈管较深,病灶面积较大的CINⅢ者,行冷刀椎切是明智的选择。CIN治疗后均有病变持续存在、复发、进展为宫颈癌的风险,所以CIN治疗后的长期随访是必要的,尤其是高度病变者。
4.LEEP术后的随访 近年来宫颈癌防治的流行病学研究已证明宫颈癌及宫颈上皮内瘤变的主要病因是感染高危型HPV[8]。积极干预高危型HPV感染状况可有效防止宫颈癌的发生。本研究通过对507例宫颈上皮内瘤变LEEP术后高危型HPV检测和病理分析发现。高危型HPV感染率的升高与CIN级别的升高密切相关。本研究观察到术前CIN I组,CINⅡ组,CINⅢ组高危型HPV阳性率分别为32.63%,90.85%,98.13%,LEEP术后6月高危型HPV阳性率分别为2.54%,12.80%,25.23%。说明LEEP术能有效清除HPV(P<0.001)。不同程度宫颈上皮内瘤变组经LEEP术后病变持续存在率5.52%。病变复发率4.61%。说明LEEP术能有效治疗宫颈上皮内瘤变,本研究数据显示,术后6个月和1年高度宫颈上皮内瘤样病变两组LEEP术后高危型HPV感染率皆高于低度宫颈上皮内瘤样病变组(P<0.001)。相应的LEEP术后宫颈病变持续存在或复发率高度宫颈上皮内瘤样病变两组也皆高于低度官颈上皮内瘤样病变组(P<0.001)。说明LEEP术后宫颈病变持续存在或复发与HPV的持续感染密切有关。而且发现病变持续存在和复发患者的高危型HPV皆阳性,因为大部分高危型HPV感染是暂时性的。只有持续或反复的高危型HPV感染才使机体的免疫力下降。导致宫颈癌的危险性大大增加[9]。此结果提示术后检测高危型HPV能预测宫颈上皮内瘤变的预后。高危型HPV持续阳性能提示宫颈高度病变的持续存在或复发。所以高危型HPV检测已被证实了其在CIN患者LEEP术后随访中的价值[10],但目前对高危型HPV持续阳性的患者尚无明确有效的治疗方案,所以对该类患者应注意延长随访的时间。
[1] MUNOZN,BOSCH F X,SANJOSE S,et a1.Epidemiologic classification of human papilloma virus types associated with cervical cancer[J].N Engl J Med,2003,348(6):518-527.
[2] CHAEM-MAGHAMI S,Sagi S,MAJEEDC,etal.Incomplete excision ofcervical intraepithelialneoplasia and risk of treatment failure:a meta anaysis[J].Lancet Oncol,2007,8(11):985-993.
[3] SANKARANARAYANAN R,KESHKAR V,KOTHARiI A,etal.Effectiveness and safety of loop electrosurgicalexcision procedure for cervicalneoplasia in rural India[J].Int JGynaecolObster,2009,104(2):95-99.
[4] 李铁梅,李劲,吴晓玲.LEEP治疗宫颈上皮内瘤变133例疗效及其预后影响因素分析[J].现代妇产科进展,2008,17(4):298-299.
[5] PRETAT JL,JACQUARD AC,SAUNIER M,et al.Human papillomavirus genotype distribution in low-grade squamous intraepithelial lesions in France and comparison with CIN2/3 and invasive cervical cancer:the EDITHⅢstudy[J].Gynecol Oncol,2008,110(2):179-184.
[6] WRIGHT TC JR,MASSAD LS,DUNTON CJ,etal.2006 consensus guidelines for the management of women with cervical intraepighelial neoplasia or adenocarcinoma in situ[J].Am JObstetGynecol,2007,197(4):337-339.
[7] OSTORAG.Natural history of cervical intraepithelial neoplasia:a critical review[J].Ine J Gynecol pathol,1993,12(2):186-192.
[8] 丁素玲,高魁文.人乳头状瘤病毒感染与宫颈癌的研究进展[J].中国自然医学杂志,2008,10(2):147-148.
[9] 张学东.人乳头瘤病毒与子宫颈癌的研究进展[J].国外医学:妇产科学分册.2006.33(2):113-116.
[10] BRANCAM,CIOTTIM,GIORGI C,et al.Up-regulation of proliferating cellnuclearantigen(PCNA)is closely associated with high-risk human papillomavirus(HPV)and progression of cervical intraepithelial neoplasia(CIN),but dose not predict disease outcome in cervical cancer[J].Eur J Obstet Gynecol Reprod Biol,2007,130(20):223-231.
