鸭源大肠杆菌和沙门菌混合感染的分离鉴定及药敏试验
2012-11-23胡岚岚
林 安,喻 元,胡岚岚,伍 莉,2
(1.西南大学荣昌校区动物医学系,重庆 荣昌402460;2.重庆市兽药工程技术研究中心,重庆 北碚400715)
近年来,为控制与大肠杆菌和沙门菌感染有关的禽类死亡,某些抗菌药物在临床上进行了广泛使用,这不可避免地导致细菌对药物产生耐药性。为了解和掌握鸭大肠杆菌和沙门菌混合感染的情况以及耐药程度,为临床上有效预防和治疗药物的筛选提供依据,本试验对荣昌县某鸭场发病雏鸭分离的细菌进行了实验室诊断和药敏试验,以期望为更有效地防控该病提供理论依据。
1 材料与方法
1.1 病料来源 采集重庆市荣昌县某鸭场病死雏鸭的肝、脾脏等组织,低温保存送回实验室待检。
1.2 培养基及试剂 普通琼脂培养基、营养肉汤增菌培养基、麦康凯培养基、S.S.培养基、三糖铁培养基、细菌微量生化鉴定管(批号:101226)、药敏纸片(批号:110104)、肠杆菌科细菌生化鉴定编码册(第二代GYZ-15e),均购自杭州天和微生物试剂有限公司。
1.3 试验动物 昆明系健康小鼠16只,购自重庆医科大学实验动物中心,体重18.0~22.0g,雌雄各半;购自荣昌县某孵化场的2日龄健康花边雏鸭40只,雌雄各半,观察2d后用于动物回归试验。
1.4 细菌的分离、纯化 将采集的病料接种于普通琼脂培养基,37℃培养18~24h,选取疑似菌落进行分离菌的抹片,革兰染色,镜检。于菌种管内取菌液在S.S.培养基和麦康凯培养基进行划线,37℃培养18~24h,观察菌落生长特点[4]。
1.5 生化试验 将分离菌株活化后接种到营养琼脂斜面培养基,进行15项生化试验,参照肠杆菌科细菌生化鉴定编码册(第二代GYZ-15e)计算编码值,确定细菌种类。
1.6 致病性试验 16只健康小鼠分成4组,每组4只,1组腹腔注射大肠杆菌菌悬液0.2mL/只(2×1010CFU/mL);2组腹腔注射沙门菌菌悬液0.2mL/只(2×1010CFU/mL);3组同时腹腔注射沙门菌和大肠杆菌菌悬液各0.1mL/只;4组为对照组,腹腔注射灭菌普通肉汤0.2mL/只。对注射后的小鼠隔离饲养,观察其发病及死亡情况[2],并从死亡小鼠的肝、脾组织中回收细菌进行生化试验,判断细菌种类。
1.7 药敏试验 采用WHO推荐的K-B纸片琼脂扩散法进行[3],按临床实验室标准研究所(CLSI)2010年标准判断结果。
1.8 动物回归试验 40只2日龄雏鸭饲养2d后分为4组,每组10只。1组腹腔接种沙门菌菌悬液0.5mL/只(2×1010CFU/mL);2组腹腔接种大肠杆菌菌悬液0.5mL/只(2×1010CFU/mL);3组分别腹腔接种大肠杆菌和沙门菌菌悬液各0.25mL/只;4组为对照组,腹腔注射灭菌普通肉汤0.5mL/只。对注射后的雏鸭隔离饲养,观察其发病及死亡情况,并对死亡雏鸭立即剖检,观察病理学变化。无菌采取死亡雏鸭的肝、脾组织,涂片、染色、镜检,并在麦康凯琼脂上划线分离,37℃培养24h,观察菌落形态、大小。
2 试验结果
2.1 细菌分离、纯化 病料在培养基上分离出A、B两种菌株。普通琼脂上:A菌为圆形、表面光滑湿润、边缘整齐、灰白色半透明、中等大小的菌落;B菌为圆形、表面光滑、边缘整齐、无色半透明、中等大小的菌落。在麦康凯琼脂平板上:A菌形成较大、红色、圆形、边缘整齐、中央隆起的菌落;B菌形成中等、无色透明、边缘整齐、中央隆起的菌落。在S.S.琼脂上:A菌形成圆形、中心混浊的紫红色菌落;B菌形成圆形、透明的无色菌落。把两种细菌进行镜检:A菌为革兰阴性、中等大小、两端略圆的短粗杆菌,呈单个存在、也有成双排列;B菌为革兰阴性、较前者大、直杆菌。镜检后将两种菌分别接种于麦康凯培养基和S.S.培养基中,让其纯化生长,然后将纯化的两种菌分别接种到营养肉汤中作增菌培养,接种A菌的肉汤呈均匀混浊,管底有絮状沉淀,液面有菌环;接种B菌的肉汤呈均匀混浊,管底有絮状沉淀,液面无菌环。
2.2 生化试验 生化试验结果见表1。参照肠杆菌科细菌生化鉴定编码(第二代GYV-15e),结合细菌的生化试验与分离特性,判定A菌为大肠埃希菌(编码值:06174),B菌为猪霍乱沙门菌(编码值:42165)。

表1 生化试验结果(n=3)
2.3 致病性试验 小鼠接种细菌24h后,1组死亡3只,2组死亡2只,3组全部死亡,4组小鼠健康存活,未出现发病或死亡现象。死亡鼠剖检变化典型,并从肝、脾组织中回收细菌,通过麦康凯培养基培养、生化鉴定、镜检等检出的两种细菌和原分离的两种菌株一样,即A菌为大肠埃希菌,B菌为猪霍乱沙门菌。
2.4 药敏试验 试验结果见表2。大肠杆菌对氨苄西林等7种抗菌药物高敏;对阿莫西林中敏;对恩诺沙星等6种药物耐药。沙门菌对庆大霉素等7种药物高敏;对强力霉素中敏;对氧氟沙星等6种药物耐药。经比较发现,对大肠杆菌和沙门菌都高度敏感的药物有头孢唑啉、庆大霉素、链霉素、大观霉素、多黏菌素B等5种抗菌药物,它们可作为该养鸭场防治鸭源大肠杆菌和沙门菌混合感染的首选药物。
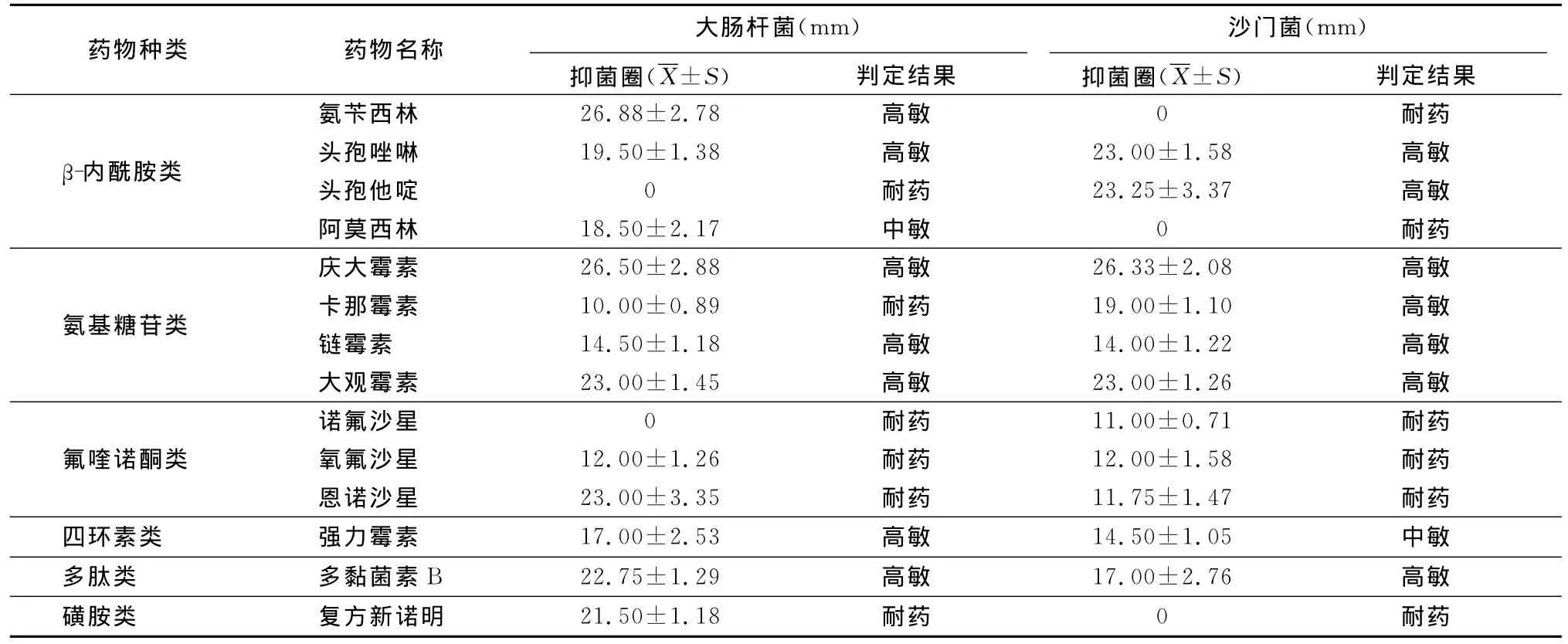
表2 药敏试验结果(n=6)
大肠杆菌对恩诺沙星等6种药物耐药,沙门菌对氧氟沙星等6种药物耐药。两种细菌均对氟喹诺酮类的诺氟沙星、氧氟沙星、恩诺沙星和磺胺类的复方新诺明具有很强的耐药性;多重耐药谱显示,大肠杆菌呈现四重耐药,沙门菌呈现三重耐药。
2.5 动物回归试验 雏鸭感染细菌后24h后开始出现临床症状,甚至死亡。48h后,1组死亡7只,2组死亡8只,3组全部死亡,4组未出现发病或死亡。分别从病死雏鸭的肝、脾组织接种细菌,通过麦康凯培养基培养、生化鉴定、镜检等检出的两种菌和原分离的两种菌株一样,即A菌为大肠埃希菌,B菌为猪霍乱沙门菌。
3 分析与讨论
本试验分离到的鸭源大肠埃希氏菌和猪霍乱沙门菌,均具有较强的致病性。药敏试验结果表明,分离菌对头孢唑啉、庆大霉素、链霉素、大观霉素、多黏菌素B等5种抗菌药物高敏,它们可作为该场防治大肠杆菌和沙门菌混合感染的首选药物。两种细菌均对氟喹诺酮类的诺氟沙星、氧氟沙星、恩诺沙星和磺胺类的复方新诺明具有很强的耐药性,因此,临床上该场要禁用上述耐药性药物。
在应用抗生素治疗细菌感染时,要有明确的临床指征[4]。应根据临床症状、病例剖检,再结合实验室检验结果进行综合诊断,找出病原,合理选择用药,不可在不明病因的情况下盲目用药。临床实践证明,长时间单用一种药物防治某种疾病,不仅治疗效果不佳,而且容易使细菌产生耐药性,而适当的联合使用敏感的抗生素能达到疗效协同或相加,减少毒性,防止或延缓耐药菌株产生的目的。
根据本次试验结果,建议该养鸭场应定期分离雏鸭大肠杆菌和沙门菌的优势菌株,及时对产蛋鸭和雏鸭进行免疫接种;临床用药以药敏试验结果为依据,采用多途径、联合、交叉等合理用药方案,加上科学的饲养管理,搞好环境卫生等多方面的措施,才能收到良好效果。此外,对该类细菌性疾病的防制不能完全依赖药物治疗或预防,应该把重点放在强化生物安全措施、改善饲养管理条件上。经常保持舍内的环境干燥、卫生、温度和湿度适宜,空气清新,喂饲易消化吸收的全价饲料,供给多种维生素,以预防为主,治疗为辅。
[1]陆承平.兽医微生物学[M].3版.北京:中国农业出版社,2001:215-231.
[2]姚火春.兽医微生物学实验指导[M].北京:中国农业出版社,2006:36-42.
[3]桂炳东,孙敬,徐建民.细菌药物敏感性试验测定手册[M].南昌:江西科学技术出版社,2001:28-29.
[4]刘山辉.抗菌药物的药敏试验方法[J].吉林畜牧兽医,2003,24(12):49-50.
