转化生长因子-β1在多柔比星致大鼠心肌细胞凋亡中的促进作用
2012-11-22陈星潘建业周艳芳王好顾琳张国辉
陈星,潘建业,周艳芳,王好,顾琳,张国辉
(江苏大学附属人民医院心内科,江苏镇江212002)
蒽环类药物多柔比星(doxorubicin,DOX)作为化疗药物已广泛应用于肿瘤的治疗,但同时也会引起人体严重的并发症,其中以心脏毒性最具代表性,临床上主要表现为心肌病的慢性发展,最终可导致心力衰竭[1],这一过程被认为是多因素共同作用的结果,主要包括活性氧自由基增多、脂质过氧化、钙超载、细胞凋亡、能量代谢紊乱等[2]。在心衰的发展过程中有多种细胞因子参与调控,转化生长因子-β1(transforming growth factor-β1,TGF-β1)作为多效性细胞因子,能够抑制炎症、促进血管新生,但同时也会引起心肌细胞肥大、凋亡及纤维化等[3]。本研究观察不同浓度多柔比星作用于大鼠心肌细胞不同时间后,心肌细胞的存活率和凋亡率的改变以及TGF-β1表达量的差异,探讨 TGF-β1在多柔比星心脏损伤过程中是否具有促进作用。
1 材料和方法
1.1 动物和主要试剂
新生SD大鼠,1~2日龄,雌雄不限,由江苏大学动物实验中心提供。
盐酸多柔比星购自美国Enzo公司,DMEM-F12培养基购自美国Gibco公司,标准小牛血清购自美国Hyclone公司,胰蛋白酶和Ⅰ型胶原酶购自美国Sigma公司,多聚赖氨酸购自碧云天生物科技公司,α-横纹肌肌动蛋白(α-sarcomericactin,α-SA)、链霉素亲和素-生物素-过氧化物酶复合物(SABC)免疫组化试剂盒、DAB显色试剂盒均购自武汉博士德生物工程有限公司,噻唑蓝(MTT)、AnnexinⅤ/PI双染凋亡试剂盒购自南京凯基生物公司,TGF-β1ELISA试剂盒购自R&D公司。其余生化试剂均为进口分装或国产分析纯。
1.2 方法
1.2.1 原代心肌细胞分离及培养 新生SD大鼠经75%乙醇消毒2次,无菌条件下取出心脏,将其剪成1 mm左右的组织块,用PBS清洗组织块2遍。用0.06%胰酶和0.1%Ⅰ型胶原酶共同消化,收集消化后的上清并用含20%血清的DMEM-F12中和,直到组织块变透明终止消化。将收集的细胞离心、重悬,差速贴壁1.5 h,后将纯化的心肌细胞按所需密度接种于不同的细胞培养板中,置于37℃、5%CO2培养箱培养。24 h后用含10%小牛血清的DMEM-F12更换培养液。
1.2.2 心肌细胞形态学观察及鉴定 倒置显微镜下观察培养1~3 d的心肌细胞形态及搏动情况。取培养3 d的心肌细胞进行α-SA鉴定,α-SA阳性率作为心肌细胞纯度鉴定的指标。400倍镜下随机选取5个视野,每个视野计数20~30个细胞,计算α-SA阳性细胞比例。
1.2.3 MTT法检测心肌细胞存活率 心肌细胞按密度1×105/ml接种于96孔板培养3 d,分别加入终浓度为 0.5,1,2 μmol/L 的多柔比星,各浓度组又分4,12,24,48,72 h 时间点进行检测,以不加多柔比星培养的心肌细胞作为对照组,每组设3个复孔。以空白孔调零。各孔加入5 mg/ml MTT 20 μl,37℃孵育4 h后,吸出每孔上清,再各加入200 μl DMSO,振荡10 min,使结晶充分溶解,酶标仪(490 nm)检测各孔光密度(D)值。心肌细胞存活率=(多柔比星组D值-空白孔D值)/(对照组D值-空白孔D值)×100%。
1.2.4 流式细胞术AnnexinⅤ/PI双染法检测凋亡率 心肌细胞按密度1×106/ml培养,分为对照组和多柔比星组,多柔比星组以2 μmol/L多柔比星处理心肌细胞,4,12,24,48,72 h 后进行检测。接种于培养板中的各组细胞加入0.25%胰蛋白酶消化,1 000 r/min离心5 min收集细胞,用磷酸缓冲液(PBS)洗涤细胞2次;各组分别加入结合缓冲液(binding buffer)500 μl混匀悬浮细胞,加入 5 μl FITC标记的膜结合蛋白V(Annexin V-FITC)避光反应,再加入10 μl碘化丙啶(PI)避光4℃孵育5 min,流式细胞仪检测分析。以AnnexinⅤ(+)/PI(-)、AnnexinⅤ(+)/PI(+)两个象限的细胞比例之和作为凋亡率。
1.2.5 ELISA 检测各组心肌细胞上清中 TGF-β1含量 心肌细胞按3×105/ml接种24孔板培养。收集各组细胞上清液,按ELISA试剂盒操作,酶标仪(450 nm)检测各孔光密度值,根据标准曲线计算各组细胞上清中TGF-β1浓度。
1.3 统计学处理
用SPSS 16.0统计软件进行分析。数据均采用均数±标准差(±s)表示,重复测量资料采用一般线性模型方差分析,多组间比较采用单因素方差分析,组间两两比较采用最小显著性差异法(LSD法),相关分析采用Pearson相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 乳鼠心肌细胞形态学观察
原代分离及纯化后的心肌细胞,培养1 d能够贴壁,一部分细胞有微弱的自发搏动,频率为30~40次/min;培养2 d的心肌细胞逐渐伸出伪足,由圆形变为梭形;培养3 d的心肌细胞呈星形、三角形及不规则形,呈团簇状生长,汇合后出现同步搏动,频率为50~60次/min。见图1。
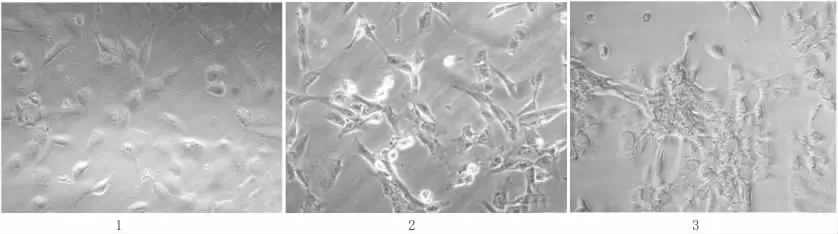
图1 倒置显微镜下观察原代培养乳鼠心肌细胞形态学改变(×400)Fig 1 The cultured cardiomyocytes isolated from 1~2 d SD rats(×400)
2.2 心肌细胞的纯度鉴定
培养3 d的心肌细胞α-SA鉴定,心肌细胞胞质内呈棕黄色,即表达为阳性,非心肌细胞胞质内表达阴性,结果显示心肌细胞纯度可达90%。见图2。
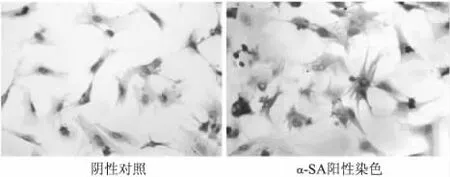
图2 α-SA免疫化学染色鉴定原代心肌细胞纯度(×400)Fig 2 The purify of cardiomyocytes was evaluated by immunocytochemical staining with α-SA(×400)
2.3 多柔比星不同浓度及不同处理时间对心肌细胞存活率的影响
在每个时间点,不同浓度多柔比星处理后的心肌细胞与对照组相比,随着多柔比星浓度的增加,心肌细胞存活率随之下降,呈剂量依赖性(P<0.05);其中,2 μmol/L 组较0.5 μmol/L 组和1 μmol/L 组心肌细胞存活率显著下降(P<0.01)。同一浓度不同时间点之间两两比较,除0.5 μmol/L浓度组48 h和72 h间心肌细胞存活率差异无统计学意义(P>0.05),其余各组间差异均有统计学意义(P<0.05)。见图3。
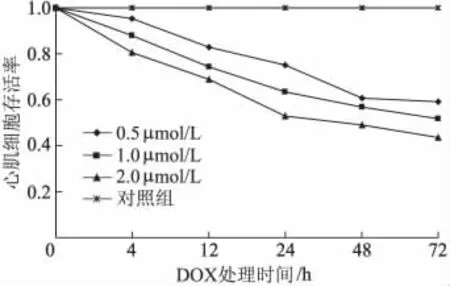
图3 多柔比星不同浓度及不同处理时间对心肌细胞存活率的影响(±s,n=3)Fig 3 The survival rates of cardiomyocytes induced by different concertrations and different times of DOX
2.4 多柔比星对心肌细胞凋亡的影响
流式细胞术分析表明,对照组心肌细胞凋亡率为(1.39 ±0.18)%,而2 μmol/L 多柔比星诱导心肌细胞4 h后,其凋亡率为(3.65±0.49)%,较对照组增加(P<0.05);随着处理时间延长,心肌细胞凋亡率逐渐增加,12,24,48,72 h 的凋亡率分别为(8.54±0.64)%,(11.70 ±1.62)%,(17.67 ±1.48)%,(17.80 ±1.67)%,呈时间依赖性(F=103.80,P <0.05),其中,48 h组和72 h组之间凋亡率差异无统计学意义(P>0.05)。见图4。
2.5 多柔比星对心肌细胞分泌TGF-β1的影响
2 μmol/L多柔比星处理心肌细胞不同时间后,12 h、24 h、48 h 细胞上清中 TGF-β1蛋白浓度较对照组明显增加,72 h 较 24 h,48 h TGF-β1分泌量下降(P<0.05),见图 5。同时,多柔比星诱导 4~48 h后,其所分泌的TGF-β1与心肌细胞凋亡率呈正相关,r=0.932。
3 讨论
蒽环类抗生素多柔比星作为化疗药物已广泛用于治疗各种肿瘤疾病。然而研究发现,多柔比星治疗的肿瘤患者,其心脏疾病发生率呈剂量依赖性,当累积药量达到550 mg/m2时,心脏疾病发生率可达7%[4]。多柔比星心脏毒性临床上主要表现为慢性心肌病过程,严重者可发展为伴有充血性心力衰竭的扩张型心肌病[2]。研究者们希望在不降低多柔比星抗肿瘤特性的同时,减少心脏毒性的发生。目前,对于多柔比星心脏毒性的机制仍不明确,普遍认为,活性氧自由基(ROS)生成、脂质过氧化、线粒体损伤、钙超载、Fe2+-DOX复合物引起的氧化应激是其中重要环节。随着研究深入,多柔比星导致心肌细胞凋亡、细胞因子及特异性基因异常表达、代谢产物阿霉素醇(DOXol)异常蓄积逐渐成为新的研究热点[2]。
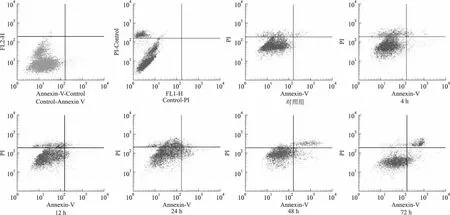
图4 流式细胞术检测心肌细胞的凋亡率Fig 4 The apoptosis rate was determined by flow cytometry(FCM)
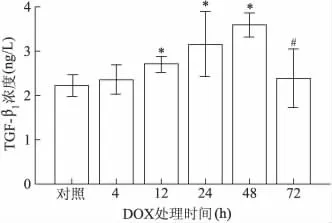
图5 多柔比星诱导心肌细胞不同时间TGF-β1蛋白表达量Fig 5 The protein levels of TGF-β1of cardiomyocytes treated by 2 μmol/L DOX with different times
多柔比星引起的心肌细胞凋亡是心肌病呈慢性发展,并且最终导致心力衰竭的关键。心肌细胞线粒体损伤是多柔比星诱导心肌细胞凋亡的前兆,表现为线粒体肿胀、嵴断裂、空泡化,并能释放一系列可溶性促凋亡蛋白进入细胞质,如细胞色素C、AIF、Smac等,这一机制本课题组已有前期研究[5]。研究还发现,除内在线粒体介导凋亡,多柔比星可以通过激活p38 MAPK途径诱导细胞凋亡,这可能与氧化应激导致ROS蓄积有关[6]。同时,p38 MAPK信号通路又能调节各种促凋亡细胞因子表达,包括TNF-α、IL-1β、TGF-β 等[7]。
然而,多柔比星是否可以通过诱导心肌细胞自身分泌TGF-β来诱导凋亡尚未见报道。在心衰发展过程中,心脏由代偿转向失代偿,心肌细胞或非心肌细胞自身都能产生一系列细胞因子,通过自分泌或旁分泌,在特定的条件下,经特定的信号级联通路,调控心衰的发生发展。研究发现,TGF-β是在心力衰竭过程中急剧增加的细胞因子中的一员[8]。TGF-β1作为TGF-β超家族中的重要亚型,生物学功能最复杂,对其研究也最多[3]。TGF-β1在介导心肌细胞凋亡过程中,主要依赖 SMAD信号通路[9]。Schröder等[10]发现 AngⅡ通过 p38 MAPK 通路激活GATA和AP-1(转录激活因子),使大鼠心肌细胞TGF-β1表达上调,而分泌的 TGF-β1又可以作用于心肌细胞自身,通过激活SMAD信号通路诱导心肌细胞凋亡;Heger等[11]发现 TGF-β1可激活 SMAD4 蛋白,SMAD4又可诱发心肌细胞由肥大向凋亡转变。在大鼠心肌梗死模型中,内皮氧化亚氮合酶(eNOS)能下调Caspase-3、TGF-β1蛋白水平,而在eNOS抑制剂LNAME的作用下,其抑制心肌细胞凋亡的作用减弱,这与抑制 TGF-β1/Smad2信号转导有关[12]。研究者们还发现在扩张型心肌病患者心肌组织中TGF-β1表达上调,且其表达量高低与患者预后密切相关[13]。
本实验通过体外培养原代乳鼠心肌细胞,发现多柔比星在0.5~2 μmol/L浓度范围内均可使心肌细胞存活率下降,呈浓度依赖性,且2 μmol/L多柔比星可使细胞存活率显著下降;多柔比星诱导心肌细胞4~72 h,细胞存活率呈时间依赖性下降,且4 h即可出现显著下降。
在成功建立多柔比星体外心肌细胞损伤模型的基础上,用2 μmol/L多柔比星诱导心肌细胞不同时间,4~48 h内可使细胞凋亡率随时间延长而显著增加,同时细胞自身能够不断分泌TGF-β1且分泌量不断增加,与细胞凋亡率呈正相关,而72 h后TGF-β1分泌量逐渐下降,我们推测这可能与大量心肌细胞出现凋亡及部分坏死后正常分泌功能受损,以及TGF-β1分泌后降解以致检测浓度下降有关。
综上所述,采用2 μmol/L多柔比星诱导心肌细胞4 h即可建立体外心肌细胞损伤模型,在诱导凋亡的同时,心肌细胞TGF-β1表达量逐渐增加,与细胞凋亡率呈正相关,提示在多柔比星诱导心肌细胞时,可以通过自分泌TGF-β1促使心肌细胞发生凋亡,这可能是多柔比星心脏毒性引起心力衰竭的重要机制之一。
[1]Singal PK,Iliskovic N,Li T,et al.D.Adriamycin cardiomyopathy:pathophysiology and prevention[J].FASEB J,1997,11(12):931-936.
[2]Tokarska-Schlattner M,Zaugg M,Zuppinger C,et al.New insights into doxorubicin-induced cardiotoxicity:The critical role of cellular energetics[J].J Mol Cell Cardiol,2006,41(3):389-405.
[3]Dobaczewski M,Chen W,Frangogiannis NG.Transforming growth factor(TGF)-β signaling in cardiac remodeling[J].J Mol Cell Cardiol,2011,51(4):600-606.
[4]Minotti G,Menna P,Salvatorelli E,et al.Anthracyclines:molecular advances and pharmacologic developments in antitumoractivity and cardiotoxicity[J].Pharmacol Rev,2004,56(2):185-229.
[5]徐莉,张赢予,汪健飞,等.缬沙坦对多柔比星诱导的心肌病大鼠心肌线粒体的影响[J].江苏大学学报:医学版,2010,20(1):21-24.
[6]Kim JK,Pedram A,Razandi M,et al.Estrogen prevents cardiomyocyte apoptosis through inhibition of reactive oxygen species and differential regulation of p38 kinase isoforms[J].J Biol Chem,2006,281(10):6760-6767.
[7]Saklatvala J.The p38 MAP kinase pathway as a therapeutic target in inflammatory disease[J].Curr Opin Pharmacol,2004,4(4):372-377.
[8]李勇,戴瑞鸿.心血管分子与细胞生物学原理[M]//陈灏珠,主译.Braunwald心脏病学.5版.北京:人民卫生出版社,1999:1475-1497.
[9]Schneiders D,Heger J,Best P,et al.SMAD proteins are involved in apoptosis induction in ventricular cardiomyocytes[J].Cardiovasc Res,2005,67(1):87-96.
[10]Schröder D,Heger J,Piper HM,et al.Angiotensin II stimulates apoptosis via TGF-β1signaling in ventricular cardiomyocytes of rat[J].J Mol Med,2006,84(11):975-983.
[11]Heger J,Peters SC,Piper HM,et al.SMAD-proteins as a molecular switch from hypertrophy to apoptosis induction in adult ventricular cardiomyocytes[J].J Cell Physiol,2009,220(2):515-523.
[12]Chen LL,Yin H,Huang J.Inhibition of TGF-beta1 signaling by eNOS gene transfer improves ventricular remodeling after myocardial infarction through angiogenesis and reduction of apoptosis[J].Cardiovasc Pathol,2007,16(4):221-230.
[13]Felkin LE,Lara-Pezzi E,George R,et al.Expression of extracellular matrix genes during myocardial recovery from heart failure after left ventricular assist device support[J].J Heart Lung Transplant,2009,28(2):117-122.
