新型松香基酰基亚胺噻唑烷衍生物的合成
2012-11-21饶小平王宗德宋湛谦
伍 勇, 饶小平, 王宗德, 宋湛谦
(1. 四川卫生康复职业学院 公共系,四川 自贡 643000; 2. 中国林业科学研究院 林产化学工业研究所 国家林业局林产化工重点开放性实验室,江苏 南京 210042; 3. 江西农业大学 园林与艺术学院,江西 南昌 330045)
研究表明含噻唑杂环结构的化合物具有广谱的生物活性以及低毒性等[1~3]特点,并已经成为当前绿色农药研究的热点之一。1,3-噻唑烷类化合物则在农药领域中被广泛作为杀虫剂、杀菌剂、除草剂、植物抗病毒剂等[4~7]使用,是近年来发展的一个新亮点。由天然产物松香树脂酸为原料合成的松香基酰基亚胺噻唑烷其结构活性基团主要为羰基、亚胺(N=C)双键、及1,3-噻唑杂环,且具有潜在的生物农药、医药等生理活性。
本文以脱氢枞酸(1a)或二氢枞酸(1b, Chart 1)为起始原料,经酰卤化、硫氰酸根加成、有机胺加成异构、浓盐酸催化脱水成环合成了两个新型的松香基酰基亚胺噻唑烷衍生物(5a和5b, Scheme 1),产率分别为29%和41.8%,其结构经1H NMR,13C NMR和IR表征。
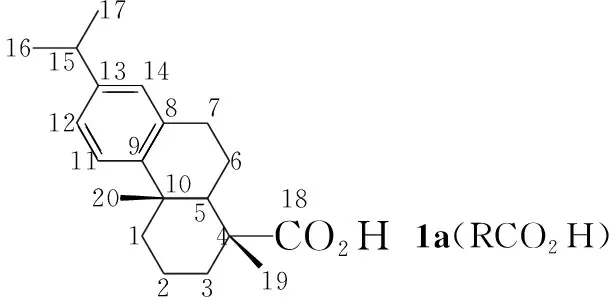
Chart1
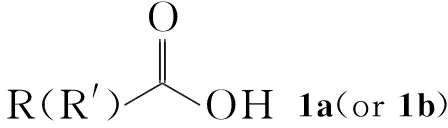
Scheme1
1 实验部分
1.1 仪器与试剂
XT5型数显双目显微熔点仪(温度未经校正);Bruker AV-500型核磁共振波谱仪(CDCl3为溶剂,TMS为内标);Bruker Vector 22型傅立叶变换红外光谱仪(KBr压片);Shimadau GC-7AG型气相色谱仪(色谱柱为OV-17毛细管柱)。
1a,浙江万安塑料有限公司;氢化松香,广西梧州日成林产化工有限公司,用无水乙醇重结晶制得1b,含量90.56%~96.78%;其余所用试剂均为分析纯或化学纯。
1.2 合成
(1) 松香基酰氯(2a和2b)的合成
在四口烧瓶中加入1a(或1b) 100 g的CH2Cl2(150 mL)溶液,搅拌下滴加二氯亚砜36.5 mL,滴毕,于40 ℃~45 ℃反应5 h。冷却后减压蒸除溶剂得油状液体2a(或2b)。
(2) 松香基异硫氰酸酯(3a和3b)的合成
在四口烧瓶中加入硫氰酸钾38.5 g的乙腈(80 mL)溶液,搅拌下滴加2a(或2b)的CH2Cl2(100 mL)溶液,滴毕,回流反应90 min。冷却至室温,过滤,滤液用蒸馏水(3×33 mL)洗涤,无水硫酸钠干燥,减压蒸除溶剂得红棕色油状液体3a(或3b)。
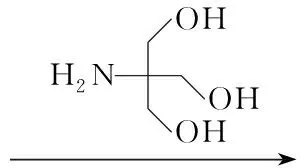
(3) 松香基酰基硫脲三羟甲基氨基甲烷(4a和4b)的合成
在四口烧瓶中加入3a(或3b) 50 mmol的CH2Cl2(30 mL)溶液,搅拌下滴加三羟甲基氨基甲烷55 mmol的CH2Cl2(25 mL)溶液,滴毕,于43 ℃反应6 h。冷却后减压蒸除溶剂得黏稠物4a(或4b)。
(4)5a和5b的合成
在反应瓶中依次加入4a(或4b)和浓盐酸50 mL,搅拌下于95 ℃反应1 h。冷却后用40%NaOH溶液调至pH 9~10,用水洗涤,过滤,滤饼用水洗涤2次~3次,依次用乙醇、石油醚重结晶得白色晶体5a(或5b)。5a(或5b)不溶于水,能溶于热乙醇和热丙酮,易溶于氯仿、甲苯、DMF, DMSO等有机溶剂。
5a: 产率29.0%(以4a计算),m.p.184.4 ℃~186.0 ℃;1H NMRδ: 7.15~6.87(m, 3H, 11,12,14-H), 4.53(s, 3H, 24,25-OH, NH), 3.83~3.64(s, 4H, 24,25-H), 3.34(s, 2H, 23-H), 2.83(m, 1H, 15-H), 1.77(t, 1H, 5-H), 2.88~1.42(m, 10H, 1,2,3,6,7-H), 1.27~0.83(s, 12H, 16,17,19,20-H);13C NMRδ: 178.9(C18), 172.1(C21), 146.3(C9), 126.9(C14), 145.8(C13), 134.3(C8), 123.9(C11,12), 72.1(C22), 62.5(C24,25), 48.5(C5), 44.3(C4), 37.3(C3), 37.0(C1,10), 36.2(C23), 33.4(C15), 29.7(C7), 25.2(C20), 23.9(C17,16), 21.5(C19), 18.4(C6), 16.4(C2); IRν: 3 384(N-H), 3 192, 3 120(O-H), 2 956, 2 931, 2 870(-CH3, -CH2), 1 720(C=O), 1 591(N=C), 1 525(O=C-N), 1 229(C-S), 1 169(C-N), 1 052, 1 037(C-O), 821(Ar) cm-1。
5b: 产率41.8%(以4b计算),m.p.182.5 ℃~183.4 ℃;1H NMRδ: 4.44(s, 3H, 24,25-OH, NH), 3.89~3.77(s, 4H, 24,25-H), 3.34(s, 2H, 23-H), 1.45(m, 1H, 15-H), 1.63(t, 1H, 5-H), 1.89~1.86(m, 1H, 15-H), 1.99~1.32(m, 16H, 1,2,3,6,7,11,12,14-H), 1.21~0.82(s, 12H, 16,17,19,20-H);13C NMRδ: 178.6(C18), 173.0(C21), 137.1(C9), 126.1(C8), 71.9(C22), 62.2(C24,25), 48.6(C5), 45.8(C4), 40.3(C1), 37.3(C3), 37.0(C13), 36.2(C23), 35.1(C10), 34.3(C14), 32.5(C15), 31.5(C7), 27.0(C12), 24.5(C11), 21.2(C20), 19.8(C19), 19.5(C16), 19.3(C17), 18.3(C6), 16.3(C2); IRν: 3 395(N-H), 3 193, 3 127(O-H), 2 952, 2 933, 2 870(-CH3, -CH2), 1 724(C=O), 1 593(N=C), 1 521(O=C-N), 1 206(C-S), 1 169(C-N), 1 090, 1 052(C-O) cm-1。
2 结果与讨论
由4a(或4b)合成5a(或5b))时选择浓盐酸作质子试剂,是因为该反应脱水温度要求不高,盐酸挥发较少;浓盐酸既是催化剂又是溶剂。松香的三环菲结构对成环反应有较大的空间位阻,且噻唑环为五元环,加之环上取代基伸展空间较大,都对反应有较大影响,故产率较低。
本文分别以脱氢枞酸、二氢枞酸为起始原料经四步反应合成了松香基酰基亚胺噻唑烷衍生物(5a和5b)。脱水关环[4a(或4b)→5a(或5b)]反应具有反应条件温和、反应时间较短、操作简便、产物易分离等优点。
5a和5b具有潜在的抑菌、抗肿瘤等生物活性,有望得到广泛应用。
[1] Novak L, Hornyanszky G, Rohaly J,etal. Preparation of novel hexythiazox analogues[J].Pesticide Science,1997,49(1):85-89.
[2] 胡利民,李学恕,陈志远,等. 含1H-吡啶和噻(二)唑的新型双杂环化合物的合成及其生物活性[J].有机化学,2003,23(10):1131-1134.
[3] 文丽荣,李明,景淑霞,等. 2-(1-苯基/取代苯基-3-甲基-5-氯-1H-4-吡唑基)-3-芳酰胺-4-噻唑啉酮的合成及生物活性[J].有机化学,2005,25(02):197-200.
[4] Takahiro H, Tadaaki T, Toru K,etal. Organophosphoms compounds and insecticidal,miticidal or nematocidal composition containing them[P].EP l46 748,1985.
[5] Umemura T, Morino H, WataJlabe T,etal. Method for preparing 4-substituted-N-methylbenzothiazolone derivatives[P].DE 2 924 712,1979.
[6] Takallo M, Enomoto M, Saito K,etal. Iminothiazolone derivative and use thereof[P].JP 7 304 759,1995.
[7] 翁建全,沈德隆,陈杰,等.N-烃氧羰基-2-噻唑烷酮衍生物的合成及其杀菌活性[J].农药学学报,2005,7(1):73-76.
