钙蛋白酶与谷氨酸的兴奋性毒性
2012-11-20刘婉珠隋海娟辽宁医学院药理学教研室辽宁锦州2000
王 蕊 金 英 刘婉珠 隋海娟 (辽宁医学院药理学教研室,辽宁 锦州 2000)
谷氨酸是中枢神经系统的兴奋性神经递质,但其浓度过高将引起神经毒性。中风、颅脑损伤、癫痫〔1~3〕等急性脑病引起谷氨酸大量释放,导致神经毒性。此外,退行性神经疾病如阿尔茨海默病(AD)的发病机制也牵涉到兴奋性毒性〔4〕。高浓度谷氨酸引起NMDA受体过度激活,使Ca2+大量进入神经元,并进一步激活其下游钙蛋白酶。钙蛋白酶是半胱氨酸蛋白水解酶,有两种异构体,钙蛋白酶Ⅰ(μ-calpain)和钙蛋白酶Ⅱ(mcalpain)。两种钙蛋白酶激活所需的钙离子浓度不同,钙蛋白酶Ⅰ的激活需要微摩尔级的钙浓度,钙蛋白酶Ⅱ的激活需要毫摩尔级的钙浓度〔5〕。两种钙蛋白酶的作用底物相似,它们的过度激活与细胞损伤有着密切的关系〔6〕。本研究采用乳鼠大脑皮质神经元进行体外培养,观察钙蛋白酶Ⅰ在谷氨酸作用后的表达、细胞内定位及钙蛋白酶抑制剂MDL-28170对神经元的保护作用。
1 材料与方法
1.1 药品和试剂 谷氨酸,二甲基亚砜(DMSO),DMEM,F12培养基,Hoechst 33258,胰蛋白酶(trypsin,1∶250),L-多聚赖氨酸(poly-L-lysine)均购自Sigma公司。MTT试剂购于碧云天生物技术研究所。胎牛血清、HEPES、马血清购于北京华美转导科技有限公司。钙蛋白酶Ⅰ大亚单位多克隆抗体购于Cell Signal公司(Beverly,MA,USA)。MDL-28170,兔抗神经元特异性烯醇化酶(NSE)多克隆抗体,鼠抗神经丝蛋白(NF200)单克隆抗体,山羊抗兔、山羊抗鼠二抗均购自Santa Cruz公司。β-肌动蛋白抗体和NBT/BCIP显色液购于Beyotime试剂公司。
1.2 细胞培养 取出生24 h以内的SD大鼠乳鼠(辽宁医学院实验动物中心提供)。75%乙醇浸泡消毒,无菌条件下取出大脑皮层,置于培养基中,剔除血管和软脑膜,剪成1 mm3左右的小块。加入0.125%胰蛋白酶,37℃消化10 min。待细胞分散后,加入含10%胎牛血清和10%马血清的DMEM/F12培养基,终止消化。200目筛网过滤,离心10 min,用含10%胎牛血清和10%马血清的DMEM/F12培养基制成细胞悬液,调整细胞密度为(1~10)×108/L,接种在铺有L-多聚赖氨酸24孔或6孔培养板中,置于37℃、5%CO2培养箱中培养。培养48 h后加入含阿糖胞苷(终浓度为5 mg/L)的培养基,抑制非神经细胞增殖。以后每3天换液1次,培养7 d后用于实验。应用抗NSE多克隆抗体和抗NF200抗体免疫荧光染色进行神经元纯度鉴定,结果表明神经元纯度在90%以上。
1.3 实验分组 细胞分为对照组;谷氨酸组:加入谷氨酸(100 μmol/L)作用 24 h;谷氨酸 +MDL-28170组:先加入MDL-28170(10 μmol/L)作 用 30 min,然 后 加 入 谷 氨 酸(100 μmol/L)作用 24 h;MDL-28170 组:加入 MDL-28170(10 μmol/L)作用24 h,MDL-28170 浓度根据文献报道〔7〕和预实验确定。
1.4 MTT法测定细胞活力 将接种在96孔培养板的神经元按以上分组处理后,加入MTT(终浓度0.5 g/L)培养4 h,弃去上清液,每孔加入DMSO 150 μl,待颗粒溶解后,在570 nm的吸光值下检测各孔的吸光度值(A),并根据公式计算细胞生存率。细胞生存率(%)=(A实验组-A空白组)/(A正常对照组-A空白组)×100%。
1.5 Hoechst33258核染色检测细胞凋亡情况 依据Jin等〔8〕的方法,按以上分组加入药物处理后,移去培养基,用冷磷酸盐缓冲液(PBS)洗2次,4%的多聚甲醛固定20 min,弃固定液,双蒸水冲洗2次,Hoechst33258 5 mg/L避光染色10 min,用双蒸水冲洗2次,室温晾干后于荧光显微镜(Olympus)下观察拍照。每组取4张盖玻片,每张片随机选取4个高倍视野,计算凋亡细胞占每个视野总细胞数的百分比,求出16个视野平均百分比,作为该样本的凋亡百分比。
1.6 免疫荧光染色检测钙蛋白酶Ⅰ表达 培养7 d的皮层神经元,经各因素处理后,移去培养基,用冷PBS洗2次,然后用4%的多聚甲醛固定30 min,弃固定液,PBS洗3次,每次10 min,然后用 TritonX-100 0.3%作用30 min,PBS洗3次,每次10 min,3%BSA封闭30 min,然后加入钙蛋白酶Ⅰ大亚基的多克隆抗体(1∶100)4℃过夜后,PBS洗3次,再加入罗丹明标记的二抗,37℃孵育2 h,PBS洗3次,Hoechst33258核复染10 min,PBS洗3次,每次10 min,最后甘油封片,荧光显微镜下观察。
1.7 Western蛋白印迹检测钙蛋白酶Ⅰ蛋白水平 原代培养的神经细胞,经各种因素处理后,用冷PBS冲洗,立即放入预冷的裂解缓冲液中4℃ 超声粉碎后,离心30 min,取上清,用Lowry等法测定蛋白质含量,以牛血清白蛋白为标准品,将各组蛋白浓度调成一致。用10% ~12%(SDS-PAGE分离蛋白质,每个泳道蛋白上样量为20 μg。为了准确判断目的蛋白带的位置,一个泳道加SeeBlue Plus 2预染蛋白标记物,电泳后将PAGE凝胶中的蛋白质电转移至硝酸纤维素膜上,取出后将膜放入3%BSA阻断缓冲液中,封闭60 min,再用TBS,洗膜3次,每次10 min。将膜放入一抗中(抗体1∶500稀释),4℃过夜。TTBS冲洗后,将膜放入二抗中,室温孵育1~2 h,然后用TTBS洗膜3次,每次10 min,置硝基四氮唑蓝/5溴-4氮-3吲哚磷酸盐(NBT/BCIP)显色液中显色,直至出现,终止反应。每个抗体测定时都将与β-actin相应的膜用TBS洗3次后,将膜放入βactin抗体中,4℃过夜,进行杂交,TTBS冲洗后,将膜放入二抗中,室温孵育1 h。再用TTBS洗膜3次后,放入NBT/BC IP显色液中避光显色,直至显色,终止反应,以保证蛋白上样量的一致性。将蛋白印迹显影图扫描,利用凝胶自动分析成像软件Chem Image 5500对蛋白带进行积分吸光度值(IA)分析。
2 结果
2.1 MDL-28170抑制谷氨酸引起的神经元细胞活力降低 谷氨酸组神经元细胞活力较对照组明显降低〔(71.5±6.1)%vs(100.0±5.4)%,P<0.01〕,谷氨酸+MDL-28170组较谷氨酸组明显升高〔(89.0±2.6)%,P<0.01〕。MDL-28170单独使用对神经元细胞活力没有影响〔(97.5±1.9)%,P>0.05〕。
2.2 MDL-28170抑制谷氨酸引起的神经元凋亡 图1可见,对照组神经元凋亡百分比为(8.7±1.3)%(n=16),谷氨酸组为(35.4±6.9)%(n=16,与对照组比较 P<0.01),谷氨酸+MDL-28170组为(13.4±1.6)%(n=16,与谷氨酸组比较P<0.01),MDL-28170单独应用对细胞凋亡百分比没有影响(10.7±1.1)%。凋亡神经元的特征是胞核缩小,染色质浓缩,或核碎裂(图1,箭头)。
2.3 谷氨酸引起皮质神经元钙蛋白酶Ⅰ表达增加 钙蛋白酶Ⅰ免疫荧光染色结果显示,谷氨酸作用24 h后,钙蛋白酶Ⅰ表达较对照组明显增多,而且钙蛋白酶Ⅰ主要表达在凋亡的细胞核内(箭头所示)。Western蛋白印迹结果显示,与对照组相比谷氨酸组80 kD和76 kD钙蛋白酶Ⅰ蛋白水平明显增加。见图2、图 3。
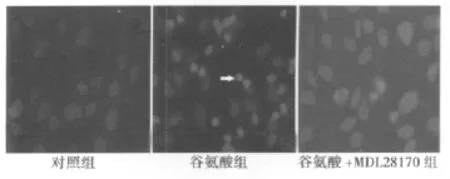
图1 MDL-28170抑制谷氨酸引起的皮质神经元凋亡(×400)
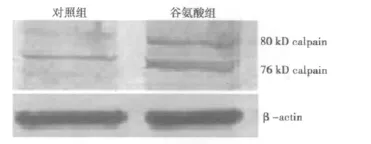
图2 谷氨酸对皮质神经元钙蛋白酶Ⅰ蛋白水平的影响
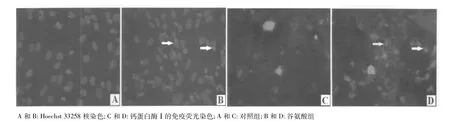
图3 谷氨酸对钙蛋白酶Ⅰ(μ-calpain)表达的影响(×400)
3 讨论
N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受体是钙通道耦联受体。细胞外异常增多的谷氨酸过度激动NMDA受体使钙离子大量进入细胞内并激活钙蛋白酶。钙蛋白酶由大亚基(80 kD)和小亚基(30 kD)构成,激活时首先大小亚基分离,然后大亚基自溶产生76 kD活性产物〔9〕。本研究发现谷氨酸作用24 h后,钙蛋白酶80 kD大亚基与76 kD活性产物明显增多,而钙蛋白酶抑制剂MDL-28170明显抑制了谷氨酸引起的神经元损伤。钙蛋白酶被激活后通过水解细胞骨架蛋白,可引起细胞形态的改变;此外钙蛋白酶还可劈切抗凋亡蛋白Bcl-2,导致细胞色素c的释放而激活线粒体途径的凋亡通路〔10〕。本研究发现谷氨酸作用24 h后,钙蛋白酶在凋亡的细胞核中大量表达,而在胞浆和存活的细胞核中表达较少,可能是钙蛋白酶在细胞凋亡的过程中发生了核移位。本研究证明钙蛋白酶在谷氨酸作用后被大量激活,并在细胞凋亡过程中移位至细胞核,钙蛋白酶抑制剂MDL-28170对谷氨酸引起的皮质神经元损伤具有保护作用。
1 Bancila V,Nikonenko I,Dunant Y,et al.Zinc inhibits glutamate release via activation of pre-synaptic K channels and reduces ischaemic damage in rat hippocampus〔J〕.J Neurochem,2004;90(5):1243-50.
2 Jennings JS,Gerber AM,Vallano ML.Pharmacological strategies for neuroprotection in traumatic brain injury〔J〕.Mini Rev Med Chem,2008;8(7):689-701.
3 Peña F,Tapia R.Seizures and neurodegeneration induced by 4-aminopyridine in rat hippocampus in vivo:role of glutamate-and GABA-mediated neurotransmission and of ion channels〔J〕.Neuroscience,2000;101(3):547-61.
4 Harris ME,Wang Y,Pedigo NW Jr,et al.Amyloid beta peptide(25-35)inhibits Na+-dependent glutamate uptake in rat hippocampal astrocyte cultures〔J〕.J Neurochem,1996;67(1):277-86.
5 Chiu K,Lam TT,Ying Li WW,et al.Calpain and N-methyl-D-aspartate(NMDA)-induced excitotoxicity in rat retinas〔J〕.Brain Res,2005;1046(1-2):207-15.
6 Mansouri B,Henne WM,Oomman SK,et al.Involvement of calpain in AMPA-induced toxicity to rat cerebellar Purkinje neurons〔J〕.Eur J Pharmacol,2007;557(2-3):106-14.
7 James R,Brorson MD,Charles J,et al.Delayed Antagonism of Calpain reduces excitotoxicity in cultured neurons〔J〕.Stroke,1995;26:1259-67.
8 JinY,Yan EZ,Fan Y,et al.Neuroprotection by sodium ferulate against glutamate-induced apoptotic cell death is mediated by ERK and PI3 kinase pathways〔J〕.Acta Pharmacol Sin,2007;28(12):1881-90.
9 Rami A,Volkmann T,Agarwal R,et al.β2-Adrenergic receptor responsiveness of the calpain-calpastatin system and attenuation of neuronal death in rat hippocampus after transient global ischemia〔J〕.Neurosci Res,2003;47(4):373-82.
10 Gil-Parrado S,Fernández-Montalván A,Assfalg-Machleidt I,et al.Ionomycin-activated calpain triggers apoptosis.A probable role for Bcl-2 family members〔J〕.J Biol Chem,2002;277(30):27217-26.
