宫颈脱落细胞hTERC基因扩增在宫颈病变筛查中的应用与意义
2012-11-20李招云张黎明范广明沈景丰
李招云 张黎明 王 攀 朱 杰 范广明 沈景丰*
(浙江省台州市中心医院,浙江 台州 318000)
子宫颈癌(SCC )是危害女性健康的主要恶性肿瘤之一,国际上,SCC处于妇女恶性肿瘤的第二位,每年约25万人死于SCC。我国SCC患病率和病死率均占世界1/3,每年新发病例9万左右,且患者年龄有年轻化上升趋势[1]。SCC是可预防和治愈的,早期筛查和定期复查,积极处理癌前病变,可阻断病程,预防SCC,特别是宫颈癌浸润癌的发生。我国目前筛查SCC宫颈癌的主要方法是TCT检查及HPV检测,但在临床上的应用均存在一定的局限性,近年研究人员一直在寻求一种新的跟准确的指标,以提高筛查力度。非整倍体染色体是癌细胞普遍存在的遗传学特征之一,现代细胞遗传学和分子生物研究表明,人类大多数肿瘤细胞常表现出染色体不稳定导致的非整倍体,染色体的不稳定性可致端粒酶功能异常的发生[2],端粒酶功能异常就可使正常细胞获得肿瘤细胞的“不死性”。SCC染色体研究显示,该肿瘤细胞3号染色体位点遗传呈不稳定性,多为3q26~3q27拷贝数增加[3,4],同时发现SCC拷贝数增加明显高于重度不典型增生,据此推测此区域可能存在SCC发生的致病基因[5,6]。本研究用荧光原位杂交方法检测正常宫颈细胞、CIN宫颈上皮及SCC肿瘤细胞中hTERC基因的异常扩增,以探讨hTERC基因的异常扩增与SCC发生发展过程的关系,为临床SCC筛查、诊断提供实验依据。
1 材料与方法
1.1 对象
选择台州市中心医院2008年6月至2010年12月门诊收集的经宫颈脱落细胞液基细胞学检查正常女性45名,宫颈异常病变患者208例,年龄18~65岁,平均年龄42岁。208例宫颈脱落细胞液基细胞学减产异常患者均行阴道镜检查及病理活检一一明确诊断。同时,按伯波塞斯达系统分类法将其分为宫颈脱落细胞液基细胞学检测正常组(简称“正常组”)45名、ASC组41例、LSLL组115例、HSLL组21例和SCC组31例。208例TCT检查ASC以上异常患者在阴道镜下行病理活检,确定为炎症或湿疣组34例 、CIN1~3期3组共148例、SCC组26例。表1 台州市中心医院依据中国病理学会诊断标准对受试者进行巴氏涂片、病理学诊断与TCT细胞形态学所得结果之间的对照。
1.2 方法
1.2.1 细胞标本的采集
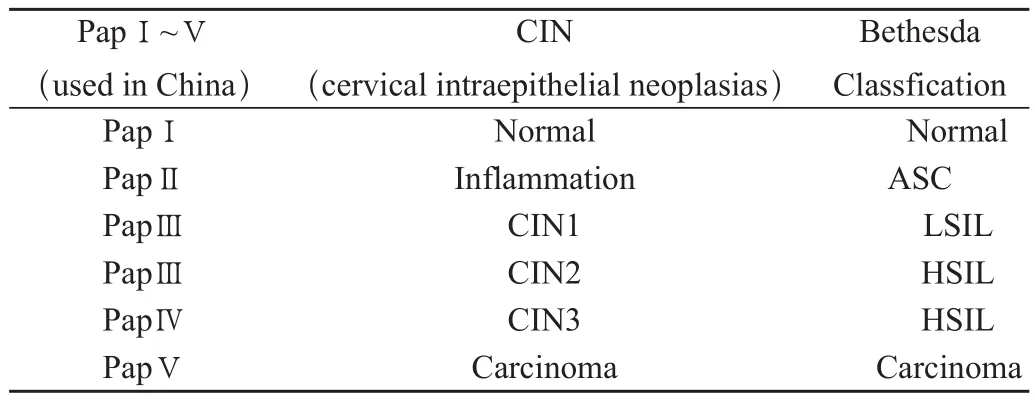
表1 巴氏涂片、病理学诊断与TCT细胞形态学结果之间的对照
TCT子宫颈刷在宫颈口鳞柱上皮交界处取细胞标本,并置TCT保存液中。保存液中的宫颈悬浮细胞按照常规用于TCT检查,剩余的用于FISH检测。
1.2.2 制片
取TCT检查剩液约10mL,1200×g离心10min,1×PBS洗涤两遍后离心去除上清液;胶原酶B 5mL(1mg/mL)37℃水浴30min,再次离心。加入5mL去离子水,低渗重新吹打悬浮细胞。37℃水浴30min,加2mL固定液(甲醇∶冰乙酸=3∶1)预固定5min。离心后弃上清液,再加上5mL固体液重复以上“固定、去除上清液的”步骤2次,用沉淀的细胞制备成一定浓度的溶液,将细胞滴于玻璃上,56℃烤片3h后推制细胞片。
1.2.3 FISH检测hTERC基因
①探针:GIPTERC/CSP3DNA探针由北京菩嘉医疗科技有限公司提供。将TERC DNA探针杂交到3号染色体长臂(3q26.3),荧光信号为绿色。②标本片预处理:涂片置2×SSC洗脱2次,70%、85%和100%乙醇梯度脱水固定,自然干燥。③FISH操作步骤:避光环境中,10μL探针混合液(7μL杂交缓冲液、1μL去离子水和2μL探针)滴于杂交区域,加盖盖玻片,橡皮胶封片,置于原味杂交仪(ThermoBriteTM)中76℃5min,42℃16h过液杂交,第2天将玻片洗脱,移去盖玻片,在水浴温度67℃下,玻片置2×SSC/0.3%NP-40溶液中1.5min,最后于70%乙醇溶液中10min脱水。玻片自然干燥后,加15μLDAPI(4,6-diamidino-2-phenylndole)复染液。用盖玻片封好,放于暗盒中复染20min。
1.2.4 FISH信号的判断
用OlympusB×51荧光显微镜在DAPI/FTTC/TRITC三色滤光镜激发下观察间期细胞荧光杂交信号,用Video2.0公司提供的FISH分析软件进行图像分析,评估整个涂片的CSP3和TERC基因双色探针杂交情况,选择细胞核状态完整、杂交信号结果为绿:红,正常细胞杂交信号为2∶2型,异常细胞信号包括2∶3、2∶4、2∶5、3∶3、3∶4、4∶5、5∶5、10∶10型等。从正常组中选20名健康人宫颈细胞玻片,各计数信号完整的100个细胞,记录其中的异常细胞数、将TERC基因异常扩散的临界值定为(异常细胞χ—±3s)×100%,大于此值为TERC基因扩增阳性。本试验临界值为5.9%,取整数,将临界值≥6定义为TERC基因扩增异常。
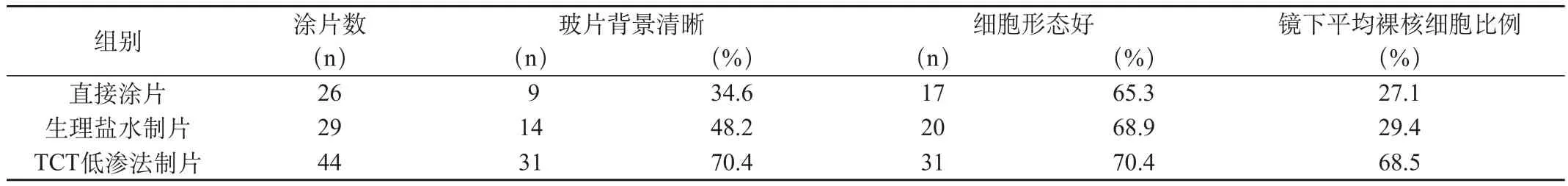
表2 各组细胞涂片背景、细胞形态

表3 各组细胞涂片杂交信号
1.3 统计学分析
用SPSS10.0软件进行统计学分析,各组间hTERC表达阳性率分析比较,采用行x列表资料和表资料的χ2检验,标准α=0.05。
2 结 果
2.1 不同制片方式所得FISH杂交片在背景与细胞形态方面的比较
直接涂片26张;生理盐水制片29张;TCT低渗制片44张。直接涂片法、生理盐水法与TCT低渗法玻片背景清晰度分别为34.6%(9/26)、48.2%(14/29)和70.4%(31/44),各组之间有明显差异(P<0.05),其中以TCT低渗法最满意。TCT低渗法高倍镜下平均裸核细胞比例高于直接涂片法、生理盐水法,差异有显著性(P<0.05)。见表2。
2.2 不同制片方式所得FISH杂交片在杂交信号方面的比较
TCT低渗法高倍镜下无/少信号比例高于直接涂片法和盐水制片法,差异有显著性(P<0.05)。直接涂片法、生理盐水法高倍镜下无/少信号比例无明显差异(P>0.05)。TCT低渗组杂交成功率与直接涂片法、生理盐水法比较,差异有显著性(P<0.05)。见表3。
3.2 TCT分组的受试者FISH检测hTERC基因扩增结果
TCT检测45名正常涂片和异常涂片208例患者,经FISH检测,hTERC基因异常扩增阳性率在正常组、ASC组、LSIL组、HSIL组、SCC组分别为2.2%(1/45)、4.8%(2/41)、73.0%(84/115)、95.2%(20/21)、100%(31/31);ASC组明显低于LSLL组和HSIL组(χ2=15.16、36.93,P均<0.01)。见表4。提示FISH检测hTERC基因扩增阳性率对宫颈病变的进展趋势有一定的预见性。

表4 TCT分组的受试者FISH检测hTERC基因扩增阳性率
2.4 病理活检分组的受试者FISH检测hTERC基因扩增结果
病理活检确定的253例受检者中,经FISH检测,hTERC基因扩增阳性率在正常者组、炎症者组、CINⅠ组、CIN Ⅱ期组、CIN Ⅲ期组、SCC组分别为2.2%(1/45)、 4.8%(2/41)、 70.5%(31/44)、82.5%(33/40)、100%(21/21)、100%(31/31)。见表5。CINⅠ组、CIN Ⅱ组、CIN Ⅲ组、SCC组与涂片正常比较,hTERC基因阳性率差异均有统计学意义(χ2=132.38,P<0.01)。其中CINⅠ期与CINⅡ期比较,CIN Ⅱ期与CIN Ⅲ期/SCC比较,均采用直接概率法检验,结果显示前者差异具有统计学意义(P=0.04),而后者差异无统计学意义(P=0.37),且随组织学病变程度增加,hTERC基因扩增阳性率增加。说明FISH检测hTERC基因扩增阳性率在CINⅠ期组、CIN Ⅱ期组、CIN Ⅲ期组、SCC组效果更好。
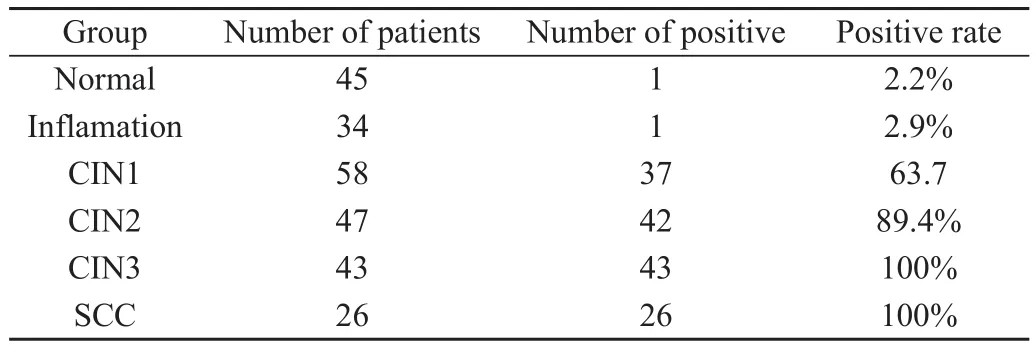
表5 病理活检分组的受试者FISH检测hTERC基因扩增阳性率
2.5 hTERC基因拷贝数异常表现类型
我们共计数细胞39001个,其中异常细胞15763个,CIN组和SCC组患者中,hTERC基因异常杂交信号多样化表现为CSP3:hTERC(绿信号:红信号)为2∶3、2∶4、2∶5、3∶3、4∶4、5∶5、3∶6、3∶5、4∶8、10∶10等类型,其中前6种类型较为常见。各种类型受试者宫颈细胞FISH检测的镜下图片及其宫颈异常病变患者hTERC基因扩增细胞杂交信号类型分布分别见图1和表6。34例患者炎性细胞涂片中,异常细胞中2∶3型占63.8%;58例CINⅠ期患者涂片中,异常细胞中2∶3型占50.4%;47例CIN Ⅱ期患者涂片中,异常细胞中2∶3型仅占30.7%,较炎症和CINⅠ期明显下降(χ2=8.3,P<0.05),但出现双色>3的多倍体比例明显增高;43例CIN Ⅲ期涂片患者中异常细胞>3的多倍体占90.1%,比CIN Ⅱ期中69.3%有明显上升(χ2=24.1,P<0.01);26例SCC患者涂片中,异常细胞中>3的多倍体占98.4%与CIN Ⅲ期的90.1%比较无明显差别(χ2=2.1,P>0.05),可见到随着病变严重程度的增加,hTERC基因扩增的拷贝数增加,并出现10∶10的多倍体。所有异常细胞中出现的多倍体一3∶3型最常见,在CINⅠ期、CIN Ⅱ期、CIN Ⅲ期、SCC组中hTERC基因扩增杂交信号≥3∶3型的异常细胞数占总异常细胞数的百分比分别为26.0%、52.1%、65.9%和90.7%,呈渐进上升趋势。见表6。

表6 宫颈异常病变患者hTERC基因扩增细胞杂交信号类型分布

图1 宫颈异常病变患者hTERC基因扩增细胞杂交信号类型分布
3 讨 论
FISH技术是一种分子细胞遗传学技术,其基本原理是利用碱基的互补性,将标记上荧光素的探针与待测样本的DNA进行杂交,通过荧光显微镜收集荧光信号,从而对待测核酸进行定性、定量及定位分析,可发现常规细胞遗传技术无法检测到的基因或染色体异常。FISH技术可直接检测活检实体肿瘤组织细胞中的基因改变,突破了检测实体肿瘤基因异常受细胞培养困难的限制[4],具有特异性强、准确、快速等优点,目前广泛应用于产前、产后遗传病诊断及血液肿瘤、实体瘤等方面的检测。
FISH技术检测宫颈脱落细胞TERC基因的扩增主要包括以下几个步骤:①样本玻片制备程序;②样本玻片预处理程序;③FISH杂交操作步骤;④杂交荧光信号的观测。本实验从宫颈脱落细胞几种取材和制片方法的角度,探讨了双色间期FISH技术用于宫颈脱落细胞TERC基因检测的方法,成功得到了TERC基因在宫颈脱落细胞上的杂交荧光信号。从取材和制片方法对FISH结果影响来看,杂交是否成功与玻片制备的质量、预处理过程关系密切。TCT低渗细胞制备过程中漂洗、离心等步骤去除了粘液等杂质的干扰,血液污染少,经过了低渗和胶原酶的处理使细胞质易于消化,裸核细胞比例高,更易杂交,信号明显,并且背景清晰,假阳性也随之降低。新鲜的脱落细胞除了易于消化外,细胞染色质破坏少也可能是导致杂交率高的原因。另外,新鲜涂片减少了TCT等保存液对染色体的破坏,也是致使杂交率高的原因之一。实验结果表明,新鲜细胞直接涂片、生理盐水制片、TCT低渗制片三种样本玻片制备程序(样本玻片预处理程序)中,以TCT低渗制片操作方法简单快速,玻片背景最为清晰,杂交成功率最高。需要引起注意的是,以上3种制片方法都要求细胞涂片制作均匀,减少细胞重叠,玻片预处理时掌握合适的温度和时间。本研究采用TCT低渗法制片进行的初步临床FISH检测显示炎症患者FISH检测的阳性率为4%(1/25)、CIN2患者FISH检测的阳性率为72.7%(17/22)、宫颈癌患者FISH检测的阳性率为100%(16/16),该结果与江静等[5]所作的研究结果相似。
FISH技术已广泛应用于产前及胚胎植入前遗传学诊断、各种肿瘤的检测,用宫颈脱落细胞诊断宫颈癌的研究已有小样本的相关报道[9-11]。 FISH技术检测的优点是细胞中的DNA结构稳定,不易被环境条件影响;其次操作相对简单,稳定性较好,可用于间期细胞,不需要细胞培养[12-14];另外FISH结果的判定借助于对荧光的颜色判断和信号计数,客观上量化了检测结果,最大限度的降低操作者和检测着得主观因素,确保结果的准确性[15,16]。我们采用原位杂交仪进行探针的杂交代替了繁琐的甲酰胺75℃水浴箱变性,—20℃梯度乙醇脱水,42℃孵化等步骤,避免了甲酰胺毒性物质的接触,试验显示的结果清晰。
大量研究证明,HPV感染是宫颈癌的主要致病因素,甚至95%的癌前病变患者携带HPV癌基因,但只有很少病例最终发展到浸润性宫颈癌,因此,HPV检测特异性较低,筛查宫颈癌假阳性率高[2,17-19]。同样TCT检测中非典型增生和轻度细胞学异常在年轻妇女中很常见,低度病变发展比率也不高。故以上2种方法在临床应用上存在一定的局限性,所以研究人员试图寻找更好的标记来检测早期宫颈癌。有研究发现,人类端粒酶RNA基因中,在长约450个碱基的人端粒酶RNA序列中,有一段长11个苷酸区域,发生在该模板区域的3号染色体长臂hTERC突变将导致端粒酶功能改变,从而出现染色体异常[20]。本试验采用FISH双色探针成功检测了hTERC基因扩增,子宫颈瘤变组hTERC基因的红色信号主要表现为3个或4~6个个而SCC中多出现10个TERC基因信号,在CINⅠ期以及SCC中的表达显著概予健康女性正常宫颈组织,随着CIN级别的增加、病变程度的升级,起阳性表达率与病变程度呈正相关。这说明端粒酶的异常激活可能发生在SCC的早期,随病变进展,端粒酶活性表达增高,提示端粒酶作为SCC的生物学标志,用于宫颈癌筛查和早期诊断是可行的。
2003年和2005年Heselmeyer-Haddad等[8,21]分别对TCT剩余液体子宫颈细胞涂片和以往保存的子宫颈涂片,采用FISH探针成功地进行hTERC基因检测,他们的研究发现,CINⅠ期中hTERC基因扩增者只占7.1%,而CIN Ⅱ期和CIN Ⅲ期占62.5%和76.4%,宫颈癌组中所有的细胞都出现了hTERC基因的扩增。本试验结果显示CINⅠ期中hTERC基因扩增只占63.7%。而CIN Ⅱ期占89.4%,CIN Ⅲ期及SCC组中所有细胞都出现了hTERC基因扩增。结果与Heselmeyer-Haddad等报道的趋势一致,但所占比例和hTERC基因扩增的异常细胞杂交信号类型有差别(图1)。本研究中CINⅠ期/CIN Ⅱ期、CIN Ⅲ期/SCC3q拷贝异常明显。且随拷贝数比例增加出现2∶3、2∶4、2∶5、3∶3、5∶5以上的杂交类型,推测CIN可能与染色体的高度不稳定性明显相关,hTERC基因异常拷贝数增加,可能是SC形成早期事件。由此可见,hTERC基因异常的染色体不稳定性可能是SCC前病变发展到SC的重要因素之一。此外,58例CINⅠ期涂片中异常细胞杂交信号一2∶3和2∶5型为主,随着CIN级别的升高3∶3、4∶4、5∶5等型号的信号比例上升,出现双色大于3的多倍体在CIN Ⅲ期中虽hTERC基因扩增率与SCC组的相同,但异常细胞占65.9%,低于SCC组涂片中的异常细胞(占90.7%)。故在临床中,对于病检hTERC出现阴性,但杂交信号2∶3和3∶3型以上的患者要予以严密随访,警惕SCC的发生。
本试验证明,用FISH 方法和特异的诊断探针检测hTERC基因扩增和染色体着丝粒的拷贝数,使染色体的非整体客观上可见,起弥补了TCT细胞学和HPV病毒检测指标的不足。检测hTERC基因可作为预测CINⅠ期/CIN Ⅱ期发展到CIN Ⅲ期/SCC的指标,为早期发现SCC前病变提供了有价值的生物遗传学监测标记。
[1]World Health Organization Reproductive Health and Research.Chronic Diseases and Health Promotion.Comprehensive Cervical Cancer Control:a guide to essential practice[R].Geneva:World Health Organization,2006:3-4.
[2]Chu LL,Weinstein S,Yee J.Colorectal cancer screening in women:an underutilized lifesaver[J].AJR Am J Roentgenol,2011,196(2):303-310.
[3]Jiang J,Wei LH,Li YL,et al.Detection of TERC amplification in cervical epithelial cells for the diagnosis of high-grade cervical lesions and invasive cancer[J].J Mol Diagn,2010,12(6):808-817.
[4]Qiu LP,Pan D,Xu WF,et al.Study on the carbapenemase genotype and molecular epidemiology of Acinetobacter baumannii[J].Zhonghua Liu Xing Bing Xue Za Zhi,2007,28(4):381-384.
[5]Azueta A,Gatius S,Matias-Guiu X.Endometrioid carcinoma of the endometrium: pathologic and molecular features[J].Semin Diagn Pathol,2010,27(4):226-240.
[6]Tierney B,Westin SN,Schlumbrecht MP,et al.Early cervical neoplasia: advances in screening and treatment modalities[J].Clin Adv Hematol Oncol,2010,8(8):547-555.
[7]Al-Mansour Z,Verschraegen C.Locally advanced cervical cancer:what is the standard of care? [J].Curr Opin Oncol,2010,22(5):503-512.
[8]Heselmyer-Haddad K,Janz V,Castle PE,et al.Detection of genomic amplification of the human telomerase gene (TERC)in cytologic specimens as a genetic test for the diagnosis of cervical dysplsia[J].Am J Pathol,2003,163(4):1405-1416.
[9]Tan YO,Han S,Lu YS,et al.The prevalence and assessment of ErbB2-positive breast cancer in Asia: a literature survey[J].Cancer,2010,116(23):5348-5357.
[10]Policht FA,Song M,Sitailo S,et al.Analysis of genetic copy number changes in cervical disease progression[J].BMC Cancer,2010,16(10):432-436.
[11]Garcia S,Panero JL,Siroky J,et al.Repeated reunions and splits feature the highly dynamic evolution of 5S and 35S ribosomal RNA genes (rDNA)in the Asteraceae family[J].BMC Plant Biol,2010,16(10):176-181.
[12]Rothenberg SM,Mohapatra G,Rivera MN,et al.A genome-wide screen for microdeletions reveals disruption of polarity complex genes in diverse human cancers[J].Cancer Res,2010,70(6):2158-2164.
[13]McNees CJ,Tejera AM,Martínez P,et al.ATR suppresses telomere fragility and recombination but is dispensable for elongation of short telomeres by telomerase[J].J Cell Biol,2010,188(5):639-652.
[14]Chen XS,Nie XQ,Chen CM,et al.Weekly paclitaxel plus carboplatin is an effective nonanthracycline-containing regimen as neoadjuvant chemotherapy for breast cancer[J].Ann Oncol,2010,21(5):961-967.
[15]Rippe V,Dittberner L,Lorenz VN,et al.The two stem cell micro RNA gene clusters C19MC and miR-371-3 are activated by specific chromosomal rearrangements in a subgroup of thyroid adenomas[J].PLoS One,2010,5(3):e9485.
[16]Van Roosbroeck K,Cools J,Dierickx D,et al.ALK-positive large B-cell lymphomas with cryptic SEC31A-ALK and NPM1-ALK fusions[J].Haematologica,2010,95(3):509-513.
[17]Zappacosta B,Romano L,Guerriero M,et al.Detection of 14 human papillomavirus genotypes in cervical samples in women from a central-southern area of Italy showing different Pap test results[J].New Microbiol,2009,32(4):351-358.
[18]Suh DS,Kim SC,An WG,et al.Differential apoptotic response in HPV-infected cancer cells of the uterine cervix after doxorubicin treatment[J].Oncol Rep,2010,23(3):751-756.
[19]Barnack JL,Reddy DM,Swain C.Predictors of parents' willingness to vaccinate for human papillomavirus and physicians' intentions to recommend the vaccine[J].Womens Health Issues,2010,20(1):28-34.
[20]Jády BE,Bertrand E,Kiss T.Human telomerase RNA and box H/ACA scaRNAs share a common Cajal body-specific localization signal[J].J Cell Biol,2004,164(5):647-652.
[21]Heselmeyer-Haddad K,Sommerfeld K,White NM,et al.Genomic amplification of the human telomerase gene (TERC)in pap smears predicts the development of cervical cancer[J].Am J Pathol,2005,166(4):1229-1238.
