HPLC法测定盐酸帕唑帕尼片含量和有关物质
2012-11-17赵玲赵春才杨博刘艳艳施琳
赵玲,赵春才,杨博,刘艳艳,施琳
(1.武汉工业学院生物与制药工程学院,武汉4 3 0 0 2 3;2.南京科瑞翔医药科技有限公司,南京 2 1 0 0 1 9;3.南京安格医药化工有限公司,南京 2 1 0 0 0 9)
HPLC法测定盐酸帕唑帕尼片含量和有关物质
赵玲1*,赵春才2,杨博3,刘艳艳2,施琳2
(1.武汉工业学院生物与制药工程学院,武汉4 3 0 0 2 3;2.南京科瑞翔医药科技有限公司,南京 2 1 0 0 1 9;3.南京安格医药化工有限公司,南京 2 1 0 0 0 9)
目的:建立测定盐酸帕唑帕尼片中主药和有关物质含量的方法。方法:采用高效液相色谱法。色谱柱为Kromasil C18,流动相为乙腈-0.0 2 mol·L-1醋酸铵缓冲液(3 5∶6 5),流速为1.0 mL·min-1,检测波长为2 6 8 nm,柱温为2 5℃,进样量为2 0 μL。结果:盐酸帕唑帕尼检测浓度线性范围为4 0.1 8~3 6 1.6μg·mL-1(r=0.9 9 99),检测限为2ng,平均回收率为9 9.6 0%,RSD=0.5 3%(n=9)。结论:该方法操作简便、快捷、准确、可靠,可用于盐酸帕唑帕尼片的质量控制。
盐酸帕唑帕尼片;有关物质;含量测定;高效液相色谱法
盐酸帕唑帕尼(Pazopanib hydrochloride,PH)是由葛兰素史克公司研制开发的第2代多靶点酪氨酸激酶抑制剂,商品名为Votrient,2 0 0 9年1 0月1 9日由美国FDA宣布批准上市,用于晚期肾癌的治疗[1]。目前其上市剂型有片剂,但该制剂的含量及有关物质测定国内未见文献报道。为此,笔者建立了测定PH片含量的高效液相色谱(HPLC)法,以为其质量评价和标准的建立提供科学依据。
1 仪器与试药
HPLC仪,包括LC-1 0 ATvp泵、SPD-1 0 Avp紫外检测器、N2 0 0 0色谱工作站、UV-2 4 0 1 PC紫外-可见分光光度计(日本Shimadzu公司)。
PH片(批号:1 1 0 3 2 2 1、1 1 0 3 2 2 2、1 1 0 3 2 2 3,规格:每片2 0 0 mg)、PH对照品(由批号为1 1 0 3 0 7的原料药精制而成,纯度:9 9.8 3%)及中间体Ⅰ[N-(2-氯嘧啶-4-基)-2,3-二甲基-2 H-吲哚-6-胺]、中间体Ⅱ[2,3-二甲基-N-(2-氯嘧啶-4-基)-N-甲基-2 H-吲哚-6-胺]均由南京科瑞翔医药科技有限公司提供;乙腈为色谱纯,其余试剂均为分析纯,水为超纯水。
2 方法与结果
2.1 色谱条件
色谱柱:Kromasil C18(2 5 0 mm×4.6 mm,5µm);流动相:乙腈-0.0 2 mol·L-1醋酸铵缓冲液(1.5 4 3 g醋酸铵,溶于1 0 0 0 mL水中)(3 5∶6 5),流速:1.0 mL·min-1;检测波长:2 6 8 nm;柱温:2 5℃;进样量:2 0 μL。
2.2 溶液的制备
2.2.1 供试品与对照品溶液。取PH片粉末适量,约相当于PH 2 0 mg,精密称定,置于1 0 0 mL量瓶中,用流动相溶解并稀释至刻度,过滤,取续滤液作为供试品溶液;另取PH对照品,同法用流动相溶解并制成0.2 mg·mL-1的溶液作为对照品溶液。
2.2.2 有关物质溶液。取PH片粉末适量,按“2.2.1”项下方法制成PH浓度为0.2 mg·mL-1的溶液作为供试液;取供试液适量,用流动相稀释制成2 μg·mL-1的溶液作为对照液。
2.3 系统适用性试验
精密量取“2.2.1”项下对照品、供试品溶液各2 0 μL,并以空白辅料的流动相溶液作为阴性对照,分别进样分析。结果,PH的理论板数为8 5 9 4,保留时间为8.4 0 2 min,峰形对称,详见图1。
2.4 线性关系与检测限考察
取PH对照品,用流动相溶解并稀释成浓度分别为4 0.1 8、1 2 0.5、2 0 0.9、2 8 1.3、3 6 1.6 μg·mL-1的溶液,分别精密量取上述溶液进样,记录色谱。以浓度(c)为横坐标,峰面积(A)为纵坐标进行线性回归,得回归方程为A=-2.5 2 49×1 04+2.4 6 15×1 04c(r=0.9 9 99,n=5)。结果表明,PH检测浓度的线性范围为4 0.1 8~3 6 1.6μg·mL-1。以信噪比S/N=3计算,得检测限为2 ng。
2.5 精密度试验
取对照品溶液连续进样6次,测定。结果,峰面积值RSD=0.2 7%。
2.6 重复性试验
精密称取同批样品6份,制备成供试品溶液,进样分析,测定每份样品的含量,结果平均含量为9 9.1 3%,RSD=0.3 0%,表明本方法重复性良好。
2.7 稳定性试验
取供试品溶液1份,在0、1、2、4、8 h时分别进样,结果以峰面积计算RSD=0.2 8%,表明供试品溶液在8 h内相对稳定。
2.8 回收率试验
取同批样品,按测试浓度的8 0%、1 0 0%、1 2 0%3个梯度分别加入PH对照品,进样分析,计算回收率,结果详见表1。
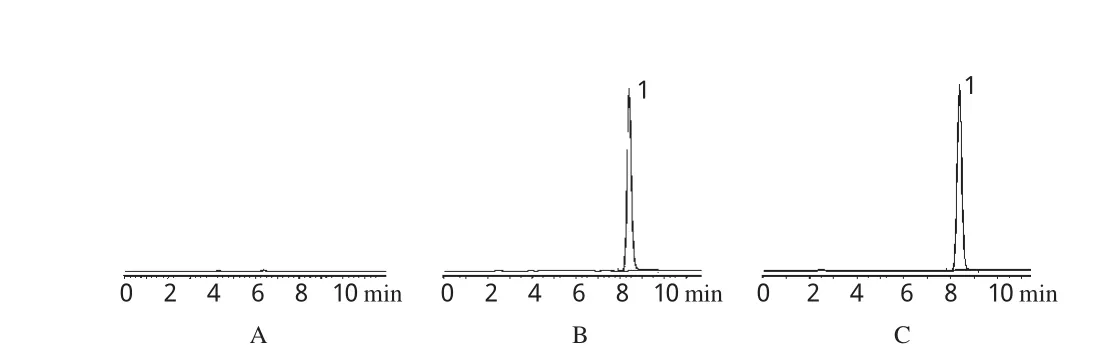
图1 系统适用性试验高效液相色谱图A.空白辅料;B.对照品;C.供试品;1.PHFig 1 HPLC chromatograms of system suitability test A.blank excipients;B.substance control;C.test sample;1.PH
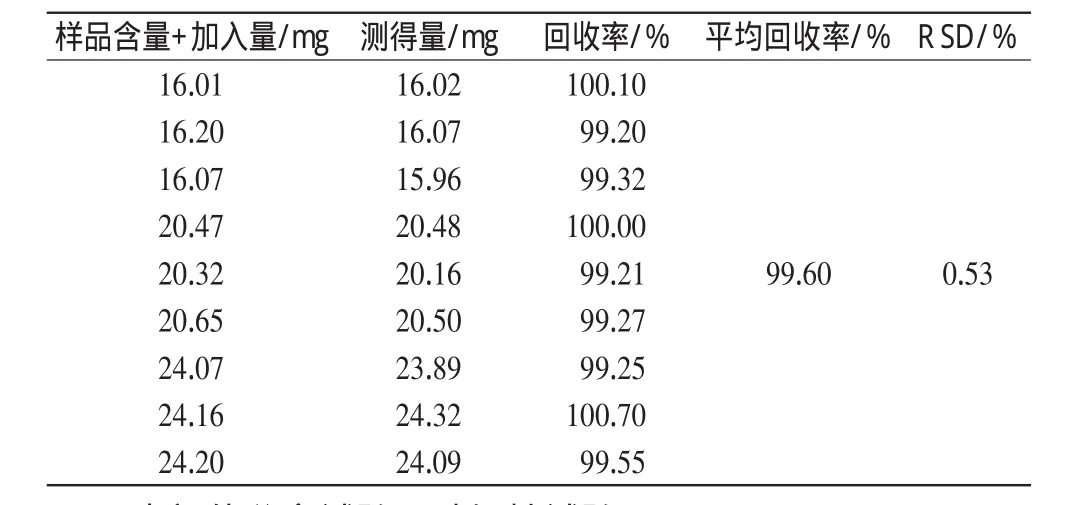
表1 回收率试验结果(n=9)Tab 1Results of recovery test(n=9)
2.9 中间体分离试验及破坏性试验
取PH对照品及中间体Ⅰ、Ⅱ用流动相制成每1 mL中含PH 2 0 0 μg、中间体Ⅰ2 0 μg、中间体Ⅱ2 0 μg的溶液,作为中间体分离试验的供试品溶液。另取PH片粉末(约相当于PH 1 mg)各3份,分别置于1 0 mL量瓶中,第1份加0.1 mol·L-1的盐酸1 mL;第2份加0.1 mol·L-1的氢氧化钠溶液1 mL;第3份加3%的双氧水1 mL。静置2 h后,第1份加0.1 mol·L-1的氢氧化钠溶液1 mL中和后,加流动相稀释至刻度,滤过,取续滤液作为酸破坏后的供试品溶液;第2份加0.1mol·L-1的盐酸1 mL中和后,加流动相稀释至刻度,滤过,取续滤液作为碱破坏后的供试品溶液;第3份加流动相稀释至刻度,滤过,取续滤液作为氧化破坏后的供试品溶液。取上述各供试品溶液进样分析,记录色谱图。结果各中间体的峰与主峰能完全分离,酸、碱破坏没有产生明显的降解产物,氧化破坏有明显的降解产物,且各降解产物都能与主成分完全分离。中间体分离及氧化破坏后溶液色谱图见图2。
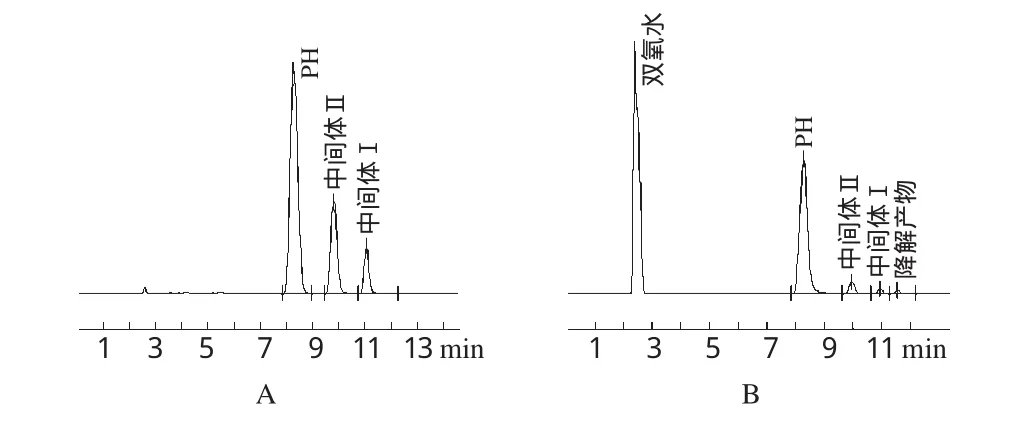
图2 中间体分离及氧化破坏试验高效液相色谱图A.中间体分离试验供试品;B.氧化破坏后供试品Fig 2 HPLC chromatograms of intermediate separation and destructive oxidation test A.test sample of intermediates separation test;B.test sample of destructive oxidation test
2.10 样品含量测定
主药含量的测定:取PH片粉末及PH对照品适量,按“2.2.1”项下方法分别制备成供试品、对照品溶液,分别进样,记录峰面积,并按外标法以峰面积计算含量。结果3批样品含量分别为9 9.1 3%、9 9.4 9%、9 8.9 4%。
有关物质含量的测定:取PH片粉末适量,按“2.2.2”项下方法制备成供试液和对照液。量取对照液2 0 μL注入色谱仪,调节仪器检测灵敏度,使PH峰的峰高为满量程的1 0%~3 0%;再量取供试液2 0 μL注入色谱仪,记录色谱至主峰保留时间的3倍,记录主峰和有关物质的峰面积,按1%自身对照法计算有关物质的含量。结果3批样品中有关物质含量分别为0.2 8%、0.3 3%、0.2 5%。
3 讨论
3.1 检测波长的选择
取PH对照品、供试品、中间体和辅料溶液,按紫外分光光度法[2]操作,于1 9 0~4 0 0 nm波长范围内进行扫描。结果,对照品、供试品溶液均于2 1 0、2 6 8、3 2 3 nm波长处有最大吸收,合成反应各步的中间体于2 6 8 nm波长处均有最大吸收,辅料溶液在此处无吸收,故检测波长选为2 6 8 nm。
3.2 流动相的选择
通过对PH、各中间体及破坏后样品的测定,发现以乙腈-0.0 2 mol·L-1醋酸铵缓冲液(3 5∶6 5)为流动相时,主成分峰形对称,与其有关物质、各步中间体和降解产物均能得到很好的分离。
综上所述,本方法操作简便、快捷、准确、可靠,可用于PH片的质量控制。
[1] FDA.FDA approves new treatment for advanced form of kidney cancer[EB/OL].http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm1 8 7 1 7 4.htm.2 0 0 9-1 0-1 9.2 0 1 1-0 8-1 4.
[2] 国家药典委员会.中华人民共和国药典(二部)[S].2 0 1 0年版.北京:中国医药科技出版社,2 0 1 0:附录ⅣA.
Content Determination of Main Component and Related Substances in Pazopanib Hydrochloride Tablets by HPLC
ZHAO Ling(School of Biology and Pharmaceutical Engineering,Wuhan Polytechnic University,Wuhan 4 3 0 0 2 3,China)
ZHAO Chun-cai,LIU Yan-yan,SHI Lin(Nanjing Keruixiang Pharmaceutical Co.,Ltd.,Nanjing 2 1 0 0 1 9,China)YANG Bo(Nanjing Ange Pharmaceutical Co.,Ltd.,Nanjing 2 1 0 0 0 9,China)
OBJECTIVE:To develop a method for the content determination of main component and related substances in Pazopanib hydrochloride tablets.METHODS:HPLC method was adopted.The determination was performed on Kromasil C18column with mobile phase composed of acetonitrile-0.0 2mol·L-1ammonium acetate solution(3 5∶6 5)at the flow rate of 1.0mL·min-1.The detection wavelength was set at 2 6 8nm at 2 5℃.The injection size was 2 0μL.RESULTS:The linear range of pazopanib hydrochloride was 4 0.1 8~3 6 1.6μg·mL-1(r=0.9 9 99).The detection limit was 2ng and average recovery rate was 9 9.6 0%(RSD=0.5 3%,n=9).CONCLUSION:The method is simple,rapid,accurate and reliable,and it is applicable for the quality control of Pazopanib hydrochloride tablets.
Pazopanib hydrochloride tablets;Related substance;Content determination;HPLC
R9 2 7.2
A
1 0 0 1-0 4 0 8(2 0 1 2)3 3-3 1 3 8-0 2
DOI1 0.6 0 3 9/j.issn.1 0 0 1-0 4 0 8.2 0 1 2.3 3.2 6
*讲师,博士。研究方向:天然药物化学、药物化学。电话:0 2 7-8 3 9 5 6 7 9 3。E-mail:zhaolingcpu@1 2 6.com
2 0 1 1-0 9-1 9
2 0 1 1-1 0-2 6)
