长期中等负荷运动对大鼠空间学习记忆及海马神经黏附分子的影响
2012-11-17袁琼嘉李垂坤李雪高丕明杨澎湃邓文骞王璐赵燕
袁琼嘉 李垂坤 李雪 高丕明 杨澎湃 邓文骞 王璐 赵燕
1 成都体育学院运动医学系(四川成都 610041)
2 成都学院体育学院
3 四川省骨科医院
学习记忆是大脑主要的高级神经功能之一,生物学机制十分复杂[1]。海马是学习记忆的重要部位,特别与空间认知功能有关,运动影响学习与记忆,也影 响 海 马 结 构[2,3]。神 经 细 胞 黏 附 分 子 (Neural Cell Adhesion Molecule,NCAM)是1976年由Rutishanser等在鸡视网膜及脑中发现的,是最早被鉴定和研究的细胞黏附分子。研究发现,NCAM不仅与突触结构维持、模式重建有密切关系[4],而且与神经元出芽密切相关,在促进神经突起生长方面扮演重要的角色[5]。Venero等[6]发现,在海马组织中NCAM和多聚唾液酸神经黏附分子(PSA-NCAM)对形成空间记忆有重要作用。而运动科学领域在这方面的报道较少。有研究[7]发现,1周小强度跑台运动能改善脑缺血再灌注大鼠空间学习和记忆能力。脑缺血再灌注后,NCAM表达可能参与了脑细胞的修复过程[8]。长期运动训练是否增强大鼠的空间学习记忆能力?本研究旨在探讨7周中等负荷游泳运动对大鼠空间学习记忆能力的影响及其与大鼠海马NCAM表达的关系。
1 材料与方法
1.1 动物分组和实验方案
4月龄雄性SPF级SD大鼠40只,体重(240±20)克,购于成都达硕生物科技有限公司,动物生产许可证CSXK(川)2008-24。分笼饲养,自由饮食,自然昼夜节律光照,动物室温度(26±2)℃,相对湿度50%~65%。
大鼠购进后,先适应性喂养1周,然后随机分为空白组(C组)和中等负荷运动组(E组)2组,用记号笔编号、标记,每组20只。C组自然喂养,不进行干预,7周后再随机分为空白对照组 (CN组)和水迷宫组(CM组)2组,每组10只。
E组进行中等负荷游泳训练[9]:玻璃游泳缸(150 cm×60 cm×100 cm),水深70 cm,水温(34±2)℃。大鼠每天游泳1次,6 d/周。第1次下水游10 min,此后逐日加5 min,至第2周末达60 min,第3周起每次游泳时间120min,维持这一运动负荷直至游满7周。7周后再随机分为运动组 (EN组)和运动+水迷宫训练组(EM组)2组,每组10只。每天训练前对所有动物进行称重并记录数据。
第7周末处死CN组和EN组大鼠,断头取脑,检测各指标。于7周后对CM组和EM组大鼠进行Morris水迷宫行为学训练和测试。
动物造模和Morris水迷宫检测在成都体育学院动物实验室完成,NCAM的Real-time PCR和Western blot测定分别在国家体育总局四川省运动医学重点实验室和四川大学华西临床医学院科技园完成。
1.2 Morris水迷宫行为学训练
7周后,CM组和EM组参照文献[10]进行Morris水迷宫(Morris Water Maze,淮北正华生物仪器设备有限公司生产)测试。不锈钢圆形水池直径150 cm,高60 cm,水中加入碳素墨水,水温控制在(32±2)℃。水池等分为4个象限。于第一象限内的固定位置放置一平台,高度45 cm,直径12 cm,没入水下2 cm。迷宫外的参照物保持固定。水池放在一间小屋中央,室内的门、窗、摄像头等构成视觉暗示。迷宫上方安装摄像机,并与计算机连接,自动录入小鼠游泳轨迹并进行分析。
实验前一天,将CM组和EM组大鼠放入水中自由游泳2 min,使其熟悉迷宫环境。正式实验采用经典Morris水迷宫行为学测试方法。测试程序包括定位航行实验和空间搜索实验两部分,平台设置在第一象限。
1.2.1 定位航行实验(Place Navigation)
用于训练和测量大鼠对水迷宫的学习和记忆能力。实验历时10天。每个象限边缘中点确定为入水点,将大鼠面向池壁放入池中,计算机监测并记录大鼠从入水开始寻找至找到并爬上平台所需的时间(逃避潜伏期)。如120 s内找不到平台,则将其在平台上放置10 s后再放回笼中,这时潜伏期记为120 s。训练时分别从4个象限的入水点入水,每次训练的入水点相同,训练顺序固定。每次训练每只大鼠从4个不同入水点训练的潜伏期的算术平均值作为该次的学习成绩。
1.2.2 空间搜索实验(Spatial Probe Test)
训练10天后检测大鼠对平台空间位置的记忆保持能力。在上述训练结束后拆除平台,然后在原位置将大鼠从各象限入水点面向池壁放入水中,记录60 s内大鼠穿越原有平台的次数。每只大鼠从4个不同入水点训练的穿越次数的算术平均值作为该次的学习成绩。
1.3 标本收集与处理
7周后,CN组和EN组断头取脑,将组织块置于冰上切割并剥离海马,分装入冷冻管中,迅速放入液氮中长期保存,以备用于总RNA提取及蛋白提取。
1.4 生化指标测定
1.4.1 Real-time PCR测定NCAM mRNA表达
取适量海马组织,按50~100 mg/ml Trizol剂量加入Trizol。Trizol法提取总RNA。测定RNA含量、纯度,经高压处理的0.1%DEPC水定量总RNA后,采用TaKaRa试 剂 盒 Prime ScriptTMReagent Kit(Perfect Real time)进行反转录得到cDNA,采用TaKaRa试剂盒SYBRPremix Dimer EraserTM(Perfect Real time)进行Real-time PCR。引物序列:NCAM (扩增长度171 bp) 上游:5′-AGG AGA AAT CAG CGT TGG AGA-3′,下游:5′-TTG TAG ATG GTG AGG GTA GAG GA-3′;β-actin(扩增长度99bp)上游:5′-CGTAAAGAC CTCTATGCCAAC A-3′,下游:5′-TAG GAG CCA GGG CAGTAATC-3′。反应结束后,分析PCR产物融解曲线,确定反应的特异性,并进行数据处理。
1.4.2 Western blot测定NCAM蛋白表达
借助NCAM抗体,检测海马NCAM表达。取少量海马组织,每克加入20 μl裂解液(含PMSF),置于冰上30 min,收集裂解液。裂解液进行蛋白定量后,煮沸5 min后12 000 r/min离心10 min去沉淀,进行SDSPAGE电泳,转移至硝酸纤维素薄膜、5%BSA室温封闭1 h后置于含1∶2 000稀释的一抗,振摇4℃,过夜。采用辣根过氧化物酶标记的二抗检测目标蛋白。
1.5 统计学分析
采用SPSS 17.0软件对数据进行统计分析,结果用均数±标准差 (±s)表示。CN组和EN组大鼠NCMA基因和蛋白表达差异比较,CM组和EM组大鼠平均逃避潜伏期、穿越次数差异比较采用t检验;多组间比较采用单因素方差分析(One-Way ANOVA);各组大鼠体重差异组间两两比较采用LSD法。检验水准α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 体重
表1显示,与CN组比较,EN组第5、7周末体重均显著低于CN组 (P<0.05);EM组第4、5、6、7周末体重显著低于CM组(P<0.01,P<0.05)。
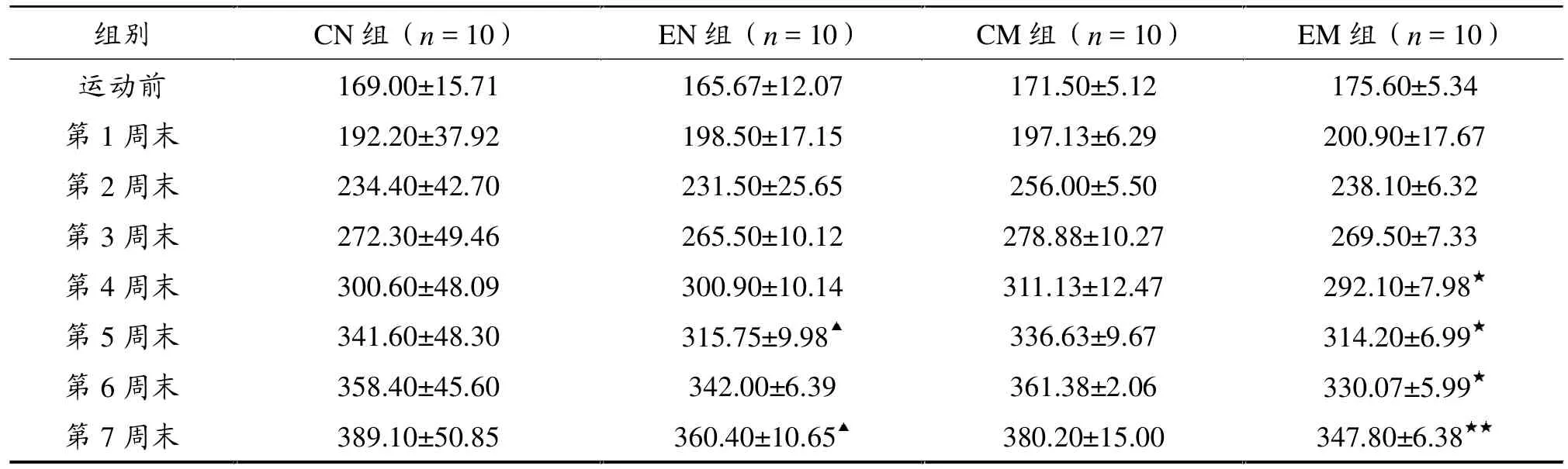
表1 各组大鼠体重变化比较(g)
2.2 Morris水迷宫检测结果
2.2.1 定位航行平均逃避潜伏期
由表2可知,实验期间,CM组和EM组大鼠平均逃避潜伏期逐渐缩短。第5天到第7天存在一定波动,但无显著性差异;第8天后趋于稳定。CM组第2~10天平均逃避潜伏期均显著低于第1天(P<0.01),第5~10天平均逃避潜伏期均显著低于第2天(P<0.01,P<0.05);EM组2~10天平均逃避潜伏期均显著低于第1天(P<0.01),第3~10天平均逃避潜伏期均显著低于第2天(P<0.01,P<0.05)。其余各天之间比较均无统计学意义(P>0.05),但逃避潜伏期逐渐缩短。每天内两组之间比较均无显著性差异(P>0.05)。

表2 CM组和EM组定位航行平均逃避潜伏期(s)比较
2.2.2 空间探索平均穿越次数检测结果
EM组平均穿越次数(1.33±0.14)显著多于CM组(0.50±0.25),P<0.05。
2.3 大鼠海马NCAM mRNA表达结果
2.3.1 标准曲线的建立和扩增效率分析
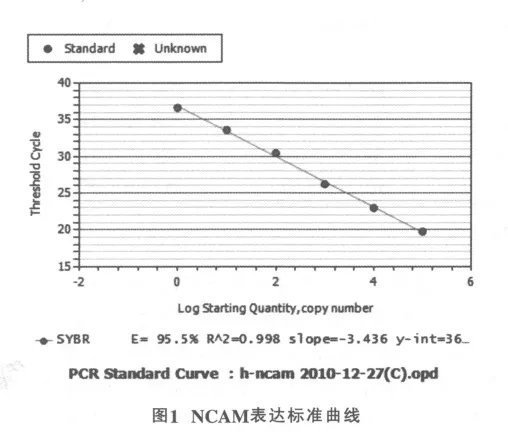
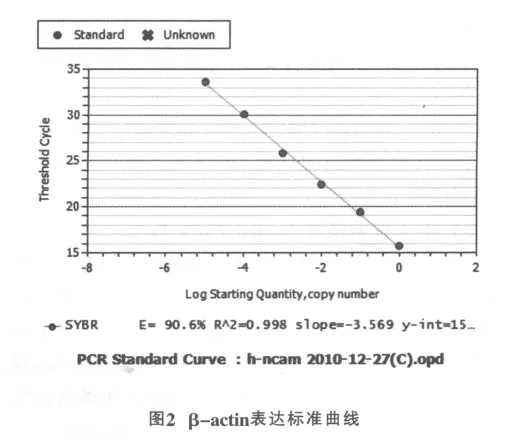
选反转录后任意一样品cDNA以10倍浓度梯度(1,10,102,103,104,105)稀释后为模板进行PCR扩增,利用CT值与稀释倍数关系做NCAM和β-actin标准曲线,观察相关系数(R2)或扩增效率(E)确定反应的可信度。利用NCAM和β-actin标准曲线获得R2和E,各引物均达到较理想的扩增效率,NCAM标准曲线的R2为0.998,E为95.5%(如图1),β-actin为标准曲线的R2为0.998,E为90.6%(如图2),目的基因与管家基因的E基本相同,用2-△△CT方法计算基因相对表达变化。
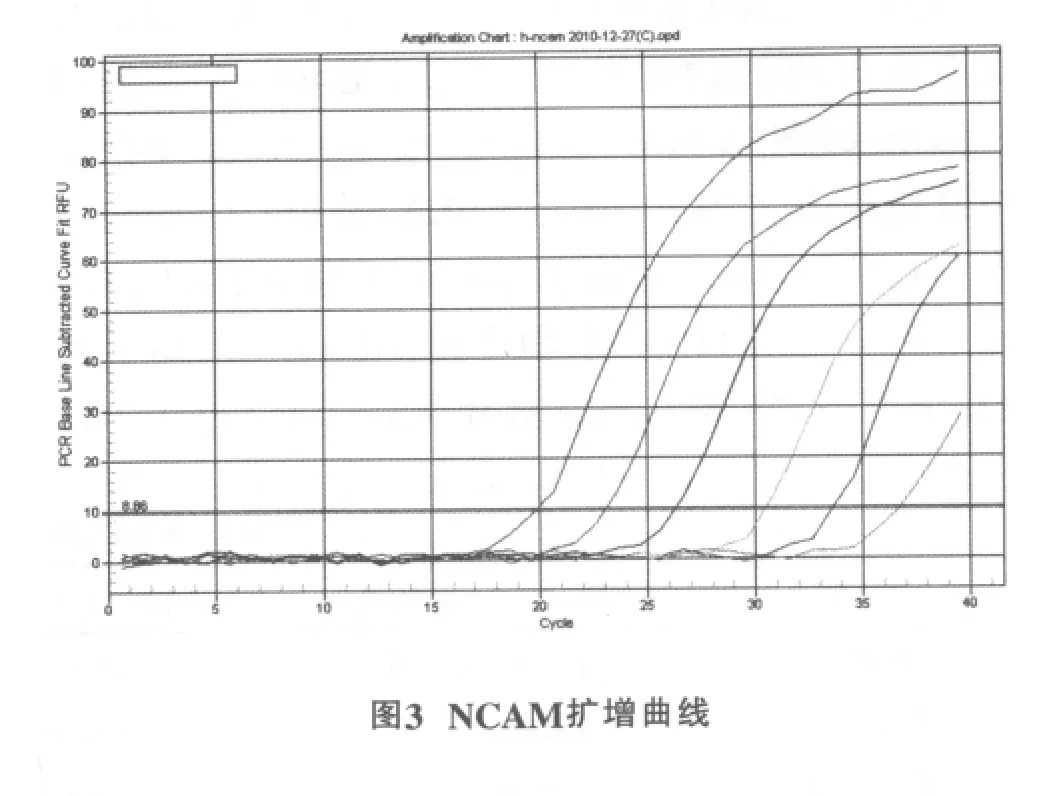
2.3.2 反应特异性分析
NCAM在83.60℃有特异峰 (图3),β-actin在82.99℃有特异峰(图4),各反应体系均为单一峰(图5),基线为9.03,起峰的循环数在10~35之间。这说明反应具有良好的特异性,无非特异性扩增或二聚体,荧光强度均来自特异性的扩增产物。
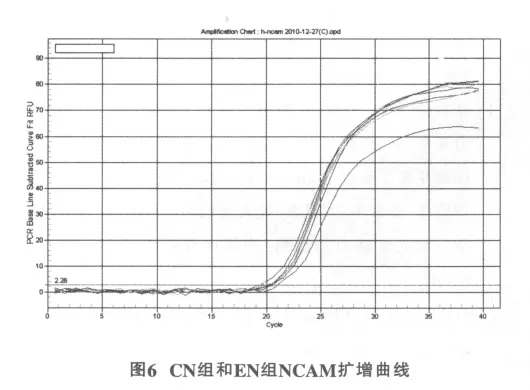
2.3.3 海马NCAM mRNA表达
EN组海马组织NCAM基因表达(1.03±0.05)高于C组(0.65±0.04),差异有统计学意义(P<0.01)(图6)。
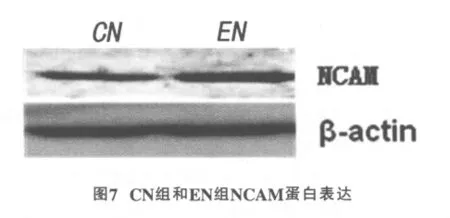
2.4 海马NCAM蛋白表达
EN组海马组织蛋白表达(0.55±0.02)高于CN组(0.27±0.01),差异有统计学意义(P<0.01)(图7)。
3 讨论
3.1 长期中等负荷运动对大鼠体重的影响
本实验结果显示,7周后大鼠体重虽有增长,但空白对照组增长量明显大于中等负荷运动组。这表明中等负荷运动抑制大鼠体重的增长速率,运动训练使大鼠代谢增加,体重增长缓慢,提示长时间中等负荷运动可以控制蛋白质和脂肪的合成速度。
3.2 游泳运动对大鼠空间学习记忆的影响
Morris水迷宫在神经生物学领域研究中被广泛应用,是较理想的测定动物空间学习记忆能力的行为实验模型[10]。本实验结果显示,随着Morris水迷宫训练时间延长,大鼠逃避潜伏期时间越来越短。第3~6天的逃避潜伏期有一定的波动,这可能是大鼠的学习进入泛化阶段,对空间的学习记忆不稳定;第7天以后逃避潜伏期趋于平稳,可能是大鼠的学习进入巩固和自动化阶段,提示Morris水迷宫训练可以提高大鼠的空间学习记忆能力。但EM组大鼠逃避潜伏期低于CM组,且更加稳定,并且其空间探索平均穿越次数也显著多于CM组,提示运动训练有利于提高EM组大鼠的学习记忆能力。这与国内外相关研究结果[11-14]一致。长期运动锻炼使脑内血流量增加、红细胞数目增多和血红蛋白含量增高,使脑组织细胞得到更多的氧,同时加快脑组织液流动,改善大脑内神经元之间的联系(如突触),从而促进学习记忆[15]。此外,运动还可改善大脑皮层神经活动过程的兴奋性、灵活性、均衡性和各中枢之间的协调性,有助于记忆能力和思维能力的提高[16]。
3.3 长期中等负荷运动对大鼠海马NCAM的影响
神经细胞黏附分子 (Neural Cell Adhesion Molecule,NCAM)是一类介导细胞与细胞、细胞与细胞外基质(Extracellularmatrix,ECM)之间黏附作用的膜表面糖蛋白。在胚胎发育期,NCAM在各胚层均有表达;而在出生后的动物中,NCAM表达主要集中在神经组织中,它在轴突的生长聚集、神经细胞的转移、神经纤维髓鞘的形成、神经通路的构建及信号的转导等方面具有非常重要的作用[17,18]。近期研究表明,NCAM不仅对学习记忆过程起重要作用,还与大脑发育、突触的可塑性及重塑有关[19]。
本实验结果表明,EN组大鼠海马组织NCAM基因和蛋白表达均显著高于CN组,提示长期适宜运动训练提高大鼠海马NCAM表达,改善大鼠学习记忆能力,但其潜在机理并不明了。临床研究表明,颅脑损伤后NCAM含量变化很大,并且间接反映颅脑损伤的严重程度[20,21]。 郑绪鹏等[22]研究认为,脑缺血再灌注后NCAM基因表达持续增加,对神经损伤修复过程可能起重要作用。杨华等[23]研究表明,行为训练对双侧海马梗死大鼠神经功能恢复及学习记忆能力起着重要的作用,其机制与海马NCAM的影响有关。
3.4 长期中等负荷运动对大鼠海马的影响及其机制
学习记忆是一个复杂过程。海马是脑内与学习记忆关系最密切的部位。突触可塑性是学习记忆的神经基础,突触可塑性包括结构可塑性和功能可塑性。NCAM的正常表达不仅是海马形态和功能发育的必需条件,还参与学习记忆过程中海马突触可塑性变化等重要的神经生理功能。突触传递长时程增强(Long-term Potentiaion,LTP)是突触可塑性的典型表现。研究表明,NCAM抗体可以干扰LTP形成。张辉等[24]研究发现,对血管性痴呆大鼠进行运动训练后,大鼠水迷宫逃避潜伏期明显缩短,说明其学习记忆功能有所改善,同时也可见LTP诱导增强。NCAM促进轴突生长的原因可能是其通过为神经细胞突起生长提供更具黏附性的基质,或者它们的相互作用启动了能刺激轴突延伸的细胞内信号[25]。对NCAM的研究有利于认识运动训练促进学习记忆分子的机制,今后还需深入探讨。
4 总结
7周中等负荷的游泳运动可以缩短大鼠的定位航行逃避潜伏期,提高大鼠空间探索穿越次数,提示长期的适宜运动有利于提高大鼠的空间学习记忆能力。
长期的中等负荷运动改善大鼠的空间学习记忆能力可能与其提高了NCAM基因和蛋白的表达,从而调节了某些信号分子和神经递质的释放有关,其具体机制还有待进一步的研究。
[1]Uysal N,Tugyan K,Kayatekin BM,et al.The effects of regular aerobic exercise in adolescent period on hippocampal neuron density,apoptosis and spatial memory.Neurosci Lett,2005,383(3),241-245.
[2]Taeko H,Satoru O,Kisou K.Jogging improved performance of a behavioral branching task implications for prefrontal activation.Neurosci Res,2004,49(3):325-337.
[3]Adlard PA,Perreau VM,Cesar CE,et al.The Time-course of induction of brain-derived neurotrophic factor mRNA and protein in the rat hippocampus following voluntary exercise.Neurosci Lett,2004,363(1):43-48.
[4]Johnson CP,Fujimoto I,Rutishauser U,et al.Direct evidence that neura1 cel1 adhesion molecule(NCAM)polysialylation increases intermembrane repulsion and abrogates adhesion.J Biol Chem,2005,280(1):137-145.
[5]Seidenfaden R,Krauter A,Schertzinger F,et al.Polysialic acid directs tumor cell growth by controlling heterophilic neural cell adhesion molecule interactions.Mol Cell Biol,2003,23(16):5908-5918.
[6]Venero C,Herrero AI,Touyarot K,et al.Hippocampal upregulation of NCAM expression and polysialylation plays a key role on spatial memory.Eur J Neurosci,2006,23(6):1585-1595.
[7]娄淑杰,陈秀恩,陈佩杰.跑台运动对脑缺血大鼠空间学习和记忆能力的影响.成都体育学院学报,2008,34(8):65-67.
[8]郑青立,李翔,张美增.脑缺血后神经细胞黏附分子和生长相关蛋白-43的表达与神经功能恢复的关系.中华物理医学与康复杂志,2005,27(8):464-467.
[9]朱全,浦钧宗.大鼠游泳训练在运动实验中的应用方法.中国运动医学杂志,1996,15(2):125-129.
[10]Morris RGM,Garrud P,Rawlines JNP,et al.Place navigation impaired in rats with hippocampallesions.Nature,1982,297:681-683.
[11]张春美,徐波,杨毅飞.游泳训练对大鼠空间学习记忆能力及海马、纹状体内c-fos、c-jun mRNA表达的影响.中国康复医学杂志,2008,23(8):724-728.
[12]刘瑾彦,娄淑杰,陈佩杰.跑台运动对不同月龄大鼠空间学习和记忆能力的影响.中国体育科技,2009,45(6):87-90.
[13]Lou SJ,Liu JY,Chang H,et al.Hippocampal neurogenesis and gene expression depend on exercise intensity in juvenile rats.Brain Res,2008,1210:48-55.
[14]史强,孟兆辉,徐波.跑台训练对大鼠海马IGF-1mRNA表达及学习和记忆能力的影响.西安体育学院学报,2010,27(5):599-602.
[15]Uysal N,Tugyan K,Kayatekin BM,et al.The effects of regular aerobic exercise in adolescent period on hippocampal neuron density apoptosis and spatialmemory.Neurosci Lett,2005,383:241-245.
[16]干芳媛.体育运动对老年痴呆症的预防及运动处方的制定.辽宁休育科技,2005,27(2):42-431.
[17]胡前胜,董胜璋,陈学敏.神经细胞黏附分子与学习记忆.卫生毒理学杂志,2003,2(17):119-121.
[18]Hansen RK,Christensen C,Korshunova I,et al.Identification of NACM binding peptides promoting neurite outgrowth via a heterotrimeric G-protein-coupled pathway.J Neurochem,2007,103(4):1396-1407.
[19]Kolkova K.Biosynthesis of NCAM.Adv Exp Med Biol,2010,663:213-225.
[20]Pedersen MV,Helweg-Larsen RB,Nielsen FC,et al.The syntheticNCAM-derived peptide,FGL,modulatesthe transcriptional response to traumatic brain injury.Neurosci Lett,2008,437(2):148-153.
[21]Jürgenson M,Aonurm-Helm A,Zharkovsky A.Behavioral profile of mice with impaired cognition in the elevated plus maze due to a deficiency in neural cell adhesion molecule.Pharmacol Biochem Behav,2010,96 (4):461-468.
[22]郑绪鹏,刘班,骆平.大鼠脑缺血再灌注后NCAM基因表达的变化.青岛大学医学院学报,2006,24(2):140-141.
[23]杨华,李玲,潘惠娟.行为训练对双侧海马梗死大鼠学习记忆与NCAM的影响.中华神经外科疾病研究杂志,2006,5(2):135-138.
[24]张辉,张昊昕,张朝东.运动训练对血管性痴呆大鼠认知障碍及长时程增强的影响.中国康复医学杂志,2007,22(1):21-23.
[25]肖成华,苗绘,杜霞,等.神经细胞黏附分子在正常老化大鼠黑质致密部多巴胺能神经细胞的表达.中国临床神经科学,2009,17(2):113-117.
