离心运动引起骨骼肌过度使用损伤机理研究
2012-11-17张学林高晓娟史冀鹏李俊平周越王瑞元
张学林 高晓娟 史冀鹏 李俊平 周越 王瑞元
1 曲阜师范大学体育科学学院(曲阜273165)
2 郑州大学体育系 3 东北师范大学体育学院
4 北京体育大学运动人体科学学院
过度使用损伤,英文通常用 “overuse injury”表示,是骨骼—肌肉系统(the musculoskeletal system)长期受到重复应力而无足够时间恢复造成慢性损伤(chronic injuries)的结果,包括肌肉、神经、肌腱、韧带、关节、软骨、血管和椎间盘多处部位劳损,通常感到疼痛、麻木、无力等症状[1]。过度使用损伤是常见的运动或职业骨骼—肌肉系统疾病,运动员及白领、蓝领工作者备受其害[2-5]。如何预防和治疗过度使用损伤一直是医学界关注的热点。虽然过度使用损伤是组织重复性微创伤造成的结果,但其机制仍不清楚。探讨过度使用损伤成因是防治的重要前提。
研究表明,骨骼肌由肌束膜把肌细胞、肌膜、基质膜、肌内膜、肌腱衔接在一起,构成一个张力复合体,其中肌束膜是传递张力的枢纽[6,7],且骨骼肌细胞内骨架蛋白具有感受膜外机械张力的能力,即当骨骼肌细胞受到外力牵张时,为避免肌细胞损伤,肌膜内骨架蛋白结构主动改变,顺应性增强,以缓解张力的变化[8]。如果改变的肌膜内骨架蛋白结构无充裕时间重新组装,势必将外来张力施加于肌束膜,造成肌束膜承受巨大的机械张力,致使肌束膜胶原纤维沉积,位于肌束膜以及周围的结缔组织内的神经、血管同样受到机械张力的影响而受损。这提示,骨骼肌细胞超微结构损伤累积与过度使用损伤发生存在联系。离心运动极易造成骨骼肌超微结构损伤[8],且通常采用下坡跑离心运动方式(动物跑台)造成的机体组织微创伤累积,建立骨骼—肌肉系统过度使用损伤动物模型[9,10],这为研究骨骼肌细胞超微结构损伤累积与骨骼—肌肉系统过度使用损伤之间的关系提供了研究基础。本实验通过建立下坡跑离心运动引起的骨骼肌过度使用损伤动物模型,研究骨骼肌细胞超微结构损伤累积对骨骼肌组织结构变化的影响,探讨骨骼肌细胞超微结构损伤累积与骨骼肌过度使用损伤之间的关系。
1 材料与方法
1.1 实验动物及饲养条件
健康雄性Sprague-Dawley大鼠12只,体重(220±6.9)g,由北京维通利华实验动物技术有限公司提供,生产许可证号:SCXK(京)2006-0009。于北京体育大学科研中心动物实验室饲养、训练,动物使用许可证号:SYXK(京)2008-0009。大鼠分笼饲养,每笼3~4只,环境温度21~22℃,12 h光照/12 h黑暗交替,自由饮食 (北京维通利华实验动物技术有限公司提供饲料)。大鼠训练之前在屏障式动物房适应环境1周,期间不对任何大鼠进行急性或耐力训练。
1.2 实验设计和运动训练方案
大鼠在动物跑台上进行下坡跑离心运动。
实验方案:大鼠适应环境1周后,随机分成安静对照组(C组)和训练组(TG组),每组6只。两组饲养条件相同。安静对照组不运动。训练组大鼠适应性训练1周,第1、2天跑台坡度0、16 m/min、10 min;第3、4天跑台坡度-5°、16 m/min、15 min; 第5天跑台坡度-10°、16 m/min、30 min; 第6、7天休息。 训练适应1周后,正式训练4周,每周训练5天,周六、周日休息。训练组每次训练结束后无干预恢复措施。
正式训练方案如下:第1周:跑台坡度-16°,跑速16 m/min,训练时间60 min。 第2周:训练1周后,大鼠适应了16 m/min的跑度,或因速度太慢跑不起来,第2周增加跑速至20 m/min,其他不变。第3周:既要保持慢速离心运动,又要防止大鼠适应性训练,以造成骨骼肌超微结构损伤累积。在坡度-16°时加大速度可能发生骨骼肌拉伤,而非轻度微损伤。故不增加速度和坡度,只增加时间至90 min。
1.3 标本取样
为避免急性训练对测试指标的影响,于第4周末次训练后36 h取材。大鼠称重,戊巴比妥钠(65 mg/kg)麻醉,冰浴(冰盘)下暴露后肢肌肉,取同侧股四头肌深层股中间肌(研究认为,下坡跑离心运动导致了深层慢肌纤维损伤[11]),快速去除多余的脂肪和结缔组织,再把股中间肌肌腹横切成三段,每段长5 mm,其中两段用冰浴(4℃)3%戊二醛(0.1 mol磷酸缓冲液稀释,pH 7.2)固定过夜,用于透射电子显微镜和扫描电子显微镜观察。另一段用液氮预冷的异戊烷快速冷冻,后放于-80℃超低温冰箱保存,用于三色染色法和免疫组化分析,观察骨骼肌结缔组织胶原纤维沉积变化和骨骼肌肌束膜、肌内膜胶原纤维浓度变化。
1.4 测试指标及方法
1.4.1 透射电子显微镜观察骨骼肌超微结构变化
取3%戊二醛固定的股中间肌,用0.1 mol磷酸缓冲液冲洗,后用1%锇酸(0.1 mol磷酸缓冲液)固定,再用0.1 mol磷酸缓冲液冲洗。冲洗后的肌肉样本进行丙酮系列脱水,环氧树脂Spurr包埋,在LEICAUC6I型切片机上纵切超薄切片,用醋酸双氧铀和柠檬酸铅双染色。采用JEM-1230透射电子显微镜观察全部6个样本骨骼肌的超微结构,包括线粒体结构和骨骼肌肌节结构。每个样本在放大6000倍下寻找损伤部位,随机选取10张放大15000倍拍摄的电子显微镜数码影像。采用Dennett等[12]的方法略作修改,用得分分值量化骨骼肌超微结构变化,数字大小表示结构变化的程度。评分标准为:肌膜下出现线粒体聚积且大小不一得1分;Z线水纹状、肌原纤维之间出现脂褐素或降解小体,符合其中任何一项得2分;线粒体肿胀、横跨两个Z线或呈晶格状,符合其中任何一项得3分。上述骨骼肌病理性超微结构变化得分分值在同一样本中可累加,由此得出骨骼肌超微结构变化分值。
1.4.2 透射电子显微镜观察骨骼肌肌膜和基质膜结合变化
样本处理同1.4.1。每个样本在放大6000倍下寻找2~4条相邻的肌纤维,随机选取10张放大60000倍下拍摄的电子显微镜数码影像,观察肌膜与基质膜的结合状态。采用JEM-1230透射电子显微镜观察全部6个样本骨骼肌肌膜和基质膜结合状态变化。
1.4.3 扫描电子显微镜观察骨骼肌神经、血管组织结构变化
取3%戊二醛固定的股中间肌,0.1 mol磷酸缓冲液冲洗,在液氮内垂直断裂,之后用1%锇酸(0.1 mol磷酸缓冲液)后固定,再用0.1 mol磷酸缓冲液冲洗。乙醇系列脱水,醋酸异戊酯置换,临界点干燥(HITACHI HCP-2),离子溅射(EIKO IB-3)后,采用扫描电子显微镜(HITACHI S-3400N)观察骨骼肌横断面胶原纤维沉积、神经结构和血管结构变化,以及纵断面胶原纤维结构变化。参考Dennett等[12]量化骨骼肌超微结构变化的标准,本实验自定骨骼肌神经、血管结构变化量化标准。采用得分分值量化非参数的骨骼肌神经和血管结构变化,数字大小表示结构变化程度,评分标准为:骨骼肌神经束结缔组织破坏、神经纤维形状变化,符合其中任何一项得2分;血管闭锁、纤维化得2分。上述骨骼肌神经和血管结构变化得分分值在同一样本中可累加,由此得出骨骼肌神经和血管结构变化分值。
1.4.4 Masson氏三色染色法观察骨骼肌胶原纤维沉积
Masson氏三色染色法是检测胶原纤维沉积的常用指标。取冻存的股中间肌,用冷冻超薄切片机(Leica,Nussloch,Germany) 于-22℃把样本横切成8 μm厚度的薄片,置于载玻片上。用丙酮固定10 min,去离子水冲洗,之后,严格按照Masson改良的三色染色法程序染色(K7298,IMEB,Inc),肌核染成黑色,肌纤维染成红色,胶原纤维染成蓝色。用奥林巴斯IX71倒置电子显微镜(日本),于10×20放大倍数下,选取每个样本4角和中央5个视野区域,用图像分析软件Image-Pro Plus 6.0量化骨骼肌胶原纤维沉积。
1.4.5 免疫组化方法染色观察骨骼肌collagenⅠ、collagenⅣ表达
取冻存的股中间肌,用冷冻超薄切片机(Leica,Nussloch,Germany)于-22℃把样本横切成8 μm厚度的薄片,置于载玻片上,风干大约30 min。用丙酮固定10 min后,磷酸缓冲液(10mM磷酸钠,pH7.5,0.9%氯化钠)冲洗3次,每次5 min,之后用甲醇稀释的3%H2O2孵育30 min,淬灭内源性过氧化物酶活性;再用5%山羊血清孵育20 min,纸巾去除多余的封闭血清;用兔多克隆抗体大鼠collagenⅠ、collagenⅣ一抗(1:200,Abcam)孵育2 h。安静对照组用磷酸缓冲液替代一抗,磷酸缓冲液冲洗3次,每次5 min,之后再用VECTASTAINABC(卵白素—生物素—过氧化物酶复合体法)试剂(Vectastain PK4001)孵育30 min,再用磷酸缓冲液冲洗3次,每次5 min。
3,3’-二氨基联苯胺 (3,3’-diaminobenzidine,DAB)过氧化物酶底物试剂盒显色 (Vectastain SK-4100)。严格按照试剂盒操作程序,滴加氯化镍,使collagenⅠ和collagenⅣ呈灰黑色显色,显色时间10 min,用水冲洗5 min,终止显色;用苏木素精液复染(Vectastain H-3404),肌核呈紫蓝色,显色30 s,用水冲洗直到无色;75%、85%、90%、95%(两次)、100%(两次)系列乙醇脱水,每个梯度2 min;二甲苯透明4次,每次2 min;风干后用封片剂(Vectastain H-5000)封片。
用奥林巴斯IX71倒置电子显微镜(日本)于10×20放大倍数下选取collagenⅠ和collagenⅣ免疫组化染色图片,每个样本取4角和中央5个视野区域,用图像分析软件Image-Pro Plus 6.0读取骨骼肌collagenⅠ、collagenⅣ光密度值,量化collagenⅠ和collagenⅣ表达。
1.5 统计学分析
所有数据用SPSS16.0统计软件包处理,数据用平均值±标准差(± s)表示,显著性水平为P<0.05。采用kruskal-Wallis H法分析比较C组与TG组两组骨骼肌组织结构差异;采用独立样本t检验比较C组与TG组两组骨骼肌胶原纤维沉积和collagenⅠ、collagenⅣ表达变化的统计学差异。
2 结果
2.1 骨骼肌超微结构变化
安静对照组骨骼肌细胞超微结构排列整齐 (图1A,白色箭头),线粒体规律地排列在Z线两侧(图2B,白色箭头),肌膜下线粒体聚积,但大小均一(图2A,白色箭头)。
训练组Z线水纹状、Z线断裂、肌浆网肿胀或空泡化(图1B,白色箭头);肌原纤维降解、间隙加宽,肌丝相互缠绕,且出现空泡现象(图2D),可能是降解的肌原纤维或细胞器;肌膜下线粒体聚积,大小不一,有巨大线粒体,也有非常小的线粒体(图2C,白色箭头),出现线粒体病理表现;肌纤维内线粒体肿胀、嵴稀少,与线粒体纵轴平行,或空泡化,横跨两个Z线,个别的线粒体出现类似晶格状形状,严重的线粒体结构异常(图2D,白色箭头)。表1显示,训练组骨骼肌细胞超微结构变化分值与安静对照组相比呈极显著性差异(P<0.001)。
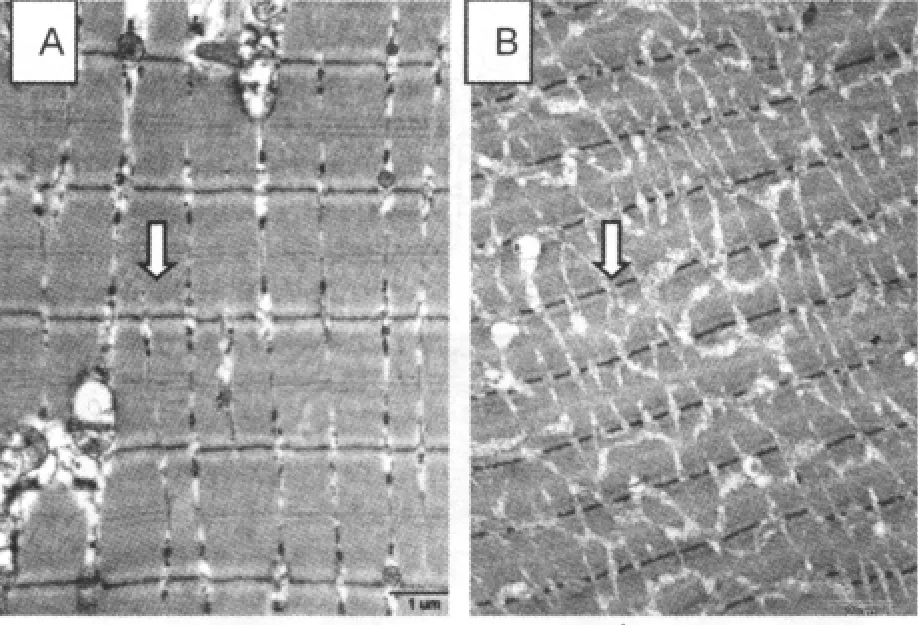
图1 透射电子显微镜观察两组骨骼肌超微结构变化

图2 透射电子显微镜观察两组骨骼肌超微结构变化
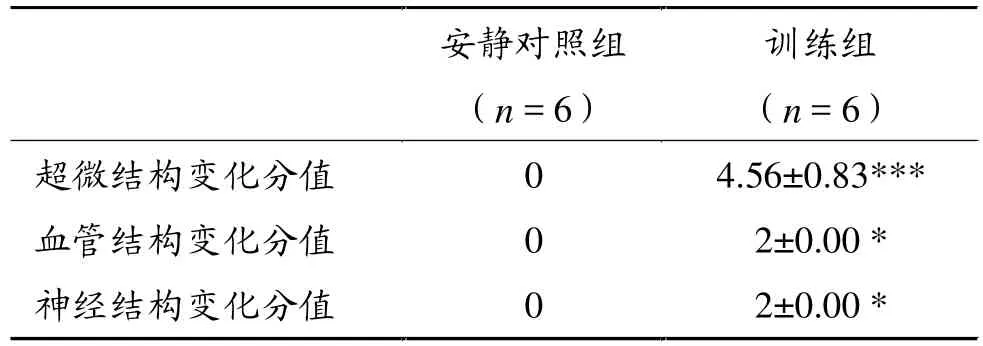
表1 两组骨骼肌组织结构变化分值比较
2.2 骨骼肌肌膜和基质膜结合变化
训练组骨骼肌相邻的两个肌细胞局部发现降解的肌原纤维和断裂的Z线,但观察全部6个样本,骨骼肌肌膜和基质膜未见分离(图3,白色箭头表示肌膜;黑色箭头表示基质膜)。这表明4周连续离心运动虽然造成骨骼肌细胞超微结构损伤累积,但肌膜和基质膜没有分离。
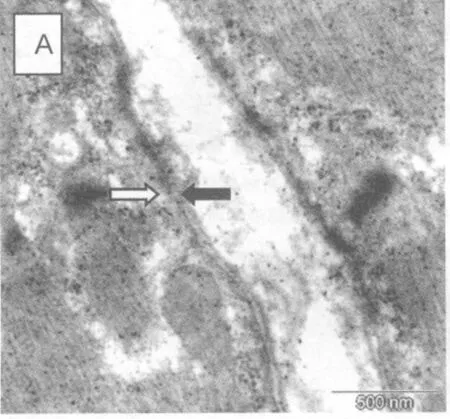
图3 训练组(A)骨骼肌肌膜与基质膜结合变化(标尺=500 nm)
2.3 骨骼肌神经和血管结构变化
安静对照组骨骼肌神经束膜结构完整,无胶原纤维增生(图4A,白色箭头),神经束内神经纤维排列整齐,呈圆柱体,中间为轴突,周围为髓鞘,结构完整,无挤压变形(图4A,白色星号)。训练组骨骼肌神经束结构变形,神经束膜周围被胶原纤维包围、纤维化(图4C,黑色箭头),神经束膜内神经纤维结构变形,轴突、髓鞘有被挤压的痕迹,轴突较安静对照组小,髓鞘变厚,呈不规则形状(图4C,白色星号)。训练组骨骼肌神经组织结构发生变化与安静对照组相比具有显著性差异(P<0.05),见表1中神经结构变化分值)。
安静对照组骨骼肌组织血管结构完整,血管壁和管腔清晰可见,无淤血,周围无胶原纤维增生(图4B,白色箭头)。训练组骨骼肌血管结构发生变化,血管周围胶原纤维增生,呈纤维化(图4D,黑色箭头),血管闭锁,血管壁皱缩,管腔被红细胞堵塞,可以清楚观察到呈圆盘状的红细胞(图4D,白色星号),与安静对照组比较呈显著性差异(P<0.05,表1中血管结构变化分值),表明血管严重受损。
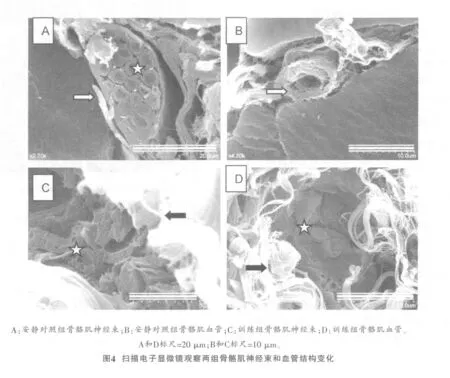
2.4 骨骼肌结缔组织胶原纤维增生变化
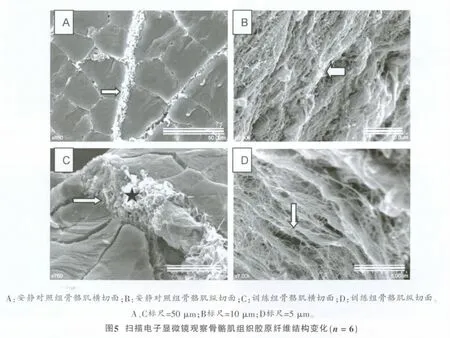
安静对照组骨骼肌横切面肌内膜和肌束膜厚度一致,胶原纤维排列整齐,粗细均匀,纹理清晰,胶原纤维束之间虽有胶原纤维丝交叉衔接,但有规律,无相互缠绕的零乱现象(图5A,白色箭头);纵切面肌束膜胶原纤维呈卷曲、波浪状,肌束膜内层网络胶原纤维层中胶原纤维走向清晰,相邻的胶原纤维丝无相互缠绕(图5B,白色箭头)。
表2显示,训练组骨骼肌结缔组织collagenⅠ和CollagenⅣ表达与安静对照组比较呈极显著性差异(P<0.001),横切面肌束膜局部厚度增加、增宽(图5C,白色箭头),肌束膜出现过度增生的胶原纤维(图5C,黑色星号),表明肌束膜胶原纤维沉积;纵切面肌束膜内层网络胶原纤维层中胶原纤维丝纹理凌乱,直径大小不一,出现许多极细小的胶原纤维丝,且相互缠绕,有明显增生症状(图5D,白色箭头)。
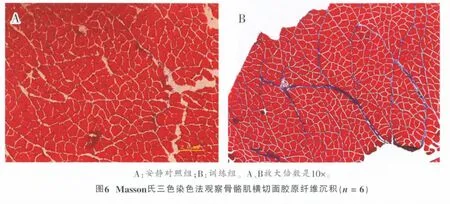
采用Masson氏三色染色法观察、量化骨骼肌结缔组织胶原纤维沉积变化 (图6),即肌纤维染成红色,胶原纤维染成蓝色,肌核染成黑色。安静对照组蓝色的胶原纤维面积小(图6A),训练组蓝色面积增加,且集中在肌束膜(图6B)。表2显示,训练组Masson氏三色染色胶原纤维沉积与安静对照组呈极显著性差异(P<0.001),与扫描电子显微镜观察结果吻合。
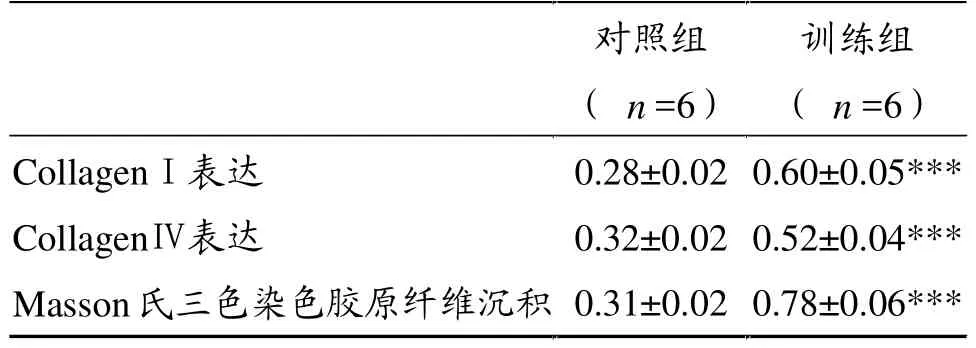
表2 两组大鼠Masson氏三色染色、collagenⅠ和collagenⅣ表达变化比较
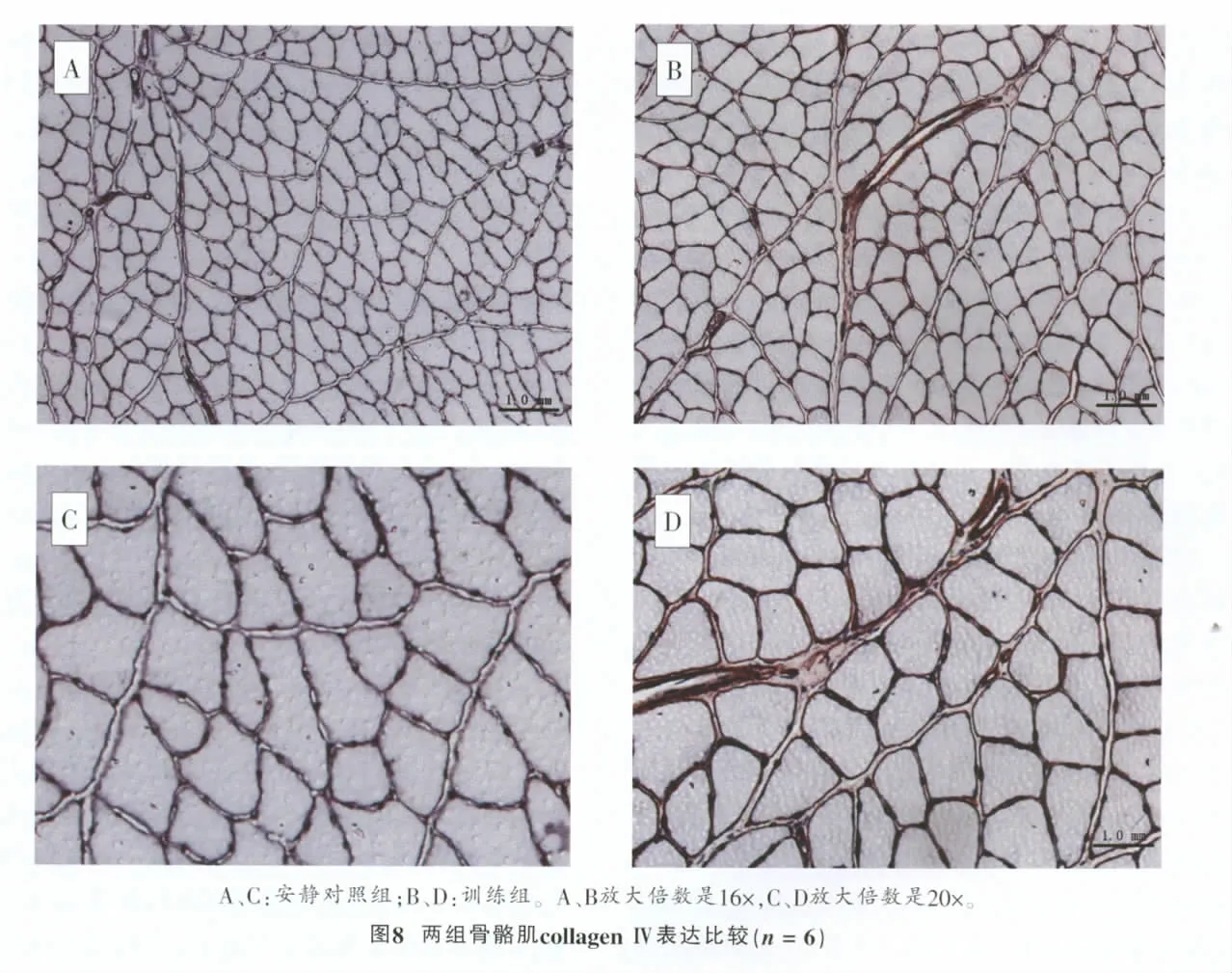
2.5 骨骼肌collagenⅠ、collagenⅣ表达变化
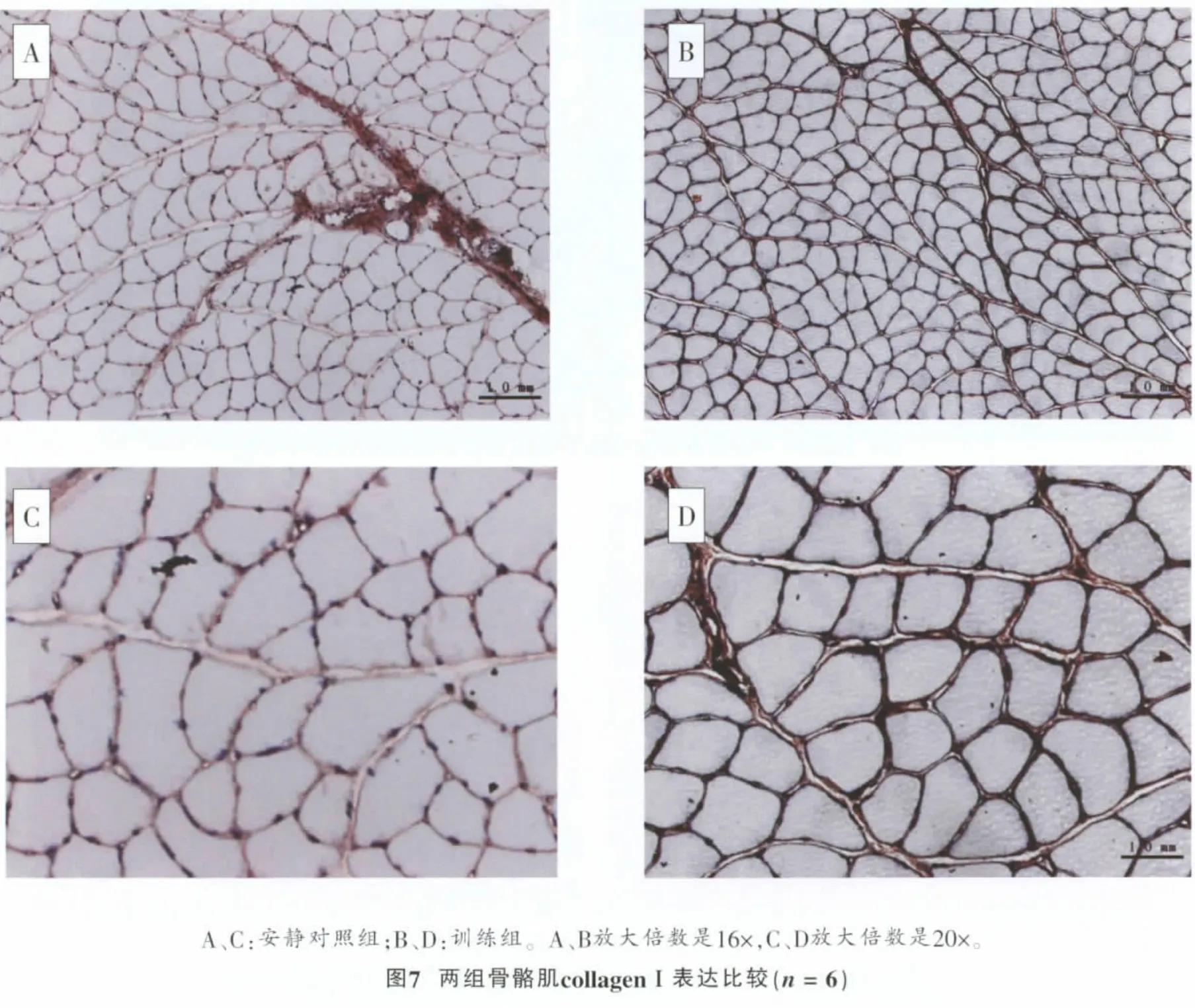
安静对照组骨骼肌collagenⅠ主要在肌束膜表达,肌内膜表达量很少。安静对照组肌束膜厚度一致,局部厚度无增加现象(图7A、C)。训练组大鼠骨骼肌collagenⅠ增生 (图7B、D),collagenⅠ主要位于骨骼肌肌束膜中,局部肌内膜中表达增加。若骨骼肌结缔组织损伤,collagenⅠ表达增加意味着结缔组织损伤修复或重塑。collagenⅠ表达变化反映了骨骼肌肌内膜、肌束膜损伤或重塑程度。从collagenⅠ免疫组化染色图片观察(图7B、D),训练组collagenⅠ在肌内膜尤其是肌束膜中表达大幅度增加,表明肌内膜尤其是肌束膜损伤较严重。表2显示,训练组collagenⅠ表达与安静对照组比较呈极显著性差异 (P<0.001)。
安静对照组CollagenⅣ主要分布于骨骼肌肌内膜。安静对照组肌内膜厚度一致,局部厚度无增加现象(图8A、C)。观察训练组骨骼肌collagenⅣ免疫组化图片(图8B、D),骨骼肌局部肌内膜厚度增加,表2显示,collagenⅣ表达与安静对照组比较,呈极显著性差异(P<0.001)。
3 讨论
3.1 建立长期下坡跑离心运动方式引起的骨骼肌过度使用损伤动物模型
过度使用损伤是机体组织重复性微创伤累积的结果。动物下坡跑(离心运动方式)能造成机体组织微创伤,且微创伤的组织恢复慢。因此,本实验采用大鼠长期下坡跑离心运动机械应激方式,通过改变运动时间和跑速,造成骨骼肌组织微创伤累积,建立骨骼肌过度使用损伤模型。
3.1.1 长期下坡跑离心运动机械应激与骨骼肌超微结构损伤累积
4周下坡跑导致训练组大鼠骨骼肌超微结构损伤,集中体现在肌节结构变化和线粒体结构变化:⑴肌节结构紊乱,Z线呈水纹状、断裂、消失现象,肌浆网肿胀、空泡化,肌原纤维间隙增加、降解;⑵肌膜下线粒体聚积,大小不一,有的线粒体很小,有的线粒体很大。肌纤维内线粒体结构异常,线粒体肿胀,嵴稀少甚至消失,出现空泡化、横跨两个Z线现象。这些症状与慢性骨骼肌劳损患者相似[12]。 Dennett和Fry[12]发现骨骼肌慢性疼痛劳损患者,骨骼肌肌原纤维降解,出现肌原纤维降解的电子密度小体(降解的肌原纤维被溶酶体自噬后的产物)以及线粒体异常,出现肌膜下线粒体聚集、肌原纤维内晶格状样线粒体。患有严重疲劳症状(表现为肌肉僵硬、无力、酸痛、获得性训练耐受能力下降、慢性疲劳等症状)的耐力项目竞技运动员骨骼肌也出现同样病理变化,Z线水纹状、肌原纤维降解、线粒体肿胀且横跨两个Z线、肌膜下线粒体聚积[13]。训练组骨骼肌超微结构变化症状表明,4周连续中等强度的下坡跑离心运动方式导致了大鼠骨骼肌超微结构损伤累积,呈现过度使用损伤症状。
3.1.2 长期下坡跑离心运动机械应激与骨骼肌神经和血管结构损伤累积
4周大鼠下坡跑导致训练组骨骼肌组织神经和血管结构发生变化。骨骼肌内神经束膜被破坏,胶原纤维增生、纤维化,且神经纤维圆柱体形状变形,轴突和髓鞘结构改变;骨骼肌组织内血管闭锁,血管壁皱缩,厚度增加,管腔变小,被红细胞堵塞,血管壁周围被胶原纤维包裹、纤维化。这些神经和血管异常现象同样出现在过度使用损伤动物模型和患有慢性骨骼肌疼痛患者的骨骼肌肉系统内。Clark等[14]采用过度使用损伤动物模型,发现腕管正中神经传导速度下降,炎症因子浸润,神经外膜束collagenⅠ过度沉积、纤维化。Larsson等[15]研究了骨骼肌结构变化与疼痛的关系,发现慢性斜方肌疼痛患者肌肉血流减少。本实验中,4周下坡跑离心运动导致骨骼肌神经结构变化,解释了Clark等[14]发现的过度使用损伤的骨骼肌肉系统神经速度下降的原因,这可能与运动造成骨骼肌神经束机械损伤有关,炎症反应的结果支持了此观点;血管结构变化也解释了Larsson等[15]发现的过度使用损伤骨骼肌患者骨骼肌内血流较少的原因,这是血管闭锁的原因,可能与运动导致骨骼肌血管机械损伤有关。研究发现,神经和血管极易受到机械损伤,过度使用损伤骨骼肌神经和血管是机械损伤的结果。损伤的神经和血管导致炎症因子浸润和结缔组织生长因子 (connective tissue growth factor,CTGF)表达增加。CTGF调节了成纤维细胞增生,过多的CTGF使成纤维细胞过度增生,进而造成collagenⅠ过度增加[14]。本实验依据在神经束和血管周围沉积的胶原纤维粗大的纤维特征[7],确定其是collagenⅠ。这表明4周连续中等强度下坡跑离心运动导致骨骼肌神经和血管结构严重损伤,胶原纤维沉积、纤维化。
3.1.3 长期下坡跑离心运动机械应激与骨骼肌结缔组织损伤累积
骨骼肌结缔组织变化集中体现在肌内膜,尤其是肌束膜胶原纤维过度沉积。4周大鼠下坡跑导致训练组骨骼肌结缔组织胶原纤维增生,肌内膜虽有胶原纤维增生,但主要集中在肌束膜。肌束膜厚度增加,胶原纤维丝凌乱,相互缠绕,直径粗大的纤维中掺杂着许多细小的胶原纤维丝,表明胶原纤维过度增生。Stauber等[16]于大鼠麻醉状态下电刺激跖肌时,在大鼠踝关节正常移动范围内强行牵拉后肢背侧的主动收缩肌,4周后肌内膜、肌束膜厚度增加,胶原纤维沉积,肌细胞死亡,被胶原纤维替代,呈纤维化症状。本研究结果与上述研究相似但略有不同,这与动物模型不一样有关。Stauber等[16]采用麻醉状态下被动牵拉大鼠骨骼肌,本实验让大鼠进行跑台离心运动,是主动运动。被动牵拉大鼠时,被牵拉的骨骼肌募集少量肌纤维参与收缩,导致局部肌纤维损伤严重;大鼠主动参与离心运动时,可以募集更多肌纤维参与运动,避免因局部肌纤维过度运动导致损伤[17]。Crameri等[17]的研究支持了此观点,作者采用等动测试仪,让受试者一侧股四头肌主动进行210次最大离心收缩(随意收缩),另一侧股四头肌被电刺激(300 μs;35 Hz;300 mA)进行210次最大离心收缩(不随意收缩),运动后24 h,电刺激腿的股四头肌超微结构比随意收缩腿股四头肌损伤更大。
本实验中,训练组大鼠4周下坡跑离心运动后骨骼肌超微结构损伤累积,表现为肌原纤维降解、线粒体肿胀;神经和血管结构损伤、纤维化;肌束膜厚度增加,胶原纤维沉积。这些变化与过度使用损伤骨骼肌症状相同,表明长期下坡跑离心运动性骨骼肌过度使用损伤动物模型建立。目前,诸多学者采用大鼠下坡跑离心运动建立骨骼肌肉系统过度使用损伤模型。 Archambault等[18]让SD大鼠进行4周下坡跑离心运动(动物跑台,坡度10%、17 m/min、1 h/day),成功建立了大鼠冈上肌肌腱过度使用损伤模型。Ng等[19]通过悬吊SD大鼠前肢,强迫后肢在跑台运动8周(动物跑台,-20°、17 m/min、1 h/day), 成功建立了大鼠跟腱过度使用损伤模型。本实验采用的长期下坡跑建立大鼠骨骼肌过度使用损伤模型与上述研究方法相符。
3.2 长期下坡跑离心运动机械应激与骨骼肌过度使用损伤的发生机制
4周大鼠下坡跑离心运动造成骨骼肌过度使用损伤症状包括:①骨骼肌超微结构损伤累积;②肌束膜纤维化;③骨骼肌神经、血管纤维化。分析这些损伤症状之间的因果关系,是解决骨骼肌过度使用损伤发生机制的关键。
3.2.1 骨骼肌细胞内超微结构、细胞外结缔组织结构变化与肌膜完整性的关系
本实验观察发现,4周下坡跑离心运动后大鼠骨骼肌肌膜与基质膜没有分离。研究表明,collagenⅣ主要位于肌内膜内层的网状层,是基质膜的主要成分[7]。通过免疫组化染色技术,发现染色的肌内膜轮廓清晰、边缘光滑,无死亡细胞出现。这证实4周大鼠下坡跑离心运动导致骨骼肌细胞内超微结构损伤累积、骨骼肌细胞外胶原纤维沉积,但肌膜与基质膜未分离,即肌膜无损伤。其他学者研究大强度离心运动后骨骼肌肌膜完整性时,发现了同样现象。Piitulainen等[20]研究了一次大强度离心运动对骨骼肌肌膜完整性的影响,让受试者在特殊的雪橇功率仪上进行单腿跳跃运动 (stretch-shortening cycle,SSC)至力竭,同样发现未破坏肌膜完整性。Costa等[21]研究了长期大强度离心运动对骨骼肌肌膜完整性的影响,让未受过训练的男性受试者进行连续6天、每天6组、每组15次的最大下肢离心收缩运动,采用免疫组化染色分析骨骼肌纤连蛋白(fibronectin)和结蛋白(desmin)以及肌膜损伤程度,发现长期大强度离心运动后肌膜的完整性不受影响。通常认为离心运动高机械张力导致骨骼肌细胞超微结构损伤,但高机械张力在使肌细胞内超微结构受损的同时,也会撕裂肌膜和基质膜,而事实并非如此。这提示,单独的机械张力学说不能解释骨骼肌细胞超微结构损伤而肌膜未受损伤的矛盾现象。研究表明,骨骼肌肌节属动态结构,能感受细胞外张力变化,及时调节肌节形态以适应机械应激环境的需要[22-24],负责把肌膜外机械张力以机械信号形式传递至肌膜内,使肌节结构变化的因子是跨膜蛋白整合素 (alpha7beta1-integrin)[8]。 同时,骨骼肌受到不习惯机械张力应激后,骨骼肌细胞外结缔组织结构发生变化,是为了防止骨骼肌再次受到机械损伤的风险[25]。这提示,骨骼肌受到不习惯的急性或慢性机械应激时,肌细胞内外结构能及时调整以免肌节撕裂而损伤肌膜。这解释了大鼠长期下坡跑离心运动后骨骼肌细胞超微结构损伤累积而肌膜未损伤的原因。
3.2.2 骨骼肌超微结构损伤累积、肌束膜胶原纤维沉积和神经、血管纤维化三者之间的关系
肌细胞内骨架蛋白具有机械张力感受器功能,能改变结构避免肌膜损伤。同时研究表明,骨骼肌肌节、肌膜、基质是一个有机的张力复合体,通过骨骼肌细胞内骨架蛋白和基质结构框架产生的预张力维持。因此,肌节张力复合体的稳定性受制于肌细胞内骨架蛋白和基质细胞外基质框架形成的预张力。张力复合体的任一环节 (细胞外基质或肌细胞内骨架蛋白)预张力受到破坏,都通过肌膜信号通路改变另一环节(肌膜内骨架蛋白或细胞外基质结构)的预张力,以维持张力复合体的张力稳定性[8]。长期下坡跑离心运动时,持续的肌细胞内骨架蛋白结构变化导致肌膜重塑,产生相应的顺应性以缓解外力,进而稳定张力复合体;同时,肌细胞和肌膜的顺应性增加会把外来张力重压给肌束膜,造成肌束膜承受巨大的外力,反复张力同样造成肌束膜损伤累积。本研究证实了此观点,扫描电镜观察发现,训练组肌束膜出现许多细小纤维丝,胶原纤维丝之间相互缠绕,表明肌束膜承受外力增加导致胶原纤维结构紊乱、胶原纤维增生、沉积。通过免疫组化染色,训练组骨骼肌collagenⅠ表达显著增加,且肌束膜中主要是collagenⅠ,也证实了扫描电镜的结果。另研究表明,肌束膜通过连接板(perimysial junctional plate)与肌内膜结合、通过蜂窝状(honeycomb structures)管状结构与肌腱结合,把骨骼肌组织连结为一个整体,能横向传递肌节的收缩张力至肌腱[6,7]。 Ramaswamy等[26]研究了骨骼肌结缔组织传递张力的机制,发现肌节收缩产生的张力能通过位于肋状体(costameres)的DGC(the dystrophin-associated glycoprotein complex)横向传递至肌内膜,进而通过肌内膜、肌束膜、肌外膜把张力传递至肌腱。然而,骨骼肌受到不习惯的机械张力应激时,在骨骼肌超微结构变化的同时,DGC复合体dystrophin极易丢失[27],骨骼肌横向传递张力机制受损[26]。4周训练组骨骼肌肌束膜collagenⅠ过度增生,表明随着骨骼肌超微结构损伤加剧,可能由于dystrophin的丢失,加剧了肌束膜横向传递肌节收缩张力的程度,进而造成肌束膜损伤并过度纤维化。Hinz[28]的研究也支持了此观点,骨骼肌结缔组织损伤能激活成纤维细胞,增加胶原纤维表达量,但结缔组织过度损伤将过度激活成纤维细胞,导致胶原纤维过度增生。另有研究表明,离心运动导致骨骼肌结缔组织损伤[29]。概括骨骼肌超微结构损伤累积、肌束膜胶原纤维沉积和神经、血管纤维化三者之间的关系,为了保护肌膜免受机械损伤,长期下坡跑离心运动时,骨骼肌细胞超微结构长期处于变化之中,造成骨骼肌超微结构损伤累积,导致肌束膜横向传递肌节收缩张力的程度增加,引起肌束膜损伤累积,诱发成纤维细胞过度激活,出现胶原纤维沉积。由于肌束膜含有丰富的血管和神经纤维,肌束膜纤维化增加了其机械张力,继而使分布于其间的血管、神经受到过度的机械张力,使骨骼肌神经、血管损伤过度纤维化。这表明骨骼肌细胞超微结构损伤累积导致了离心运动性骨骼肌过度使用损伤症状发生。
4 总结
长期下坡跑离心运动引起骨骼肌过度使用损伤,症状表现为骨骼肌超微结构损伤累积,骨骼肌肌束膜、神经以及血管纤维化,而肌膜保持了较好的完整性。提示骨骼肌过度使用时,为了保护肌膜免受损伤,骨骼肌长期超微结构改变致使其损伤累积,诱发肌束膜横向传递肌节收缩张力的程度增加,致使肌束膜损伤过度纤维化,使得分布于其间的神经、血管受到过度的机械张力损伤纤维化。因此,骨骼肌细胞超微结构损伤累积与过度使用损伤发生存在因果联系。
[1]Barbe MF,Barr AE,Gorzelany I,et al.Chronic repetitive reaching and grasping results in decreased motor performance and widespread tissue responses in a rat model of MSD.J Orthop Res,2003,21(1):167-176.
[2]Nordander C,Ohlsson K,Akesson I,etal.Risk of musculoskeletal disorders among females and males in repetitive/constrained work.Ergonomics,2009,52 (10):1226-1239.
[3]Maffulli N,Longo UG,Spiezia F,et al.Aetiology and prevention of injuries in elite young athletes.Med Sport Sci,2011,56:187-200.
[4]Abrams GD,Renstrom PA,Safran MR.Epidemiology of musculoskeletal injury in the tennis player.Br J Sports Med,2012,46(7):492-498.
[5]Yang J,Tibbetts AS,Covassin T,et al.Epidemiology ofoveruse and acute injuries among competitive collegiate athletes.J Athl Train,2012,47(2):198-204.
[6]Passerieux E,Rossignol R,Chopard A,et al.Structural organization of the perimysiμm in bovine skeletal muscle:Junctional plates and associated intracellular subdomains.J Struct Biol,2006,154(2):206-216.
[7]Passerieux E,Rossignol R,Letellier T,et al.Physical continuity of the perimysiμm from myofibers to tendons:involvement in lateralforcetransmission in skeletal muscle.J Struct Biol,2007,159(1):19-28.
[8]张祥,张学林,许寿生.运动与骨骼肌结构变化.中国运动医学杂志,2010,29(1):109-113.
[9]Dirks RC,Warden SJ.Models for the study of tendinopathy.J Musculoskelet Neuronal Interact,2011,11(2):141-149.
[10]Warden SJ.Animal models for the study of tendinopathy.Br J Sports Med,2007,41(4):232-40.
[11]Armstrong RB,Ogilvie RW,Schwane JA.Eccentric exercise-induced injury to rat skeletal muscle.J Appl Physiol,1983,54(1):80-93.
[12]Dennett X,Fry HJ.Overuse syndrome:a muscle biopsy study.Lancet,1988,1(8591):905-908.
[13]Grobler LA,Collins M,Lambert MI,et al.Skeletal muscle pathology in endurance athletes with acquired training intolerance.Br J Sports Med,2004,38(6):697-703.
[14]Clark BD,Barr AE,Safadi FF,et al.Median nerve traμma in a rat model of work-related musculoskeletal disorder.J Neurotraμma,2003,20(7):681-695.
[15]Larsson SE,Bodegrd L,Henriksson KG,et al.Chronic trapezius myalgia.Morphology and blood flow studied in 17 patients.Acta Orthop Scand,1990,61(5):394-398.
[16]Stauber WT,Knack KK,Miller GR,et al.Fibrosis and intercellular collagen connections from four weeks of muscle strains.Muscle Nerve,1996,19(4):423-430.
[17]CrameriRM,Aagaard P,Qvortrup K,etal.Myofibre damage in hμman skeletal muscle: effects of electrical stimulation versus voluntary contraction.J Physiol,2007,583(1):365-380.
[18]Archambault JM,Jelinsky SA,Lake SP,et al.Rat supraspinatus tendon expresses cartilage markers with overuse.J Orthop Res,2007,25(5):617-624.
[19]Ng GY,Chung PY,Wang JS,et al.Enforced bipedal downhill running induces Achilles tendinosis in rats.Connect Tissue Res,2011,52(6):466-471.
[20]Piitulainen H,KivR,Komi P,et al.Molecular adaptations of voltage-gated sodium ion channel related proteins after fatiguing stretch-shortening cycle exercise.Scand J Med Sci Sports,2008,18(5):636-642.
[21]Costa A,Orosz Z,Apor P,et al.Impact of repeated bouts of eccentric exercise on sarcolemma disruption in human skeletal muscle.Acta Physiol Hung,2009,96 (2):189-202.
[22]Lange S,Ehler E,Gautel M.From A to Z and back?Multicompartment proteins in the sarcomere.Trends Cell Biol,2006,16(1):11-18.
[23]Agarkova I,Perriard JC.The M-band:an elastic web that crosslinks thick filaments in the center of the arcomere.Trends Cell Biol,2005,15(9):477-485.
[24]Puchner EM,Alexandrovich A,Kho AL,et al.Mechanoenzymatics of titin kinase.Proc Natl Acad Sci U S A,2008,105(36):13385-13390.
[25]Mackey AL,Brandstetter S,Schjerling P,et al.Sequenced response of extracellular matrix deadhesion and fibrotic regulators after muscle damage is involved in protection against future injury in human skeletal muscle.FASEB J,2011,25(6):1943-1959.
[26]Ramaswamy KS,Palmer ML,van der Meulen JH,et al.Lateral transmission of force is impaired in skeletal muscles of dystrophic mice and very old rats.J Physiol,2011,589(Pt 5):1195-208.
[27]Zhang BT,Whitehead NP,Gervasio OL,et al.Pathways of Ca2+entry and cytoskeletal damage following eccentric contractions in mouse skeletal muscle.J Appl Physiol,2012,112(12):2077-86.
[28]Hinz B.Formation and function of the myofibroblast during tissue repair.J Invest Dermatol,2007,127(3):526-537.
[29]Kjaer M.Role of extracellular matrix in adaptation of tendon and skeletal muscle to mechanical loading.Physiol Rev,2004,84(2):649-698.
