急性心肌梗死患者全身与局部血浆组织蛋白酶抑制素水平的变化*
2012-11-16赵汉军颜红兵李文铮刘臣陈艺周鹏赵博迟云鹏王韶屏宋莉
赵汉军,颜红兵,李文铮,刘臣,陈艺,周鹏,赵博,迟云鹏,王韶屏,宋莉
已有研究表明动脉粥样硬化的发生、发展乃至血栓形成都有炎症机制参与[1,2]。某些炎性标记物如 C-反应蛋白(CRP)的血液水平可用于评估冠状动脉(冠脉)粥样硬化性心脏病(CAD)的风险分层[3,4]。但血样中炎性标记物的全身水平并不总是和局部血管(罪犯血管)中水平相一致[3]。如急性心肌梗死(AMI)时局部血管(斑块破裂部位)类淀粉样蛋白水平高于全身(主动脉),而C-反应蛋白水平则降低[5]。近期研究显示,组织蛋白酶抑制素(LL-37)参与动脉粥样硬化的病理生理过程[6,7]。本研究对急性ST段抬高心肌梗死(STEMI)、无CAD和稳定CAD患者的全身血浆LL-37水平进行测定,比较STEMI时全身与局部血浆LL-37水平,同时观察STEMI急性期血浆LL-37的经时性的变化。
1 资料与方法
病例选择:在取得知情授权同意后连续入选我院2009-07至2009-12接受冠状动脉造影(冠造)的患者122例,均为男性,年龄32~76岁。入选标准:①无CAD组31例。以胸痛入院但冠造提示冠脉内膜平滑、无狭窄,心脏肌钙蛋白I水平正常;②稳定CAD组44例。临床表现符合稳定型心绞痛,冠造提示左主干、前降支、回旋支或右冠脉至少存在一处直径狭窄≥50%,心脏肌钙蛋白I水平正常;③STEMI组47例,持续胸痛30 min~12 h;心电图至少两个相邻导联ST段抬高超过0.1 mV;急诊冠造示心肌梗死溶栓治疗临床试验(TIMI)血流0~1级;47例患者按心肌缺血时间分为短时间缺血者(缺血时间<210 min,n=23)和长时间缺血者(缺血时间>210 min,n=24);全组患者均接受急诊冠状动脉介入治疗(PCI)和血栓抽吸。排除标准:女性、瓣膜性心脏病、肾功能不全、肝脏疾病、免疫系统疾病或2周内有感染史,STEMI心原性休克、左主干闭塞、左束支传导阻滞、溶栓治疗后、急诊冠状动脉旁路移植术或急诊冠状动脉介入治疗术中死亡。
血样的定义及其采集:122例患者均于冠造前静脉推注50单位/kg普通肝素。全身血样(4 ml):即在主动脉根部、于冠造前通过导管采集的,取样前充分放血以排空导管内生理盐水或造影剂。47例STEMI组患者于急诊冠脉介入治疗和血栓抽吸前将普通肝素追加至100单位/kg。局部血样(4 ml):即在病变(罪犯)血管、冠脉介入治疗时通过抽吸导管(Diver CE意大利Invatec公司或ZEEK日本Zeon公司,使用前必须排空)获得的,首次抽吸物经所附滤器过滤后收集。血样不足4 ml者则将前两次或前三次抽吸物过滤后血样混合留取4 ml。STEMI组中的31例患者造影前同时于股动脉和股静脉置管,主动脉根部取血的同时采集股静脉血。STEMI组中的最后6名患者在急性期5个时间点(急诊冠脉介入治疗术前、术后即刻和发病第1、3、5天)分别采集外周静脉血4 ml。所有血样均于取样后立即置入肝素抗凝BD Vacutainer真空采血管中,并将血样在3 000 rpm离心15 min(Anke TDL 80-2B),收集血浆保存于-70℃。
样本测定:血浆LL-37和高敏C-反应蛋白水平采用夹心酶联免疫吸附法(ELISA)统一测定。LL-37 ELISA试剂盒(荷兰 Hy Cult Biotechnology公司HK321)和高敏C-反应蛋白ELISA试剂盒(德国RECI公司48040),均按照产品说明书操作,用Thermo Multiskan-MK3酶标仪(美国)在450 nm波长测定吸光度。
2 结果
三组患者临床基线资料特征。既往心肌梗死的发生率稳定CAD组比无CAD组高(15.9%比0%),STEMI组比稳定CAD组低(2.1%比15.9%);糖尿病的发生率STEMI组比稳定CAD组高(27.7%比9.1%);术前他汀类药物的使用率STEMI组比无CAD组低(48.9%比100%),比稳定CAD组也低(48.9%比100%);白细胞计数和中性粒细胞计数STEMI组均高于无CAD组和稳定CAD组,差异均有统计学意义(P<0.05)。见表1。STEMI组全身血样的采集间为发病后(254±173)min,局部血样的采集时间为发病后(263±174)min。
表1 三组患者的临床基线资料(±s)
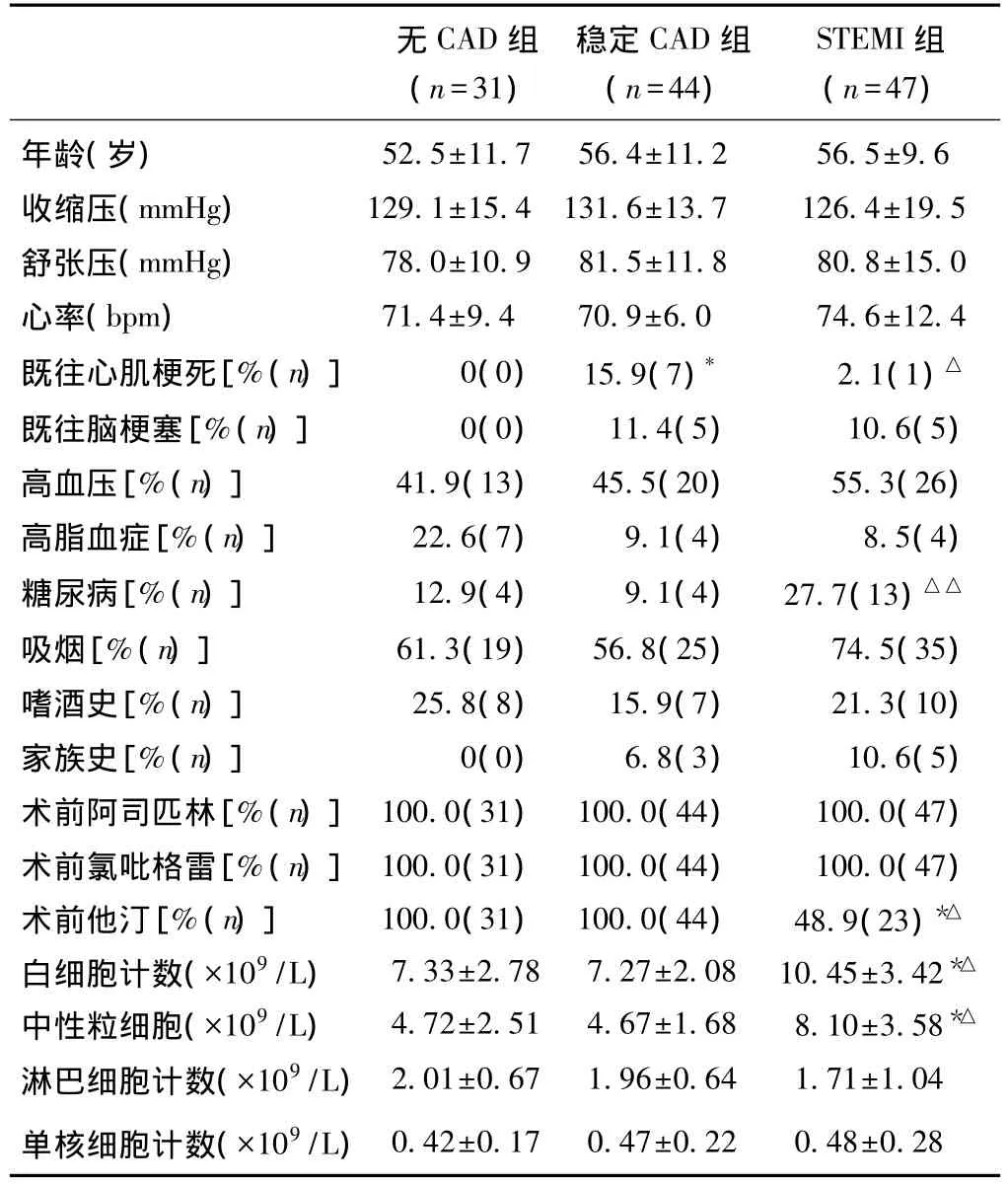
表1 三组患者的临床基线资料(±s)
注:与无 CAD组比较*P<0.05,与稳定 CAD组比较△P=0.020,△△P=0.023 CAD:冠状动脉粥样硬化性心脏病 STEMI:急性ST段抬高心肌梗死 1 mmHg=0.133 kPa
无CAD组(n=31)稳定CAD组(n=44)STEMI组(n=47)年龄(岁) 52.5±11.7 56.4±11.2 56.5±9.6收缩压(mmHg) 129.1±15.4 131.6±13.7 126.4±19.5舒张压(mmHg) 78.0±10.9 81.5±11.8 80.8±15.0心率(bpm) 71.4±9.4 70.9±6.0 74.6±12.4既往心肌梗死[%(n)] 0(0) 15.9(7)* 2.1(1)△既往脑梗塞[%(n)] 0(0) 11.4(5) 10.6(5)高血压[%(n)] 41.9(13) 45.5(20) 55.3(26)高脂血症[%(n)] 22.6(7) 9.1(4) 8.5(4)糖尿病[%(n)] 12.9(4) 9.1(4) 27.7(13)△△吸烟[%(n)] 61.3(19) 56.8(25) 74.5(35)嗜酒史[%(n)] 25.8(8) 15.9(7) 21.3(10)家族史[%(n)] 0(0) 6.8(3) 10.6(5)术前阿司匹林[%(n)] 100.0(31) 100.0(44) 100.0(47)术前氯吡格雷[%(n)] 100.0(31) 100.0(44) 100.0(47)术前他汀[%(n)] 100.0(31) 100.0(44) 48.9(23)*△白细胞计数(×109/L) 7.33±2.78 7.27±2.08 10.45±3.42*△中性粒细胞(×109/L) 4.72±2.51 4.67±1.68 8.10±3.58*△淋巴细胞计数(×109/L)2.01±0.67 1.96±0.64 1.71±1.04单核细胞计数(×109/L)0.42±0.17 0.47±0.22 0.48±0.28
三组全身动脉血浆组织蛋白酶抑制素水平的变化:全身动脉血浆LL-37水平STEMI组[16.57(7.48~24.96)μg/L]较无 CAD 组[27.02(12.61~51.91)μg/L]、稳定CAD组[26.89(16.19~65.93)μg/L]降低,差异有统计学意义(P=0.002),无CAD组与稳定CAD组比较差异无统计学意义(P=0.702)。
STEMI组全身动脉血浆组织蛋白酶抑制素水平的比较:LL-37水平术后即刻[17.37(10.26~32.28)μg/L]与术前[16.57(7.48~24.96)μg/L]比较;短时间缺血者LL-37水平[19.75(6.50~28.38)μg/L]与长时间缺血者[14.99(8.51~24.9)μg/L]比较;全身动脉血浆(n=31)LL-37水平[16.57(7.12~26.54)μg/L]与静脉血浆(n=31)[16.14(7.45~28.95)μg/L]比较,差异均无统计学意义(P=0.214~0.799)。
STEMI组局部动脉血管血浆组织蛋白酶抑制素和高敏C-反应蛋白水平的比较:STEMI组局部LL-37水平[20.66(14.41~30.82)μg/L]高于全身[16.57(7.48~24.96)μg/L],差异有统计学意义(P=0.013);局部血浆LL-37水平短时间缺血者[18.16(14.20~30.08)μg/L]与长时间缺血者[21.64(16.03~30.56)μg/L]比较差异无统计学意义(P=0.435);局部血浆LL-37水平STEMI组[20.66(14.41~30.82)μg/L]与 无 CAD 组[27.02(12.61 ~51.91)μg/L]、稳 定 CAD 组[26.89(16.19~65.93)μg/L]比较,差异无统计学意义(P=0.323)。高敏C-反应蛋白水平局部与全身血浆比较差异无统计学意义(P=0.620)。
STEMI组最后6例患者急性期各时间点全身血浆组织蛋白酶抑制素和高敏C-反应蛋白水平的比较:6例STEMI患者全身(外周静脉)血浆LL-37水平发病第1天[(64.96±34.46)μg/L]、第3 天[(73.17±21.90)μg/L]、第 5 天[(64.31±12.34)μg/L]比术前[(21.83±14.15)μg/L]及术后即刻[(21.43±12.90)μg/L]均升高(P=0.000~0.002),图1A;高敏C-反应蛋白水平术后第 1 天[(13.20±7.65)mg/L]、第 3 天[(23.97±12.17)mg/L]和第 5 天[(11.23±9.08)mg/L]较术前[(1.48±0.42)mg/L]、术后即刻[(1.41±0.48)mg/L]均升高(P=0.000~0.036),第3天比第1天高(P=0.022),第5天比第3天降低(P=0.008),差异均有统计学意义,图1B。

图1 急性ST段抬高心肌梗死组6位患者急性期5个时间点全身血浆组织蛋白酶抑制素和高敏C-反应蛋白变化(±s)。与术前及术后即刻比较*P=0.000~0.036;与1 d比较△P=0.022;与3 d比较▲P=0.008。1,3,5 d:发病第1,3,5 天。
STEMI组血浆组织蛋白酶抑制素和高敏C-反应蛋白与心肌缺血时间相关分析:STEMI组全身和局部动脉血浆LL-37水平无相关性(P=0.096)。STEMI组全身或局部动脉血浆LL-37和高敏C-反应蛋白之间不存在相关性(均P>0.05),全身动脉血浆与白细胞计数、分类计数之间也不存在相关性(均P>0.05)。STEMI组心肌缺血时间与高敏C-反应蛋白水平相关(全身 rs=0.408,P=0.004;局部 rs=0.425,P=0.003),而与血浆LL-37水平不存在相关性(全身rs=0.131,P=0.381;局部 rs=0.156,P=0.295)。
3 讨论
本研究发现STEMI患者全身血浆LL-37水平相对无CAD组和稳定CAD组下降,其水平在发病1天后升高。这是国内外较早报道急性心肌梗死时血浆LL-37水平的变化。由于全身血浆LL-37水平与白细胞或分类计数间不存在相关性,我们认为STEMI时白细胞的血浆LL-37合成或释放受到一过性抑制。
本研究中采用抽吸导管局部取样,即在急诊冠脉介入治疗血栓抽吸时留取血液样本,检测到全身与局部(罪犯病变部位)血浆水平的差异。由于STEMI组全身血样(主动脉根部)采集时肝素剂量为50单位/kg,而局部血样(罪犯病变部位)为100单位/kg,因此还不能除外肝素水平对血浆水平的影响。但目前尚少见肝素影响血浆LL-37水平的相关报道。而且,取样后均置于肝素抗凝管可能会消除这种影响。我们分析STEMI时血浆LL-37水平局部高于全身有以下可能:①可能是血栓成分裂解释放所致;②或者是罪犯血管内激活的中性粒细胞或血管壁细胞释放所致;③也可能是由于罪犯血管闭塞暂时阻碍了血流,使局部血管血浆水平未受到全身血液循环变化(降低)的影响。STEMI闭塞冠状动脉局部与全身血浆LL-37水平差异的机制值得进一步研究。
本研究显示,STEMI组术前与术后即刻全身血浆LL-37水平无差异,血浆LL-37水平与缺血时间也无相关性。这提示血管开通前取血时间对血浆LL-37水平影响不大。STEMI时全身血浆LL-37水平降低的机制和意义尚不清楚,究竟是反映了心肌梗死事件发生前还是发生后人体的病理生理变化有待进一步研究。已有的研究发现,动脉粥样硬化病变内浸润巨噬细胞和内皮细胞有血浆蛋白的异常染色[6,7]。体外培养发现血浆LL-37可诱导人脐静脉内皮细胞的细胞间黏附分子-1和单核细胞趋化因子-1表达并可促进血管平滑肌细胞的凋亡,已知它们与动脉粥样硬化病程或斑块破裂有关[8,9]。瘢痕组织血浆LL-37蛋白表达低于正常皮肤,而且血浆LL-37可抑制皮肤成纤维细胞胶原的合成[10],提示血浆LL-37在创伤修复过程中有抗纤维化的作用。血浆LL-37还可诱导成纤维细胞的增殖[11]。此外,鸡胚尿囊绒毛膜法或兔下肢缺血模型显示血浆LL-37促进毛细血管再生和动脉血管形成[12]。因此,急性心肌梗死时血浆LL-37的一过性降低是否与斑块破裂或心室重构有关可能是今后研究的主要方向。
本研究存在一些局限性。①研究未入选非ST段抬高急性冠状动脉综合征患者;②由于担心性别差异对血浆LL-37水平的影响,女性患者未予入选;③本研究中STEMI组采血时他汀服用率低于无CAD组和稳定CAD组,因此尚不能除外他汀对STEMI组LL-37水平的影响。今后也应对这几个问题进行深入研究。
[1] Libby P,Okamoto Y,Rocha VZ,et al.Inflammation in atherosclerosis:transition from theory to practice.Circ J,2010,74(2):213-220.
[2] 毛节明,王广.动脉粥样硬化与炎症.中国循环杂志,2006,21(6):405-406.
[3] 李建军.C反应蛋白:动脉粥样硬化的标志物还是兼具致病作用.中国循环杂志,2009,24(4):241-243.
[4] De Servi S,Mariani M,Mariani G,et al.C-reactive protein increase in unstable coronary disease cause or effect?.J Am Coll Cardiol,2005,46(8):1496-1502.
[5] Maier W,Altwegg LA,Corti R,et al.Inflammatory markers at the site of ruptured plaque in acute myocardial infarction:locally increased interleukin-6 and serum amyloid A but decreased C-reactive protein.Circulation,2005,111(11):1355-1361.
[6] Kougias P,Chai H,Lin PH,et al.Defensins and cathelicidins:neutrophil peptides with roles in inflammation,hyperlipidemia and atherosclerosis.J Cell Mol Med,2005,9(1):3-10.
[7] Li Y.The role of antimicrobial peptides in cardiovascular physiology and disease.Biochem Biophys Res Commun,2009,390(3):363-367.
[8] Edfeldt K,Agerberth B,Rottenberg ME,et al.Involvement of the antimicrobial peptide LL-37 in human atherosclerosis.Arterioscler Thromb Vasc Biol,2006,26(7):1551-1557.
[9] Ciornei CD,Tapper H,Bjartell A,et al.Human antimicrobial peptide LL-37 is present in atherosclerotic plaques and induces death of vascular smooth muscle cells:a laboratory study.BMC Cardiovasc Disord,2006,6:49.
[10] Park HJ,Cho DH,Kim HJ,et al.Collagen synthesis is suppressed in dermal fibroblasts by the human antimicrobial peptide LL-37.J Invest Dermatol,2009,129(4):843-850.
[11] Tomasinsig L,Pizzirani C,Skerlavaj B,et al.The human cathelicidin LL-37 modulates the activities of the P2X7 receptor in a structuredependent manner.J Biol Chem,2008,283(45):30471-30481.
[12] Koczulla R,von Degenfeld G,Kupatt C,et al.An angiogenic role for the human peptide antibiotic LL-37/hCAP-18.J Clin Invest,2003,111(11):1665-1672.
