生姜醇提取物诱导TM4细胞凋亡的研究*
2012-11-15王庆忠
王庆忠
(1.山东省高校生物化学与分子生物学重点实验室,山东 潍坊 261061;2.潍坊学院,山东 潍坊 261061)
生姜(Zingiber officinale)是药食同源植物,具有驱风散寒、健胃止吐、抑菌杀虫、抗肿瘤等作用。生姜醇提取物(Zingiber officinale extraction in alcohol,CCM)含姜黄素等多种物质,其中的姜黄素为姜的重要活性成分之一,广泛用于食品添加剂和着色剂,具有抗HIV、抗利什曼原虫、抗细胞畸变、抑制血小板聚集和血栓形成等多种作用[1-2]。尤其是生姜醇提取物的抗癌活性在近年来受到广泛重视。研究表明,生姜醇提取物可诱导细胞凋亡,对宫颈癌、子宫内膜癌、肾癌、乳腺癌等各种癌症的发生有抑制和治疗作用[3-11]。但关于生姜醇提取物对精子发生和睾丸肿瘤的作用,至今未见报道。TM4细胞株来源于小鼠睾丸支持细胞(Sertoli cells),在体外培养中具有支持细胞、上皮细胞和肿瘤细胞的特性。通过研究生姜醇提取物对TM4细胞的影响,可反映其对哺乳动物和人的生精作用和睾丸肿瘤发生的作用。
1 材料与方法
1.1 主要试剂和仪器
L-谷胺酰胺、青霉素、链霉素、葡萄糖、二甲基亚枫(DMSO)、胎牛血清(fetal bovine serum,FBS)、DMEM、胰蛋白酶(Trypsin)、明胶、MTT(甲基四氢叶酸盐)等试剂均购于Sigma-Aldrich公司;TUNNEL细胞凋亡检测试剂盒为凯基生物有限公司产品;其它一般试剂均为国产分析纯。主要仪器包括细胞培养板、细胞培养瓶(北京鼎国生物有限公司)、CO2培养箱(美国Precision Scientific Inc.)、倒置显微镜(日本Olympus)、An Thos TH2酶标仪(Austria公司)等。
1.2 细胞株与培养条件
小鼠支持细胞系TM4细胞株由中国科学院动物研究所生殖生物学重点实验室惠赠。
细胞培养基是以DMEM为基本培养液,添加2mM L-谷氨酰胺、5%FBS、100unit/ml青霉素和100ug/ml链霉素。细胞培养在37°C、5%CO2和饱和湿度条件下。0.25%的胰蛋白酶消化传代。细胞单层贴壁生长,选择对数生长期细胞进行试验。将TM4细胞株分为对照组和实验组。实验组以5种不同浓度的生姜醇提取物进行处理。
1.3 生姜醇提取物的制备
将2000g生姜粉碎后,加入60%的乙醇500ml,置入65℃恒温水浴中,作用12小时。然后过滤,弃去残渣,浸提液置于65℃干燥箱中烘干。称重浸出物,并配制成0.1mg/ml的母液。
1.4 MTT比色法检测TM4细胞活性
MTT能被活细胞线粒体中的琥珀酸脱氢酶还原为水不溶性的蓝紫色结晶甲瓒(Formazan),而死细胞无此功能。DMSO能溶解甲瓒,用酶标仪在490nm波长处测定其光吸收值,可间接反映活细胞数量。在一定细胞数范围内,MTT结晶形成的量与细胞数成正比。
用0.25%胰蛋白酶消化对数生长期的TM4细胞,制成5×104cell/mL细胞悬液,以每孔200μL接种于96孔板,置培养箱中培养24小时后,弃掉培养基,依次以终浓度为20、40、60、80、100μg/mL的生姜醇提取物的培养液分别加入96孔板的各孔内,每一浓度设5个平行孔。同时设对照组(不加药组)及空白组(仅加培养基)。继续培养48小时后,每孔加入5g/L的MTT20μL,培养箱中孵育4h,然后吸出孔内培养液,每孔加入DMSO液200μL,将培养板置于微孔板荡器上振荡10min,使结晶物溶解,最后在酶标仪上于4920nm的波长下测定各孔的吸光度OD值。通过下式计算细胞存活率和抑制率:
细胞存活率=[(对照组OD值-实验组OD值)/(对照组OD值勤-空白组OC值)]×100%
抑制率=100%-存活率
试验重复3次取平均值。结果用SPSS10.0统计分析软件进行t检验及数据处理,以P<0.05表示差异有统计学意义。
1.5 原位末端标记法(TUNNEL)检测TM4细胞凋亡
TM4细胞的处理同上,所不同的是制作成细胞爬片,载玻片常规干热灭菌处理,用前以0.2明胶包被10分钟,然后用PBS洗涤3次后接种细胞。细胞的染色按试剂盒说明书进行,主要步骤如下:
①取出细胞爬片,PBS洗涤2次,4%多聚甲醛固定20min,PBS洗涤5min×2次;②加入3%过氧化氢室温下孵育20min,PBS洗涤5min×3次;③0.1蛋白酶K在4℃下作用30min,PBS洗涤5min×3次;④加入反应混合液,37℃湿盒内孵育60min,PBS洗涤5min×3次,然后加50μLPOD,继续孵育60min,PBS洗涤5min×3次;⑤加入50μL新配制的DAB显色试剂,作用3-5min,自来水洗,置镜下观察。
2 结果
2.1 光镜下观察到生姜醇提取物对TM4细胞的增殖有抑制作用
光镜下,对照组的TM4细胞呈上皮样贴壁生长良好,形态呈梭形或多角形,胞核明显。20μg/mL的生姜醇提取物处理组的细胞形态结构没有明显变化;40μg/mL的醇提取物处理组可观察到细胞生长不良,某些细胞的胞体变小,变圆,贴壁细胞数目减少;60μg/mL的醇提取物处理组中可观察到大量的细胞脱壁,轮廓不清,细胞膜破溃,聚集成细胞团,以及少量的细胞碎片。因此,随处理剂量的增加,生姜醇提取物明显抑制TM4细胞的生长与增殖(见图1)。
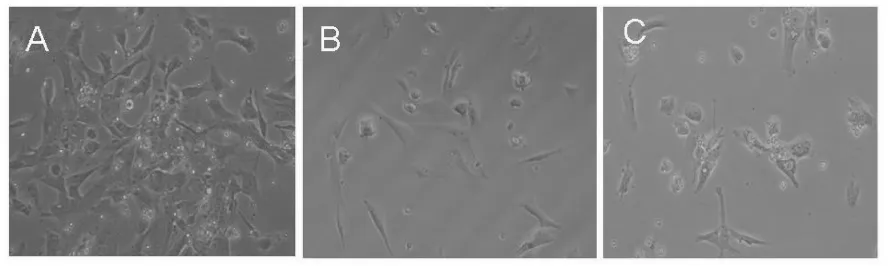
图1 光镜下生姜醇提取物对TM4细胞的影响(×260)
2.2 MTT法检测出生姜醇提取物对TM4细胞的增殖有抑制作用
MTT法测定的不同浓度的熟地黄醇提取物对TM4细胞株生长与增殖的影响见表1。从表中各不同浓度的生姜醇提取物对细胞的抑制率可以看出,20μM/mL生姜醇提取物处理的TM4细胞与对照组比较没有显著差异,40μg/mL生姜醇提取物处理组对TM4细胞增殖的抑制作用与对照组比较已经有较明显的差异,随着处理浓度的增大,这种抑制作用越来越强,呈剂量间依赖性。处理浓度达到100μg/mL时,TM4细胞的生长与增殖已被基本抑制。
表1 MTT法检测各浓度生姜醇提取物对TM4细胞增殖的影响±S)
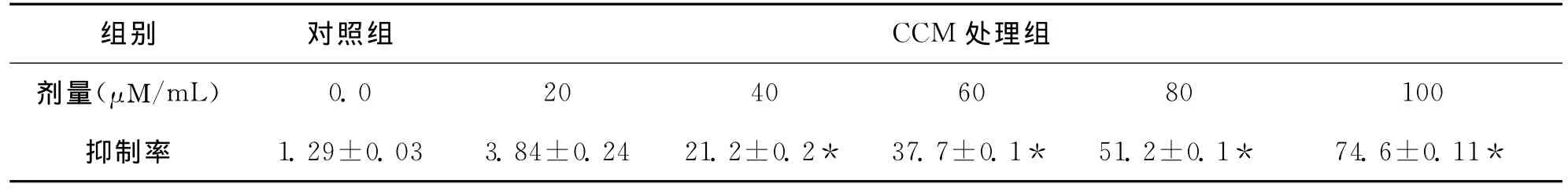
表1 MTT法检测各浓度生姜醇提取物对TM4细胞增殖的影响±S)
注:与对照组比较,*P<0.05。
组别 对照组 CCM 处理组剂量(μΜ/mL)0.0 20 40 60 80 100抑制率 1.29±0.03 3.84±0.24 21.2±0.2* 37.7±0.1* 51.2±0.1* 74.6±0.11*
2.3 TUNNEL法检测到生姜醇提取物诱导TM4细胞凋亡
通过试验检测发现,CCM具有诱导TM4细胞凋亡的作用。在20μM/mL生姜醇提取物处理组检测载片上,偶见凋亡的细胞,说明这一浓度的生姜醇提取物处理对TM4细胞没有影响;40μM/mL生姜醇提取物处理组的载片上可观察到较多的凋亡细胞,随着处理浓度的增加,凋亡细胞的比例逐渐增大(见图2,其它处理组的图片未展示)。凋亡细胞统计与分析也表明,40μM/mL生姜醇提取物处理组与对照组比较有显著差异(见表2)。

图2 光镜下观察的生姜醇提取物对TM4细胞的影响(TUNNEL法)
表2 不同浓度的生姜醇提取物对TM4细胞的凋亡指数±S,n=3)
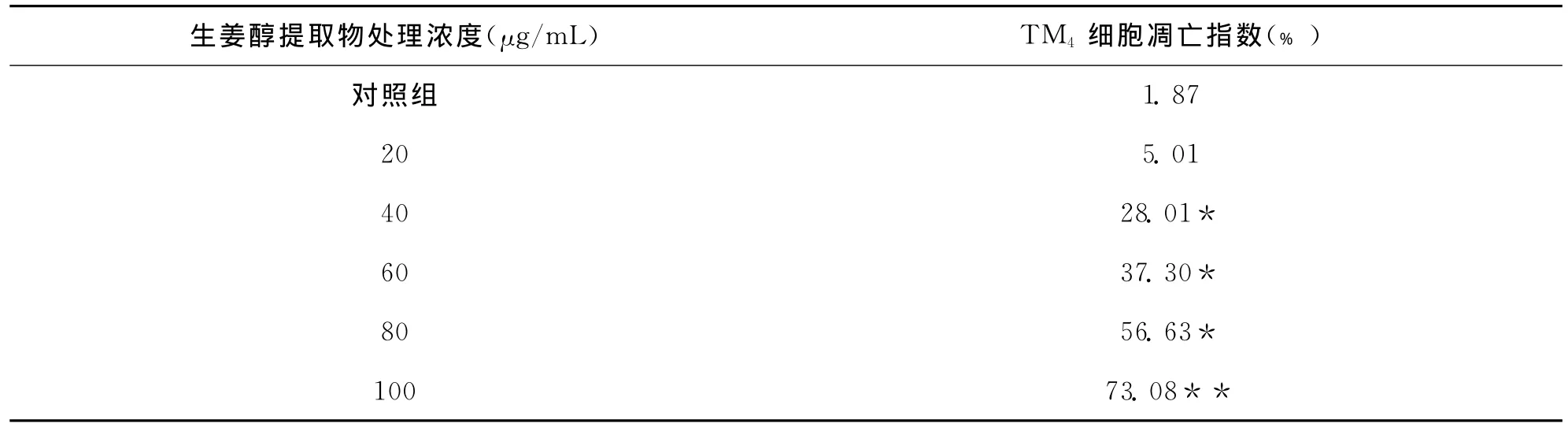
表2 不同浓度的生姜醇提取物对TM4细胞的凋亡指数±S,n=3)
注:与对照组比较,*P<0.05。
生姜醇提取物处理浓度(μg/mL) TM4细胞凋亡指数(﹪)对照组1.87 20 5.01 40 28.01*60 37.30*80 56.63*100 73.08**
3 结论与讨论
生姜醇提取物具有多方面的药理作用。尤其是作为一种具有良好发展前景的抗癌新药,具有抗癌谱广、毒副作用小的优点,被认为是一种潜在的第3代抗恶性细胞增殖药[4-11]。许多研究表明,生姜醇提取物具有确切的抗细胞增殖活性[2,8]。但生姜醇提取物对睾丸中支持细胞和生精细胞的影响作用还未见报道。
在本研究中,利用小鼠睾丸支持细胞株TM4作为研究材料,通过光镜下的细胞形态观察、MTT法测定细胞活性和TUNNEL法三种方法研究生姜醇提取物对TM4细胞的影响。研究结果表明,生姜醇提取物抑制TM4细胞的增殖,诱导TM4细胞凋亡。这一结果与报道的生姜醇提取物对其它类型的细胞的影响是一致的,40μM/mL的生姜醇提取物即能显著抑制细胞增殖并诱导细胞凋亡[2-8],并呈剂量依赖效应。TM4细胞来源于小鼠的睾丸支持细胞,既具有支持细胞的特殊性,又具有肿瘤细胞的特点。我们这一研究的结果也表明,生姜醇提取物对睾丸癌细胞的增殖有抑制和诱导其凋亡的作用。因此,生姜醇提取物可以作为预防和治疗睾丸癌的一种药物。但生姜醇提取物诱导睾丸细胞凋亡的详细机制还有待于进一步的研究。
[1]崔晶,翟光喜,娄红祥.姜黄素的研究进展[J].中南药学,2005,3(2):108-119.
[2]罗金香,丁伟,王永强,等.姜黄素双肟酯衍生物的合成与生物活性研究[J].西南农业大学学报:自然科学版,2008,30(8):52-56.
[3]王玉玲,吴振,张喜轩.姜黄素类化合物的抗肿瘤活性[J].中国医科大学学报,2006,5(4):380-381.
[4]赵承光,杨菊,梁栋楼,等.新型含氟姜黄素类似物的合成、晶体结构及抗肿瘤活性[J].有机化学,2010,30(2):289-294.
[5]林友文,陈莉敏,周有青,等.姜黄素类似物的微波合成及抗肿瘤活性研究[J].中国新药杂志,2010,19(7):622-624.
[6]黄赞松.姜黄素对消化系肿瘤作用的研究进展[J].时珍国医国药,2009,20(2):383-385.
[7]田斌强,赵应梅,王德贵,等.生姜醇提取物对大鼠膀胱肿瘤的预防与治疗作用[J].肿瘤,2011,(11):1004-1009.
[8]龚萍,李红霞,张素梅.姜黄素对人卵巢癌细胞株skov-3生长的影响[J].南京中医药大学学报,2011,36(1):18-21.
[9]Lin J K,Pan M H,Lin-Shiau S Y.Recent studies on the biofunctions and biotransformations of curcumin[J].Biofactors,2000,13(1/4):153-158.
[10]Bulku E,Stohs S J,Cicero L,et al.Curcumin exposure modulates multiple pro-apoptotic and anti-apoptotic signaling pathways to antagonize acetaminophen-induced toxicity[J].Curr Neurovasc Res,2012,9(1):58-71.
[11]Attia H N,Al-Rasheed N M,Al-Rasheed N M,et al.Protective effects of combined therapy of gliclazide with curcumin in experimental diabetic neuropathy in rats[J].Behav Pharmacol,2012,23(2):153-61.
