不同生长阶段鹿茸中多糖含量的比较及其提取条件优化
2012-11-15赵玉红金秀明
赵玉红,金秀明
(东北林业大学林学院食品科学系,黑龙江哈尔滨150040)
不同生长阶段鹿茸中多糖含量的比较及其提取条件优化
赵玉红,金秀明
(东北林业大学林学院食品科学系,黑龙江哈尔滨150040)
以鹿茸为原料,比较不同生长阶段鹿茸多糖含量的差异性,并对其提取条件进行优化。采用超声波辅助提取法提取鹿茸多糖,并用Box-Behnken中心组合实验设计优化提取条件。实验结果表明:不同生长阶段的鹿茸中二杠茸多糖含量为12.47mg/g,高于毛桃和三杈茸(P<0.05);优化的提取条件为pH=9.2、超声时间22min、超声功率500W、液料比48∶1,在此条件下二杠鹿茸中多糖得率为0.98%。
鹿茸,多糖,提取,优化
东北梅花鹿(Cervus nippon hortulorum Lydekker)是鹿科、鹿属动物梅花鹿的东北亚种,以其茸质优良而著称[1]。梅花鹿茸具有丰富的生理功能及药理作用,它是梅花鹿尚未骨化的幼角[2],是一种较为特殊的软骨组织[3]。从组织学角度来看,鹿茸是一种未钙化的角质组织,它的生长是有规律的,具有周期性特点[4]。在不同生长期限内收获的梅花鹿茸,根据生长规格可分为初生茸、二杠茸和三杈茸等几种。不同生长阶段的鹿茸,其活性物质含量也不相同[5-8]。鹿茸中含有脂类、多糖、蛋白质、多肽等多种活性物质[9],多糖作为鹿茸中主要活性成分,一直备受关注。Sunwoo等[10]对马鹿茸中蛋白多糖进行分离纯化,经电泳图谱分析证明鹿茸中至少含有三种蛋白多糖。王本祥等[11]给大鼠灌胃鹿茸多糖,实验证明其对多种类型胃溃疡皆有抑制作用。陈晓光[12]通过检测小鼠血清SGPT活性,得出鹿茸多糖具有抗肝损伤功能。目前对鹿茸多糖的研究仅限于选取某一生长阶段的鹿茸为原料,对其性质及功能性进行研究。而不同生长阶段鹿茸多糖含量的比较及优化鹿茸多糖提取条件的研究尚未见报道。因此,本实验对不同生长阶段的毛桃、二杠、三杈茸中多糖含量进行比较,采用超声波辅助提取法提取鹿茸多糖,采用Box-Behnken中心组合实验设计优化鹿茸多糖提取条件,以期获得较高的提取率,为鹿茸资源中多糖等生物活性成分的进一步研究提供科学依据。
1 材料与方法
1.1 材料与仪器
梅花鹿茸(毛桃、二杠、三杈茸) 黑龙江省大庄园集团提供;MD-44透析袋 美国Sigma公司;甘氨酸,磷酸二氢钠,磷酸氢二钠,苯酚等 均为分析纯。
PHS-3C数显pH计 上海雷磁仪器厂;TDA-8002数显恒温水浴锅 苏州威尔实验用品有限公司;RE-52A旋转蒸发仪 上海亚荣生化仪器厂; TDL-5台式离心机 上海安亭科学仪表厂;722可见分光光度计 上海光谱仪器有限公司;ALPHA1-2真空冷冻干燥机 德国Christ公司;JY99-2D超声波细胞粉碎仪 宁波新芝生物技术股份有限公司。
1.2 实验方法
1.2.1 工艺流程

1.2.2 鹿茸多糖的提取 将鹿茸切成2~3mm见方的小块,乙醚浸泡处理2h进行初步脱脂。脱脂后冷冻干燥24h,粉碎,过40目筛。准确称取1g鹿茸粉末,加入20倍体积的pH 8.0磷酸盐缓冲溶液,90℃水浴提取2h,5000r/min离心20min,取上清液,经Sevage法[13]脱蛋白,至无明显沉淀。用7%双氧水50℃保温脱色4h。室温下流动水透析48h,旋转蒸发仪浓缩至原体积的1/3~1/2,加入4倍体积95%乙醇,4℃过夜,冷冻干燥,即得鹿茸多糖提取物。
1.2.3 提取物中鹿茸多糖得率计算
1.2.3.1 标准曲线绘制 多糖含量的测定采用苯酚-硫酸法[14]。准确称取标准品葡萄糖20mg,溶解定容至500mL,分别吸取0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8mL,各以水补至2.0mL,然后加入6%苯酚1.0mL,浓硫酸5.0mL,静置10min,摇匀,沸水浴20min后于波长490nm处测定吸光度。以2.0mL蒸馏水为空白。标准曲线如图1所示,并由此得回归方程:y=0.0081x+ 0.0068,式中:x为多糖浓度(μg/mL),y为吸光值。相关系数R2=0.9991,由此可见该曲线拟合度较好,可用于鹿茸多糖含量的计算。

图1 苯酚-硫酸法标准曲线Fig.1 Standard curve by phenol-sulfuric acid method
1.2.3.2 鹿茸多糖得率 准确称取提取物,用蒸馏水复溶,吸取样品液1.0mL,稀释,按上述步骤操作测吸光值,根据标准曲线方程计算鹿茸多糖样品液中多糖的质量浓度,并计算其得率。

1.2.4 超声波辅助提取鹿茸多糖 提取工艺条件主要包括浸提时间(h)、提取液pH、液料比(mL/g)、超声时间(min)和超声功率(W)。针对这几个因素,分别在保持其它因素相同的条件下进行单因素实验,考察各因素对多糖得率的影响,选择最佳的提取工艺条件。其中,浸提时间(h)分别为0.5、1、2、3、4h,提取液pH分别为7、8、9、10和11,超声时间(min)分别为10、15、20、25、30min,超声功率(W)分别为200、400、600、800、1000W,液料比(mL/g)分别为10∶1、20∶1、30∶1、40∶1和50∶1。
1.2.5 鹿茸多糖提取条件优化 在单因素的基础上,采用Box-Behnken中心组合实验设计,选取pH、超声时间(min)、超声功率(W)和液料比(mL/g) 4个因素进行二次旋转多元回归实验,获得最佳提取条件,因素水平见表1。

表1 实验因素和水平编码值Table 1 Factors and levels of antler polysaccharide extraction test
1.3 数据统计分析
2 结果与讨论
2.1 不同阶段鹿茸多糖含量比较
由苯酚-硫酸法测得各阶段鹿茸多糖含量如表2所示。
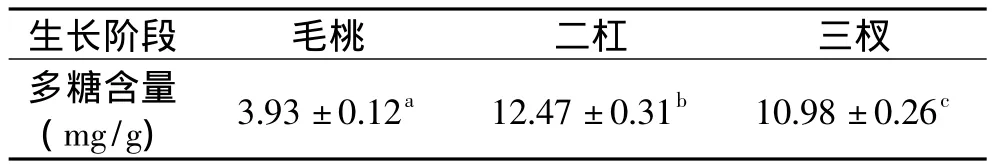
表2 不同生长阶段鹿茸多糖含量Table 2 Contents of antler polysaccharide in different growth stages
由表2可知,二杠茸中多糖含量最多,三杈茸次之,毛桃茸多糖含量最少。Mintab16统计软件分析得,二杠茸与三杈和毛桃茸中多糖含量差异显著(P<0.05)。因此,二杠茸更适合作为提取鹿茸多糖的原料,故选其作为后续实验原料。
2.2 鹿茸多糖提取单因素实验结果
2.2.1 热水浸提时间的确定 由图2可知,随着时间的延长,多糖得率不断增大,提取时间为2h时,多糖得率最大,此后随时间的延长,多糖得率并未增加,这可能是由于浸提时间短,多糖溶解不充分,时间过长则导致多糖发生少量水解[15]。所以选取热水浸提的时间为2h。
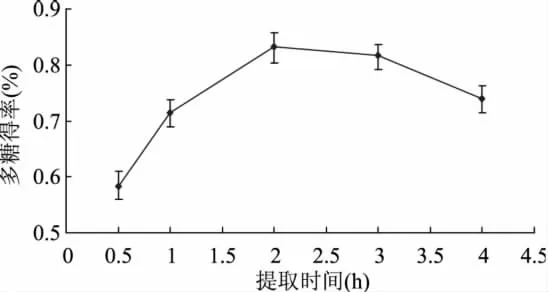
图2 热水浸提时间对多糖得率的影响Fig.2 Effect of hot water extraction time on the yield of polysaccharide
2.2.2 pH对多糖得率的影响 由图3可知,随着pH的提高,溶液中多糖得率也不断增加。当pH为9时,得率最大,pH大于9,多糖得率下降。这是因为当提取液pH小于9时,物料的结构得到解散,从而使其中所含的多糖物质充分析出,多糖得率显著增加。但pH过高时,较大的碱性造成多糖物质或性质的改变,使多糖得率呈下降的趋势。所以,选择提取液pH为9。

图3 pH对多糖得率的影响Fig.3 Effect of pH on the yield of polysaccharide
2.2.3 超声时间对多糖得率的影响 由图4可知,随着超声时间的延长,多糖得率逐渐增大,在20min时最大。20min后,得率开始下降,这可能是由于处理时间过长造成糖键断裂,多糖含量下降。所以超声时间选择20min。
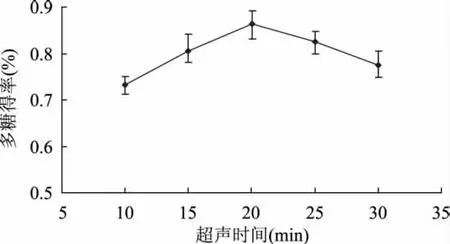
图4 超声时间对多糖得率的影响Fig.4 Effect of ultrasonic extraction time on the yield of polysaccharide
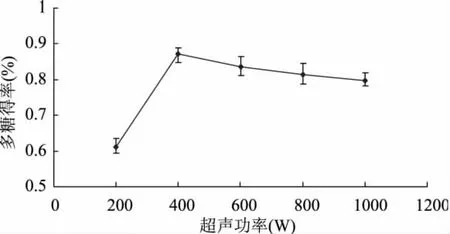
图5 超声功率对多糖得率的影响Fig.5 Effect of ultrasonic extraction power on the yield of polysaccharide
2.2.4 超声功率对多糖得率的影响 由图5可知,当超声波功率为400W时,多糖得率最大,此后,增大超声波功率,得率变化也不明显。超声波功率增大时,传质被加强,细胞破碎程度增加,有利于鹿茸多糖在溶液中的浸出;但超声波功率过大时,超声波产生的强烈振动会引起细胞内部结构的变化,使部分鹿茸多糖降解,得率降低。因此确定超声波功率为400W。
2.2.5 液料比对多糖得率的影响 由图6可知,随着液料比增加,多糖得率逐渐增多,液料比(mL/g)为30∶1时,得率最大。液料比继续增加,得率并未增加。这是由于提取液过少时,多糖提取不充分,使得提取率过低;提取液过多时,由于相同溶解状态下,多糖已基本全部溶解,再增加溶剂的量不会使得率增加;或由于超声波辐射被溶液大量吸收,不能完全作用于物料,影响多糖的得率[16]。因此选取液料比(mL/g)为30∶1。

图6 液料比对多糖得率的影响Fig.6 Effect of liquid-solid ratio on the yield of polysaccharide
2.3 鹿茸多糖提取条件优化
2.3.1 分析方案及实验结果 实验分析及结果见表3。
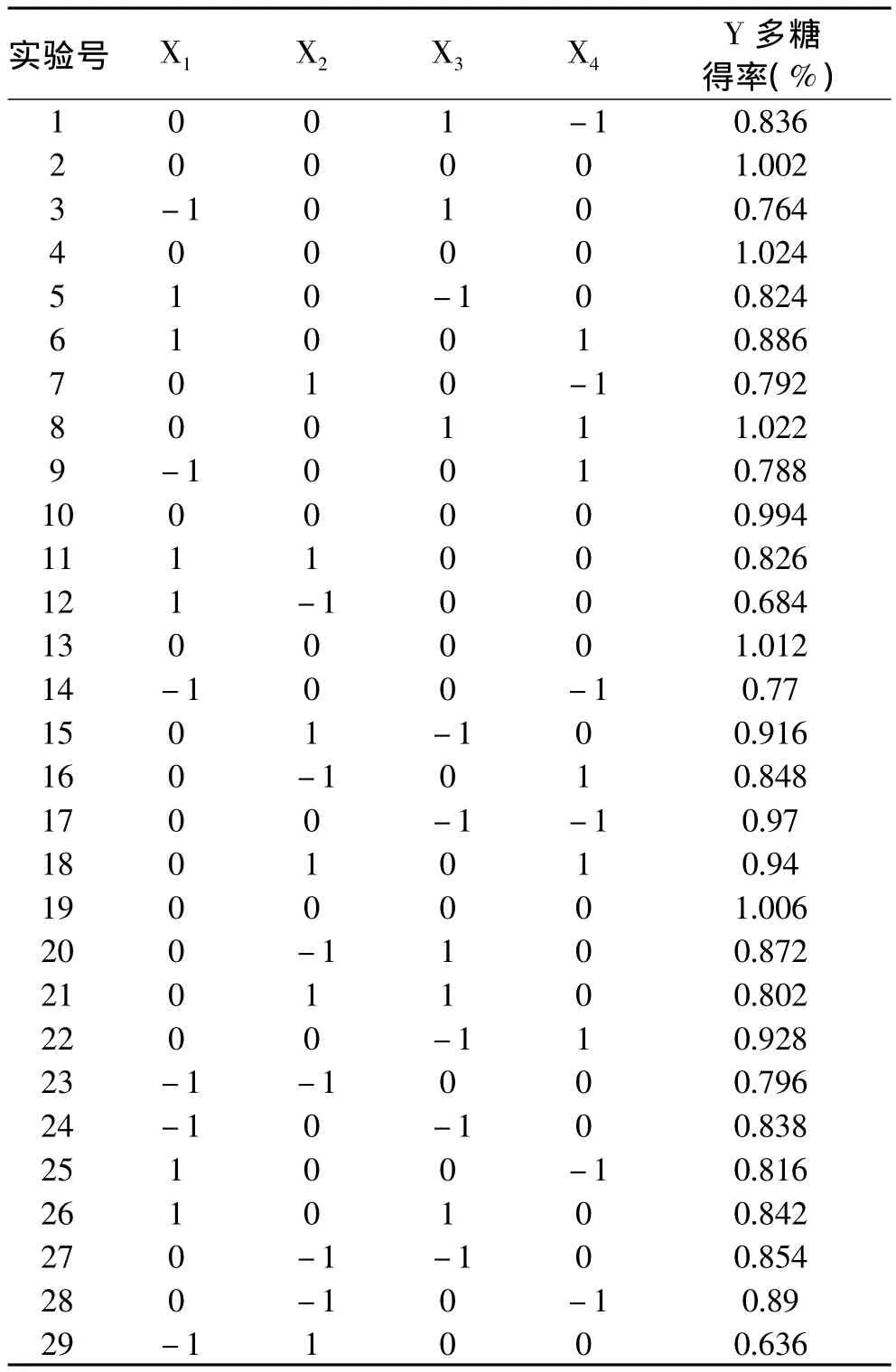
表3 Box-Behnken分析方案及实验结果Table 3 Box-Behnken analysis and results
2.3.2 回归方程的建立及响应面分析 利用SAS软件对表3中实验数据进行多元回归拟合,得到鹿茸多糖得率对编码自变量pH、超声时间、超声功率和液料比的二次多项回归,分析自变量对多糖提取效果显著性。结果见表4。
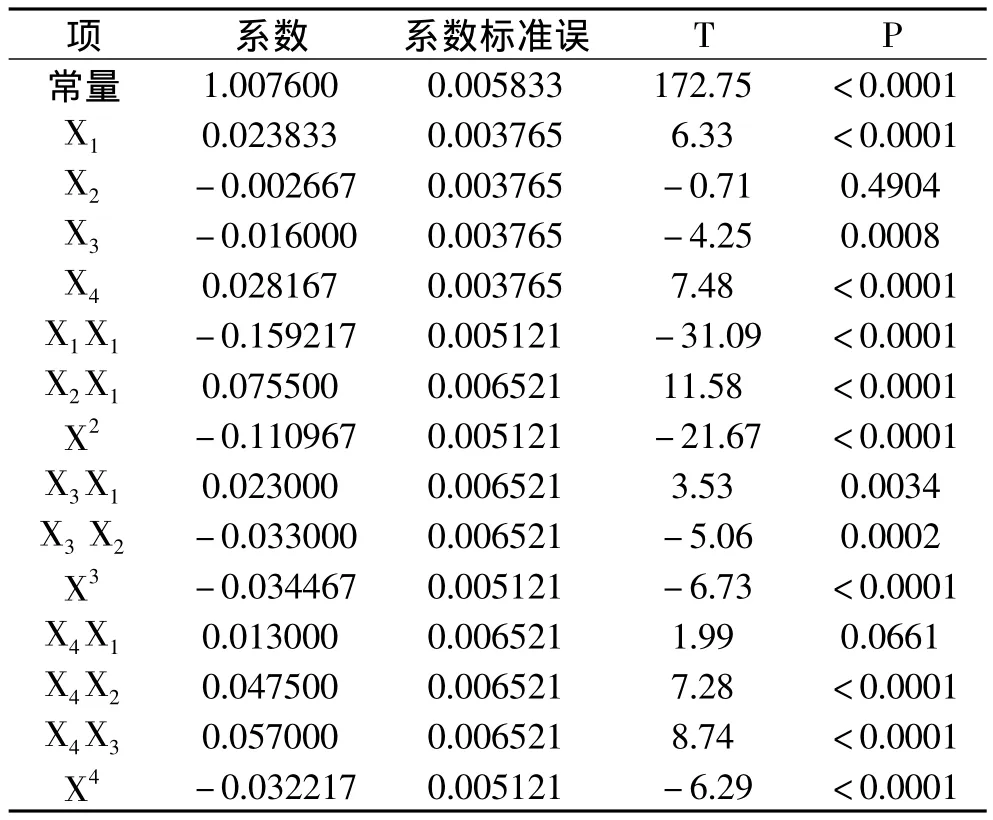
表4 回归系数显著性分析Table 4 Significant regression coefficient analysis
由此,建立数学模型:Y=1.007600+0.023833X1-0.002667X2-0.016000X3+0.028167X4-0.159217+0.075500X2X1-0.110967+0.023000X3X1-0.033000X3X2- 0.034467+ 0.013000X4X1+ 0.047500X4X2+0.057000X4X3-0.032217
X1和X4对多糖得率线性效应影响极显著,X2对多糖得率线性效应影响不显著。说明pH和液料比对鹿茸多糖得率影响较大,超声时间的改变对多糖得率影响不明显。二次项对多糖得率曲面效应影响极显著,X2X1、X4X2和X4X3对多糖得率交互效应影响极显著,X4X1对多糖得率交互效应影响不显著。由此可见,各实验因素之间不是简单的线性关系,而是二次关系。
由表4可知,各因素对多糖得率影响顺序为:液料比>pH>超声功率>超声时间。

表5 方差分析表Table 5 Variance analysis of regression equation
由方差分析可知,该回归方程极显著(P<0.0001),R2=99.16%,说明该模型二次方程高度显著,实验测得的实际值与预测值有较好的拟合度,此模型可用于预测响应值多糖得率(Y)的实际情况。方程失拟结果不显著P=0.3765>0.05,可用此模型对回归方程进行检验。
根据回归分析结果,每2个因素对多糖得率做出响应曲图。此时,考虑到定性分析各因素对得率的关系,固定另外2个因素时,均做“0”水平处理。图7~图12直观地反映了各因子交互作用的响应面分析结果。

图7 pH和超声时间交互影响的响应曲面图Fig.7 Response surface graph of pH and ultrasonic extraction time
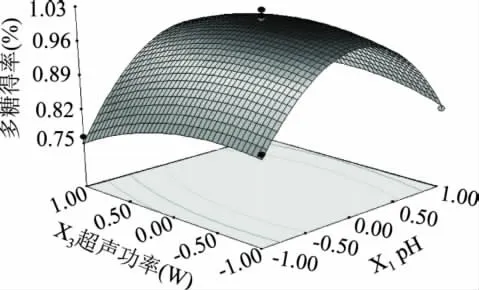
图8 pH和超声功率交互影响的响应曲面图Fig.8 Response surface graph of pH and ultrasonic extraction power
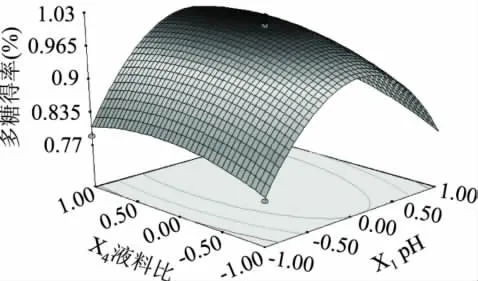
图9 pH和液料比交互影响的响应曲面图Fig.9 Response surface graph of pH and liquid-solid ratio
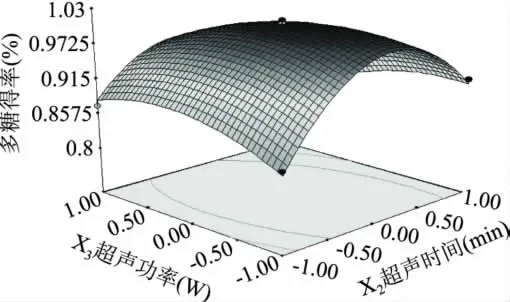
图10 超声时间和超声功率交互影响的响应曲面图Fig.10 Response surface graph of ultrasonic extraction time and ultrasonic extraction power
由响应曲面最高点可知,在所选范围内存在极值,即响应曲面最高点。对拟合方程求偏导,得到模型的最大值[17]。即当 pH 为 9.15、超声时间21.46min、超声功率518.56W和液料比47.62∶1的条件下,理论得到多糖得率的最大值。根据实际情况,确定验证实验提取条件:pH=9.2、超声时间22min、超声功率500W、液料比48∶1。将此条件代入回归方程,计算出鹿茸多糖得率预测值为1.01%。在该提取工艺条件下,实际测得鹿茸多糖得率为0.98%(三次平行实验的平均值,n=3)。预测值与实验平均值间的误差为2.97%在误差允许范围内,说明回归方程能较真实地反映各因素对多糖得率的影响。
此前,龙远德[18]等曾采用水提法从鹿茸蛋白中提取多糖,得率为0.2%;Sunwoo[19]用木瓜蛋白酶水解得到马鹿茸顶部、上部、中部和基部等不同部位多糖,得率分别为0.64%、0.71%、0.14%和0.09%; Jeon[20]等对梅花鹿不同部位酸性多糖进行比较,得出鹿茸中中部和基部多糖得率分别为0.77%和0.67%。由此可知,溶剂提取及酶法提取鹿茸多糖的结果均低于本实验所采取方法的优化结果,说明超声波辅助提取技术在鹿茸多糖提取研究中是一种行之有效的方法。
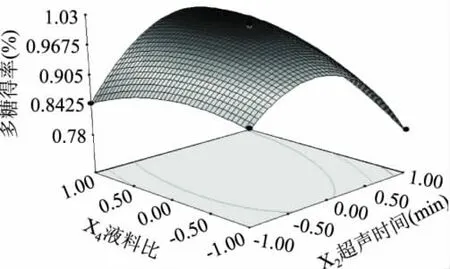
图11 超声时间和液料比交互影响的响应曲面图Fig.11 Response surface graph of ultrasonic extraction time and liquid-solid ratio

图12 超声功率和液料比交互影响的响应曲面图Fig.12 Response surface graph of ultrasonic extraction power and liquid-solid ratio
3 结论
不同生长阶段的鹿茸中多糖含量不同,二杠茸的多糖含量为12.47mg/g,高于毛桃茸和三杈茸(P<0.05),更适合作为鹿茸多糖提取的原料。采用超声波辅助提取鹿茸多糖效率更高,最佳提取工艺条件为:pH=9.2、超声时间22min、超声功率500W、液料比48∶1,在此条件下多糖得率为0.98%。
[1]T Hiura,Y Hashidoko,Y Kobayashi,etal.Effective degradation of tannic acid by immobilized rumen microbes of a sika deer(Cervus Nippon yesoensis)in winter[J].Animal Feed Science and Technology,2010,155(1):1-8.
[2]齐艳萍.鹿茸药理作用的研究进展[J].经济动物学报,2008,12(1):53-55.
[3]K H Kim,K S Kim,B J Choi,et al.Anti-bone resorption activity of deer antler aqua-acupunture,the pilose antler of Cervus Korean TEMMINCK var.mantchuricus Swinhoe in adjuvant-induced arthritic rats[J].Ethnopharmacology,2005,96: 497-506.
[4]李爱国.梅花鹿的生活习性、繁殖特点及鹿茸的生长发育[J].养殖技术顾问,2010(9):32-33.
[5]N F Ivankina,S V Isay,N G Busarova,et al.Prostaglandinlike activity,fatty acid and phospholipid composition of sika deer (Cervus nippon)antlers at different growth stages[J].Comparative Biochemistry and Physiology,1993,106(1):159-162.
[6]李泽鸿,姚玉霞,王全凯,等.二杠鹿茸与三杈鹿茸中营养元素含量的差异[J].微量元素与健康研究,2003,20(4): 30-31.
[7]姚玉霞,蔡建培,杜锐,等.梅花鹿三杈茸和二杠茸氨基酸含量对比分析[J].中国食品学报,2003,3(2):67-71.
[8]王艳红.东北梅花鹿茸二杠与三杈茸中总磷脂和牛磺酸含量比较分析[J].经济动物学报,2004,8(3):135-136.
[9]吉静娴,钱璟,黄凤杰,等.鹿茸的活性物质及药理作用的研究进展[J].中国生化药物杂志,2009,30(2):141-143.
[10]H H Sunwoo,T Nakano,R J Hudson,et al.Isolation and characterization of proteoglycans from growing antlers of wapiti (Cervus elaphus)[J].Comparative Biochemistry and Physiology,1998,121:437-442.
[11]王本祥,刘爱晶,程秀娟,等.鹿茸多糖抗溃疡作用[J].药学学报,1985(5):321-325.
[12]陈晓光.鹿茸多糖抗肝损伤作用的生化药理学研究[D].吉林大学,2004.
[13]阮培春.人工虫草菌丝多糖含量测定[J].保定师范专科学校学报,2005,18(4):63-65.
[14]周泉城,孙军凤.超声波辅助提取桔梗多糖研究[J].食品科学,2007,28:111-116.
[15]朱楠楠,侯淑丰,孙广仁.响应面法优化长白山东北细叶羊角芹根多糖提取工艺[J].北华大学学报,2010,11(6): 553-558.
[16]郝继伟.超声波法提取蒙山松菇多糖的工艺研究[J].食品工业科技,2011,32(1):213-218.
[17]B T Lin,M D Jean,J H Chou.Using response surface methodology for optimizing deposited partially stabilized zirconia in plasma spraying[J].Applied Surface Science,2007,253(6): 3254-3262.
[18]龙远德,张惠祥,黄化民,等.鹿茸中粘多糖和超氧化歧化酶的研究[J].吉林大学自然科学学报,1991(1):81-83.
[19]H H Sunwoo,T Nakano,R J Hudson,et al.Isolation,characterization and localization of glycosaminoglycans in growing antlers of wapiti(Cervus elaphus)[J].Comparative Biochemistry and Physiology Part B,1998,120:273-283.
[20]B Jeon,S Kim,S LEE,et al.Effect of antler growth period on the chemical composition of evelvet antler in sika deer(Cervus nippon)[J].Mammalian Biology,2008,74:374-380.
Optimization of polysaccharide content of velvet antlers at different growth stages and extraction process
ZHAO Yu-hong,JIN Xiu-ming
(Department of Food Science,College of Forestry,Northeast Forestry University,Harbin 150040,China)
Selecting velvet antlers as the raw materials,the content of polysaccharide at different growth stages were compared and the extraction conditions of polysaccharide were also optimized.Ultrasonic wave assisted was used to extract polysaccharide,Box-Behnken experiment was also designed to optimize the extraction conditions. Results showed that content of polysaccharide in two branched was 12.47mg/g,which was higher than three branched(P<0.05).pH of 9.2,ultrasonic time of 22min,ultrasonic power of 500W,liquid-solid ratio of 48∶1 were the optimal conditions.Under such conditions,yield of polysaccharide in two-branched was 0.98%.
antler;polysaccharide;extraction;optimization
TS201.1
B
1002-0306(2012)02-0311-04
2011-02-11
赵玉红(1968-),女,硕士,副教授,研究方向:林特产品精深加工。
黑龙江省教育厅科学技术研究指导项目(11553036)。
