甘草总黄酮提取工艺及总抗氧化活性研究
2012-11-15韩雅慧顾赛麒陶宁萍
韩雅慧,顾赛麒,陶宁萍,*,罗 锋
(1.上海海洋大学,上海201306; 2.新疆阿拉尔新农甘草有限责任公司,新疆阿拉尔843000)
甘草总黄酮提取工艺及总抗氧化活性研究
韩雅慧1,顾赛麒1,陶宁萍1,*,罗 锋2
(1.上海海洋大学,上海201306; 2.新疆阿拉尔新农甘草有限责任公司,新疆阿拉尔843000)
研究了甘草样品1和甘草样品2中总黄酮的提取方法,分别优化了提取甘草黄酮的工艺条件,采用氧还法测定样品提取前后的总抗氧化活性。结果表明乙醇回流法提取样品1中甘草总黄酮的最佳工艺条件是:乙醇浓度100%,料液比1∶2500,提取温度90℃,提取时间3h;水提法提取样品2中甘草总黄酮提取的最佳工艺条件是:料液比1∶1000,提取温度40℃,提取时间1h。两种甘草样品的总抗氧化活性在一定范围内与浓度呈线性关系,样品1总抗氧化活性提取后比提取前增加了1.25倍,样品2提取后比提取前增加了1.02倍;样品1总黄酮提取率比样品2高约4倍,而样品2提取后的黄酮总抗氧化活性比样品1高,这可能是由于不同样品中甘草黄酮组成的差异以及溶解性差异所致。
甘草黄酮,溶剂提取法,总抗氧化活性
甘草是一种补益中草药,药用部位是根及根茎。甘草有效成份包括黄酮类、三萜类、多糖等。甘草黄酮类物质主要是指具有C6-C3-C6基本母核的一类天然产物,迄今为止,已从甘草中分离出150多个黄酮类化合物,主要包括黄酮醇类、双氢黄酮类、查尔酮类、双氢查尔酮类等[1]。甘草黄酮具有明显的抑菌、抗病毒、抗肿瘤[2]、抗氧化[3]、保肝[4]等药理作用,尤其在发现它具有抗艾滋病病毒[5]作用后,甘草黄酮类化合物的研究引起了人们的广泛关注和重视。目前国内侧重于对甘草甜素的提取分离工艺[6]和药理功能的研究,生产厂家大多数也只局限于甘草酸的提取,黄酮类及其它成分常常被当作残渣而扔掉。由于各种黄酮组成的差异,所以应选择不同的提取方法,而得到的甘草黄酮的成分性质也会存在差异,本文主要针对两种甘草样品的总黄酮提取分离工艺及其抗氧化活性进行研究,以期为进一步高效合理地利用甘草资源提供依据。
1 材料与方法
1.1 材料与仪器
芦丁标准品 上海阿达玛斯试剂有限公司;无水乙醇 分析纯,上海国药;总抗氧化能力试剂盒南京建成生物工程研究所;甘草样品1、甘草样品2均属于乌拉尔甘草,新疆阿拉尔新农甘草有限责任公司提供,将甘草粉碎后加水沸腾提取24h,得到的甘草渣晾至水分含量小于10%,再用浓度80%以上的乙醇提取后真空干燥,制得样品1。将甘草粉碎后加水沸腾提取24h,合并提取液并减压浓缩,水蒸气加热搅拌至水分小于13.5%,制得样品2。两种甘草样品的性质见表1。

表1 甘草样品性质分析比较Table 1 Character analysis of licorice samples
e-10d型电子天平 赛多利斯科学仪器(北京)有限公司;WZ-100S恒温水浴锅 上海申丰科技有限公司;UV-2000型紫外可见分光光度计 尤尼柯(上海)仪器有限公司;88-I型定时恒温磁力搅拌器上海司乐仪器有限公司;DHG-9053A型电热恒温鼓风干燥箱 上海精宏实验设备有限公司。
1.2 实验方法
1.2.1 甘草样品总黄酮的提取[7]
1.2.1.1 浸提溶剂对总黄酮提取率的影响 参考罗锋等人[8]研究和前期预实验结果,样品1选取料液比(W/V,g/mL)1∶1000,温度90℃,提取时间3h,分别采用5个不同的乙醇浓度(60%、70%、80%、90%、100%)采用回流法进行实验。样品2浸提溶剂为蒸馏水,采用水浴搅拌法进行实验。
1.2.1.2 料液比对总黄酮提取率的影响 样品1以乙醇浓度100%,温度90℃,提取时间3h;样品2以提取温度50℃,提取时间2h,并采用6个不同的料液比(1∶500、1∶1000、1∶1500、1∶2000、1∶2500、1∶3000)进行实验。
1.2.1.3 温度对总黄酮提取率的影响 样品1以乙醇浓度100%,料液比1∶2500,提取时间3h,分别采用5个不同的温度(60、70、80、90、100℃);样品2以料液比为1∶1000,提取时间为1h,分别采用8个不同的温度(30、40、50、60、70、80、90、100℃)进行实验。
1.2.1.4 时间对总黄酮提取率的影响 样品1以乙醇浓度100%,料液比为1∶2500,温度为90℃;样品2以料液比1∶1000,温度50℃,分别采用5个不同的提取时间(1、2、3、4、5h)进行实验。
1.2.2 总黄酮提取率的计算
1.2.2.1 芦丁标准曲线的绘制[9]精确称取芦丁标准品50.00mg,用无水乙醇定容至50mL,则芦丁标准液的浓度为1mg/mL。准确移取对照品溶液0、0.1、0.2、0.3、0.4、0.5、0.6、0.7mL,分别加蒸馏水至3mL,加5%亚硝酸钠溶液0.5mL,放置6min,加10%的硝酸铝溶液0.5mL,摇匀,放置6min后加5%的氢氧化钠溶液 2.5mL,混匀,放置 15min后蒸馏水定容至10mL。用紫外分光光度计在510nm处测量其吸光度,以吸光值为纵坐标,芦丁浓度为横坐标,绘制标准曲线。
1.2.2.2 计算公式 提取液稀释后,参照1.2.2.1方法,配制样品液,在510nm处测其吸光度。提取率计算公式为:

其中:C-样品的浓度,根据标准曲线算出;V-样品稀释后的体积;n-稀释的倍数;m-样品的质量。
1.2.3 总抗氧化能力的研究[10-11]样品提取后旋转蒸发浓缩成粉末,取样品提取前后的粉末,样品1用无水乙醇、样品2用蒸馏水稀释成500、1000、2000、4000、6000、8000、10000mg/L测定液备用,采用总抗氧化能力测试盒法[12]。抗氧化能力单位定义为:在37℃下,每分钟每毫升测定液使反应体系吸光度增加0.01为一个总抗氧化能力单位(u/mL)。按式(2)计算总抗氧化能力:
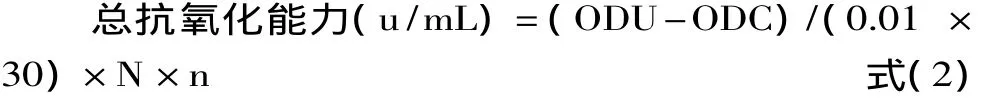
其中:ODU-测定管吸光度值;ODC-对照管吸光度值;N-反应体系稀释倍数(反应液总体积/取样量);n-样本测试前稀释倍数。
2 结果与讨论
2.1 芦丁标准曲线绘制
按照1.2.2.1的方法绘制的标准曲线见图1。
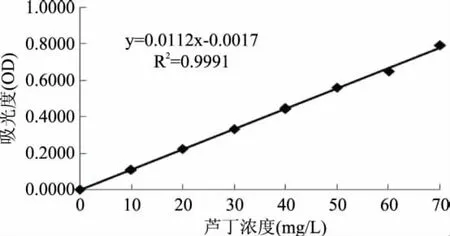
图1 芦丁标准曲线Fig.1 Rutin standard curve
从图1中可以看出,芦丁浓度在0~70mg/L范围内与吸光度线性良好。
2.2 甘草总黄酮提取的单因素实验
2.2.1 浸提溶剂对总黄酮提取率的影响 根据1.2.1的方法实验,乙醇浓度对甘草样品1总黄酮提取率的影响见图2。
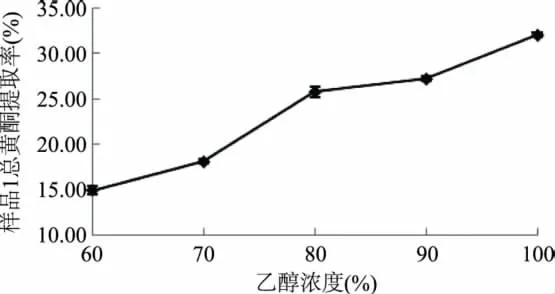
图2 乙醇浓度对样品1总黄酮提取率的影响Fig.2 Effect of concentration of alcohol on yield of licofavone
从图2可知,乙醇浓度为100%(即无水乙醇)时,样品1的总黄酮提取率达到最大值。乙醇浓度增大,其极性变弱,有利于极性较小的黄酮类化合物的溶出,故提取率呈上升趋势。当使用无水乙醇时,由于其极性较小,导致黄酮类物质中黄酮醇、查耳酮等极难溶于水并且极性弱的分子溶出,从而使总黄酮提取率进一步上升。
2.2.2 料液比对总黄酮提取率的影响[13-14]根据1.2.1的方法实验,料液比对甘草总黄酮提取率的影响见图3。
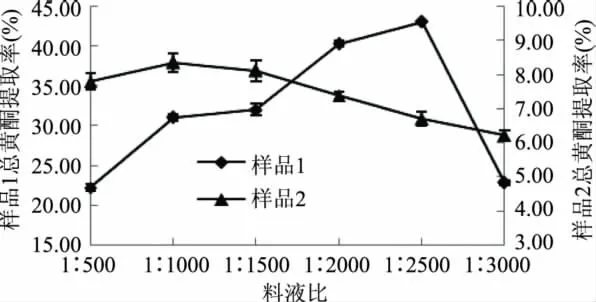
图3 料液比对总黄酮提取率的影响Fig.3 Effect of solid/liquid on yield of licofavone
从图3中可知,总黄酮提取率随着料液比的减小呈先增加后降低趋势,样品1在料液比为1∶2500,样品2在1∶1000时出现峰值。究其原因可能是料液比会影响溶剂的极性,从而导致样品中不同极性黄酮类化合物的溶解性不同,也可能因为料液比直接影响了样品的溶解性。料液比过大时导致样品过饱和现象,从而提取率降低;但随着料液比减小,浸提溶剂用量增加会增加成本,所以选择1∶2500作为样品1的最适料液比,1∶1000作为样品2的最佳料液比。
2.2.3 提取温度对总黄酮提取率的影响 根据1.2.1的方法实验,提取温度对总黄酮提取率的影响见图4。

图4 温度对总黄酮提取率的影响Fig.4 Effect of temperature on yield of licofavone
在图4中,样品1中总黄酮提取率在90℃时达到最高,为32.02%。当温度低于90℃时,黄酮提取率随着温度的升高而上升;当温度在95℃时,黄酮提取率下降,这可能是因为黄酮本身具有还原性,高温使黄酮变性导致的[15]。样品2在温度为40℃时提取率达到最高;在40℃之前,提取率随温度升高而增加,这是由于温度升高有利于黄酮类的溶出,从而提取率上升;当温度高于40℃时,随着温度的升高,水溶性黄酮可能发生水解导致提取率下降。所以样品1和样品2分别选取 90℃和40℃作为最适提取温度。
2.2.4 提取时间对总黄酮提取率的影响 根据1.2.1的方法实验,提取时间对总黄酮提取率的影响见图5。

图5 提取时间对总黄酮提取率的影响Fig.5 Effect of extraction time on yield of licofavone
由图5可知,提取时间不同,样品总黄酮提取率也不同,其中样品1在提取时间为3h时,提取率达到峰值,提取时间少于3h时,由于时间的增大有助于黄酮类化合物的溶出,从而提取率呈上升趋势;超过3h时,由于加热时间的延长,造成部分黄酮糖苷类的分解,从而提取率下降;当时间进一步延长,黄酮的提取率趋于一个平衡值,这是由于黄酮糖苷类分解完全所致[16]。样品2在提取时间为1h时,提取率为最大值;之后提取率下降,可能是由于加热时间过长,导致部分水溶性黄酮类物质的水解,从而提取率下降。
2.2.5 验证实验 样品1在乙醇浓度100%,料液比1∶2500,温度90℃,提取时间3h的优化条件下进行四次重复实验,样品1中的总黄酮提取率平均值高达44.62%;样品2在料液比为1∶1000,温度为40℃,提取时间为1h的优化条件下进行四次重复实验,样品2中总黄酮提取率平均值为10.31%,两种样品提取率差异较大的原因可能是样品1既能溶于乙醇,又能少许溶于水的缘故。两种样品的提取率均高于杨慧[15]等选择NaOH和乙醇的混合溶液作为浸提溶剂,回流法提取内蒙古产甘草渣中黄酮的提取率4.21%,也高于赵丽娜[10]等用80%乙醇回流法提取新疆产乌拉尔甘草中黄酮的提取率。可能原因之一是实验所选用的是经新疆阿拉尔新农甘草有限责任公司初步预处理过的甘草原料。
2.3 甘草样品总抗氧化能力的测定[17]
根据1.2.3的实验方法测定两种甘草样品总黄酮提取前后的总抗氧化能力,实验结果见图6。
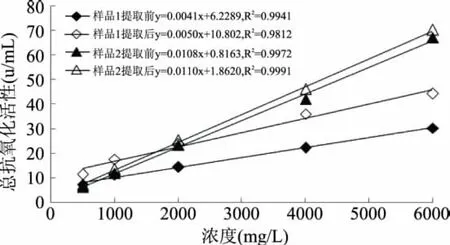
图6 样品提取前后总抗氧化活性的比较Fig.6 Comparison of total antioxidant capacity before and after extraction
结合图6和方程式,可以看出样品的总抗氧化能力都与浓度呈正比,在所给浓度范围内,呈现线性关系。通过公式中斜率的比较可以看出两种样品的抗氧化活性均有提高,样品1提取后比提取前增加了1.25倍,样品2提取后比提取前增加了1.02倍。
当样品浓度达到2000mg/L时,样品2的总抗氧化能力超过了样品1,并随着浓度的增加,其总抗氧化能力快速增加,当浓度为6000mg/L时,提取前样品2总抗氧化能力达到66.97u/mL,而样品1总抗氧化能力仅为30.21u/mL,样品2约为样品1的2倍。两种样品的总抗氧化活性不同,这是因为两种样品中所含有的黄酮类成分不同并且浓度不同所致。验证实验中,样品1总黄酮提取率为44.62%,样品2总黄酮提取率为10.31%,样品1的提取率是样品2的4倍左右,但在总抗氧化能力上样品1只提高了1.25倍,这说明虽然样品1的提取率高,但其提取效率较低。样品2提取后的总黄酮活性较高,值得生产时注意,其中原理还有待进一步分离、提纯,为其在医药和食品上的应用提供理论依据。
3 结论
乙醇回流法提取样品1中甘草总黄酮的最佳工艺条件是:乙醇浓度为100%,料液比1∶2500,提取温度90℃,提取时间3h;水提法提取样品2中甘草总黄酮提取的最佳工艺条件是:料液比1∶1000,提取温度40℃,提取时间1h。并且验证实验中两样品的总黄酮提取率分别达到44.62%和10.31%。
两种甘草样品的总抗氧化活性在一定范围内与浓度呈线性关系,样品1总抗氧化活性提取后比提取前增加了1.25倍,样品2提取后比提取前增加了1.02倍;样品1总黄酮提取率比样品2高4倍,但其总抗氧化活性只增加了1.25倍,其有待进一步研究。
[1]邢国秀,李楠,王童,等.甘草黄酮类化学成份的研究进展[J].中国中药杂志,2003,28(7):593-597.
[2]傅乃武,刘朝阳,张如意,等.G931抗促癌和抑制促癌物诱发的脂质过氧化作用[J].中草药,1995,26(8):411-413,422.
[3]Paula A Belinky,Michael Aviram,Saeed Mahmood,et al. Structural aspects of the inhibltory effect of Glabridin on LDL oxidation[J].Free Radical Biology&X Medicine,1998,24(9): 1419-1429.
[4]王根生,韩哲武.甘草类黄酮对乙醇所致小鼠肝损伤的影响[J].中国药理学通报,1993,9(4):271-273.
[5]抗病毒药用组成物质[P].日本专利:平1-175942,1989.
[6]李振汉,梁开玉.甘草甜素的提取工艺研究[J].重庆工商大学学报:自然科学版,2004,21(6):566-569.
[7]张志东,唐琦勇,茆军,等.甘草黄酮提取方法研究进展[J].新疆农业科学,2006,43(6):517-519.
[8]罗锋,王咏梅,舒尊哲,等.甘草黄酮的提取及影响活性因素研究[J].四川师范大学学报:自然科学版,2006,29(5):613-615.
[9]唐红军.中国药典2000年版一部检测芦丁含量方法的改进[J].中国医院药学杂志,2002,22(1):60.
[10]赵丽娜,王银香,罗锋,等.三种甘草渣甘草黄酮含量及其抗氧化活性比较研究[J].塔里木大学学报,2007,19 (4):14-16.
[11]吴碧华,龙存国,王晓明,等.甘草总黄酮清除羟自由基作用的体外实验探讨[J].川北医学院学报,2001,16(1):3-5.
[12]吕凛.桔皮中黄酮类化合物的超临界二氧化碳萃取工艺研究[D].上海海洋大学,2009:49.
[13]王建安,李艳芝,吴国荣,等.超声波提取抱茎苦荬菜总黄酮工艺的研究[J].南京大学报:自然科学版,2009,32(1): 120-123.
[14]但建明,李文娟,洪成林,等.甘草渣中黄酮类化合物的提取工艺研究[J].石河子大学学报:自然科学版,2004,22 (5):427-428.
[15]杨慧,蒋柏泉,白兰莉.溶剂回流萃取甘草渣黄酮[J].江西化工,2006(3):90-92.
[16]史高峰,韩学哲,陈学福,等.微波辅助提取甘草渣中的总黄酮工艺研究[J].安徽农业科学,2008,36:14153-14154,14184.
[17]徐清萍,钟桂芳,孟君,等.抗氧化剂抗氧化方法研究进展[J].食品工程,2007(2):23-25.
[18]Benzie IF,Strain JJ.The ferric reducing ability of plasma (FRAP)as a measure of“antioxidant power”:the FRAP assay[J].Anal Biochem,1996,239(1):70-76.
[19]李铭花,杨文建,赵政,等.甘草不同极性溶剂提取物抗氧化活性研究[J].粮食与油脂,2009(3):25-27.
[20]Brand Williams W,Cuvelier ME,Berset C.Use of a free radical method to evaluate antioxidant activity[J].Lebensm Wiss Technol,1995,28(1):25-30.
[21]傅乃武,刘朝阳,张如意,等.甘草黄酮类和三萜类化合物抗氧化作用的研究[J].中药药理与临床,1994(5):26.
[22]杨月琴,彭敏,胡凤祖,等.青藏高原藏木香总黄酮提取工艺研究及含量测定[J].食品工业科技,2011(2):251-253.
[23]张梦,金建锋,丰佃玉,等.微波辅助提取甘草黄酮的研究[J].中成药,2002,24(5):334-336.
[24]田庆来,张波,刘会洲.甘草有效成份的药理作用研究进[J].天然产物研究与开发,2006(18):343-347.
[25]刘百萍,马骥,张晓静,等.不同采收时期荚果蕨营养叶中总黄酮含量测定[J].食品工业科技,2011,32(7):407-409.
[26]杨玲,汪河滨,罗锋,等.甘草多糖清除自由基活性的研究[J].塔里木大学学报,2007,19(3):1-3.
[27]Cao G,Alessio HM,Cutler RG.Oxygen-radical absorbance capacity assay for antioxidants[J].Free Radical Biol Med,1993,14(3):303-311.
[28]WANG Cui-ping.Determination of Hydroxyl Radical and Antioxidant Activity of Chinese Herbs by Fluorospectroscopy[J]. Journal of Dezhou University,2007,23(4):40-42.
[29]曾超珍,刘志祥,吴耀辉,等.超声波提取甘草黄酮及其抑茵活性研究[J].时珍国医国药,2007,18(10):2402-2403.
[30]刘红,李炳奇,汪河滨,等.超声时间对甘草黄酮提取率影响的研究[J].黑龙江中医药,2005(1):52-54.
[31]吴亮亮,石雪萍,张卫明.大孔吸附树脂分离纯化花椒总黄酮的研究[J].食品工业科技,2011(7):260-262,266.
[32]韩飞,周孟良,钱健亚,等.抗氧化剂抗氧化活性测定方法及其评价[J].粮油食品科技,2007,17(6):54-57.
Study on the extraction conditions and total antioxidant capacity of licoflavone from two kinds of liquorice samples
HAN Ya-hui1,GU Sai-qi1,TAO Ning-ping1,*,LUO Feng2
(1.College of Food Science and Technology,Shanghai Ocean University,Shanghai 201306,China; 2.Xinjiang Alaer Xinnong Licorice Co.,Ltd.,Alaer 843000,China)
Optimized extraction process conditions of two types of licoflavone including alcohol-soluble sample (sample 1)and water-soluble sample(sample 2)were studied.Total antioxidant capacity of both samples was determined by a total antioxidant capacity test kit.For sample 1,the best extraction result was obtained under following conditions:100%ethanol was used as solvent,samples were extracted at 90℃ for 3h with solid/liquid ratio at 1∶2500.Sample 2 was extracted by hot water,and optimum result was obtained when extracting at 40℃for 1h.Total yield rate of flavone for sample 1 was 4 times higher than that of sample 2,and its total antioxidant capacity was 1.25 times higher than before,indicating that total flavone activity of sample 2 was higher than that of sample 1,maybe the composition and solubility of flavones from both samples are different.
licoflavone;solvent extraction;total antioxidant activity
TS201.2
B
1002-0306(2012)02-0239-04
2011-09-09 *通讯联系人
韩雅慧(1989-),女,硕士研究生,研究方向:食品营养与安全。
