双室型无质子膜MFC协同去除COD和含氮污染物的能力
2012-11-14冉春秋崔玉波赵不凋李海燕孙佳楠
冉春秋,崔玉波,赵不凋,李海燕,孙佳楠,金 政
(1.大连民族学院 环境与资源学院,辽宁 大连 116600;2.大连市金州新区环境保护局,辽宁 大连 116600)
微生物燃料电池(Microbial Fuel Cell,MFC)是利用微生物氧化有机物或无机物产生电流的装置,在阳极区由基质氧化产生的电子传递给阳极,经连接有电阻或负载的导线流到阴极,再传递给阴极区的电子受体[1]。目前,大多数研究人员较多关注MFC的产电能力,而电池结构、内阻、电极材料导电性、产电微生物的代谢以及基质类型和操作条件等都会对电池的产电性能产生影响[2-5],因此对MFC的研究主要集中在产电微生物、电极材料、产电性能和MFC结构及其优化等几方面[1,6]。相对于 MFC的产电能力,笔者认为MFC技术具有反应条件温和、底物广泛、清洁高效等显著优点,因此在污水处理方面的运用更值得深入研究。MFC技术在污水处理上的研究主要集中在单一利用阳极氧化或阴极还原去除水体中的某一污染物,并采用价格昂贵的质子交换膜分割两室[7-9]。如 Clauwaert等采用质子交换膜的MFC系统,以乙酸盐为基质在阳极氧化,电子经外电路传递给阴极的反硝化菌能完全还原NO3--N,但由于阴极超电势的增加,使得反硝化率逐渐降低[7]。能否设计结构合理、无质子交换膜的MFC污水处理系统,耦合阳极氧化和阴极还原2个过程,实现污水中还原性污染物和氧化性污染物高效被去除,这对于降低MFC的使用成本、提高其在污水处理上的实际应用价值是值得深入研究的科学问题。笔者设计了双室型无质子交换膜的MFC污水处理系统,采用不锈钢网做电极,通过驯化、培养厌氧消化菌和反硝化菌分别在阳极和阴极上附着成膜,耦合阳极氧化和阴极还原过程,考察无质子膜MFC污水处理系统协同、高效去除有机污染物和含氮污染物的能力。
1 实验材料和方法
1.1 微生物的驯化培养
厌氧消化菌培养基配方为(mg/L):(NH4)2SO4,30;KH2PO4,30;KHCO3,500;MgSO4,200;FeCl3,100;CaCl2,30;C6H12O6,500;NaNO3,40;反硝化菌培养基配方为(mg/L):(NH4)2SO4,60;KH2PO4,30;KHCO3,500;MgSO4,200;FeCl3,100;CaCl2,30;C6H12O6,200;NaNO3,200。分别接种污水处理厂的厌氧消化污泥和反硝化污泥到密闭的锥形瓶中驯化培养,每天更换培养基1次,并用高纯氮气排除系统内的氧气,培养期间溶液pH值均控制在6.5~7.5之间。控制污泥浓度在3500~4000mg/L,且出水中COD和NO3--N的浓度保持稳定,表明厌氧消化菌和反硝化菌已经驯化好了。
1.2 MFC污水处理系统的构建
阳极室和阴极室均是圆柱形有机玻璃,内径6cm,高10cm,两端采用螺母加盖固定。以网格间距180μm的不锈钢网为电极(45mm×100mm,卷曲成S型),使用前先用1mol/L的硫酸溶液浸泡约30s,洗去表面的油污和杂质等。再分别接种10~20mL驯化好的污泥悬浮液到电池的阳极室和阴极室,下部用磁力搅拌器低速搅拌(100rpm),电极表面附着了均匀、牢固的生物膜后,用培养液冲掉附着不牢的污泥,按照图1的方式连接电池系统,蠕动泵的流速为100mL/h,外接电阻为5000Ω。所有连接部分均采用乳胶管(规格为6mm×9mm)连接。
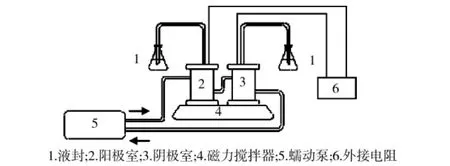
图1 无质子交换膜MFC污水处理系统示意图
1.3 实验用模拟污水和分析测试方法
采用去离子水配制无质子膜MFC处理的模拟污水(mg/L):KH2PO4,30;KHCO3,500;MgSO4,200;CaCl2,30;NaNO3,200;(NH4)2SO4,100;FeCl3,100;C6H12O6,500。添加总体积10%的磷酸缓冲溶液(pH=7),并用高纯氮气排出密闭系统内的氧气,每2d为1个周期更换1次模拟污水。
pH测定:pH计(pHS-25型,上海精科雷磁);电压测定:精密万用表;COD:重铬酸钾微波消解快速测定法;氨氮:纳氏试剂分光光度法;亚硝盐氮:N-(1-萘基)-乙二胺分光光度法;硝酸盐氮:紫外分光光度法。实验数据均为3次测定结果平均值。
2 结果与讨论
2.1 电池系统开路电压变化
可以用开路电压(OCV)来表示MFC系统的产电性能[2],本系统在运行期间的OCV变化如图2所示。将阴极室和阳极室按照图1方式连接运行1d后,电池阴阳极间的OCV由初始的74.2mV迅速降低到8.6mV,这可能是由于将电池阴极室和阳极室连接在一起后,电极液成分、离子强度发生变化,电极表面产电微生物活性和代谢受到部分抑制,因此阴阳两极电压迅速降低。随着两极微生物逐渐适应电极液的变化(表现为电极表面微生物膜逐渐增厚),OCV值也逐渐增加。电池运行6d后,OCV由8.6mV增加到30.6mV;电池运行9d后,OCV迅速增加到126.6mV达到最大;此后OCV逐渐降低到49.5mV(连续运行13d),并稳定维持在50mV左右。电池运行期间OCV值变化表明分别以厌氧消化污泥和反硝化污泥附着在阳极和阴极组成生物电极对构建无质子膜MFC污水处理系统是可行的。
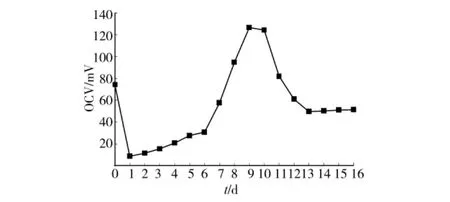
图2 MFC运行期间电极开路电压变化
该MFC系统的OCV明显低于采用质子交换膜分割2室的 MFC系统[5,8,10]。电池结构、内阻、电极材料导电性、产电微生物的代谢以及基质和操作条件等对会对电池的产电性能产生影响[1,6]。该研究的MFC系统在运行期间OCV较低的主要原因可能为:1)大多数MFCs采用能降低阴极反应活化能的催化剂,如碳载铂催化剂来修饰阴极,加快阴极反应速度,降低电化学活化电阻[6],因此OCV值较本系统高。2)相比其它电极材料,如石墨板、碳纤维毡,微生物在不锈钢网上的生长附着能力较弱,降低了该系统的产电能力[11],但由于不锈钢网价格相对比较便宜、易得,所以在本研究中采用不锈钢网作为电极。3)NO3--N作为阴极电子受体的氧化还原电势低于氧气作为阴极电子受体的电池系统[12]。4)电池在运行过程中,由于没有质子膜的分割,阳极微生物和阴极微生物在两极上交互生长,使得阴阳两极间的电势差降低。在无质子交换膜分隔条件下,如何有效降低两电极表面微生物的相互干扰是需要进一步深入研究的问题。该研究的目的是耦合阳极氧化和阴极还原作用,构建无质子交换膜的MFC污水处理系统,实现协同、高效去除污水中的污染物。因此,污染物的协同去除能力是研究中考察的重点。
2.2 有机污染物去除率变化
以COD含量表示污水中有机污染物的去除效果,图3为污水处理系统运行期间系统出水COD去除率变化。由图3可知:随着电池的稳定运行,出水COD的去除率逐渐由65.0%(2d后)增加到88.9%(8d后),表明这期间阳极具有较高的COD去除率。同时,电池的OCV也显著增加(见图2)。电池连续运行8d后,阳极的COD去除率逐渐降低到72.7%(16d),电池的产电能力也相应下降(见图2)。

图3 MFC运行期间COD去除效率变化
MFC运行期间,COD的去除效率主要受阳极厌氧菌的厌氧消化作用和阴极反硝化菌的代谢作用影响。阳极上附着的厌氧微生物通过厌氧消化作用降解一部分有机物,产生的电子和质子可被阴极的反硝化菌利用;同时阴极的反硝化菌在脱氮时需要补充碳源,因此也能直接去除一部分有机物。反硝化脱氮作用对COD去除效率的影响将在后面分析讨论。
2.3 氨氮、亚硝酸盐氮和硝酸盐氮浓度变化
进水中NH4+-N、NO3--N浓度分别为19.09、29.65mg/L,电池运行期间,出水中 NH4+-N、NO2--N和NO3--N浓度变化如图4所示。在电池系统连续运行16d期间,电池系统出水中NH4+-N、NO2--N和NO3--N始终保持较低含量。在运行0~10d期间,出水中的NH4+-N由初始的19.09mg/L降低到1.00mg/L以下,而后迅速增加到14.68mg/L(14d),电池运行结束时出水中的NH4+-N含量为11.06mg/L,去除率最高达到97.7%。出水中NO2--N始终保持较低水平,由最初的0.05mg/L增加到1.25mg/L(10d)后降低到0.12mg/L(16d)。在电池运行的8d内,出水中NO3--N的含量始终低于1.55mg/L,在此后运行的4d内,NO3--N的含量增加到7.16mg/L,在电池运行结束时,出水中NO3--N的含量则降低到2.54mg/L,去除率最高达到98.2%。
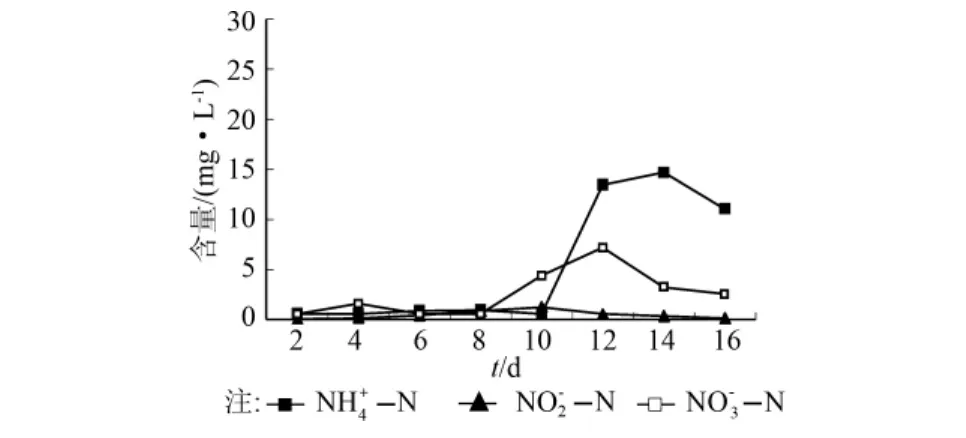
图4 MFC运行期间NH4+-N,NO2--N,NO3--N含量变化
该系统出水中COD和含氮污染物含量变化,表明该结构的MFC污水处理系统具有良好的COD类污染物和含氮污染物的协同去除能力,污染物的去除能力与阳极和阴极微生物的代谢作用紧密相关。MFC系统在运行期间,一部分有机物在阳极区被厌氧消化菌氧化,产生的质子、电子传递给阴极,促进阴极区反硝化菌进行反硝化脱氮;同时,一部分有机物为阴极的反硝化菌提供碳源进行反硝化被直接消耗。已有的研究表明:在反硝化脱氮工艺中以C6H12O6作为电子供体时,当COD/NOx--N介于8.86~53时,反硝化和厌氧消化同时存在[13];在本研究中COD/NO3--N约为16.2,而系统在运行期间对NH4+-N具有明显的去除作用,出水中NO2--N浓度变化趋势与NH4+-N浓度变化一致(图4),这表明在本MFC污水处理系统中同时存在厌氧消化、反硝化和厌氧氨氧化作用。MFC运行8d后,出水中NO3--N的含量增加,表明反硝化作用降低,生成NO2--N的量减少,随后NH4+-N的含量也相应增加,因此这可能是厌氧氨氧化作用减弱所致。因此,将通过对系统中微生物的属性鉴定和调节进水中C6H12O6和NH4+-N的含量来研究电池运行过程中存在的生物脱氮过程。
2.4 无质子膜MFC协同去污能力的比较、分析
分别将附着好厌氧消化菌和反硝化菌的电极置于彼此分开的阳极室和阴极室,并将相同成分的模拟污水注入阳极室和阴极室(模拟污水不能在两室间流动),其余操作条件完全同前。通过测定阳极室和阴极室出水中COD、NH4+-N、NO2--N和NO3--N含量的变化,并与阳极室和阴极室连通时污染物去除能力相比较,来研究耦合阳极氧化和阴极还原作用对有机污染物和含氮污染物协同去除能力的影响。
2.4.1 阳极室和阴极室内有机污染物去除率变化
图5为阳极室和阴极室分开时,分别附着在阳极和阴极上的厌氧消化污泥和反硝化污泥对COD的去除效果。运行2d后,阳极室和阴极室内有机污染物的去除率分别为30.8%和8.5%;阳极室内的有机污染物仅能通过厌氧消化菌呼吸代谢作用去除,可能是较高浓度的氨氮对厌氧消化污泥代谢的抑制作用[14],因此在连续运行期间COD的去除效率始终较低,16d后逐渐减低到22.6%;在阴极室内,运行8d后COD的去除效率增加到36.7%,高于阳极室的22.3%,此后运过程中阴极室内COD的去除效率均高于阳极室内COD的去除效率。阳极室和阴极室分开后,各自COD的去除率均低于MFC系统内COD的去除率,且分开两室内COD去除率之和也略低于两室连通时MFC的去除率(图3)。
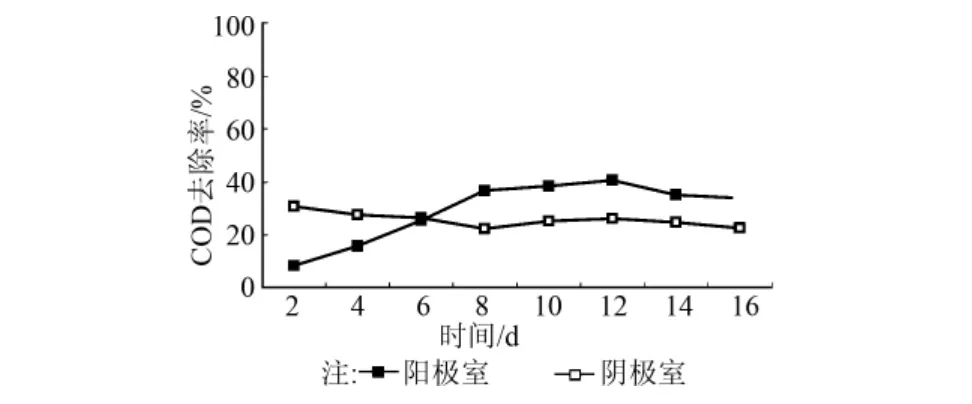
图5 阳极室、阴极室内COD去除率变化
2.4.2 阳极室和阴极室内含氮污染物浓度变化
图6、图7分别为分开的阳极室和阴极室内,“三氮”污染物浓度变化。在阳极表面附着的厌氧消化菌对含氮污染物没有明显的去除能力,在连续运行的16d内,阳极室出水中NH4+-N和NO3--N的浓度只略有降低,分别由进水的19.09mg/L和29.65mg/L降低到15.6mg/L和25.22mg/L,最高去除率分别为20.1%和15.4%;而出水中NO2--N有明显的积累,其浓度介于1.46~3.09mg/L之间。阴极表面附着的反硝化菌和厌氧氨氧化菌对含氮污染物具有明显的去除作用,因此阴极室出水中NH4+-N和NO3--N的去除效果明显优于阳极室。2d后出水中NH4+-N的浓度为8.24mg/L,在8d时逐渐增加到11.27mg/L,16d时降低到10.23mg/L;NO3--N的浓度在24d后达到9.32mg/L,在第6d时增加到11.88mg/L,在16d后为12.18mg/L,最高去除率分别为56.8%和68.6%;而NO2--N的浓度始终低于2.68mg/L。可见当阳极室和阴极室分开时,出水中NH4+-N、NO3--N的去除率之和均明显低于MFC系统的去除率。

图6 阳极室内NH4+-N,NO2--N,NO3--N含量变化
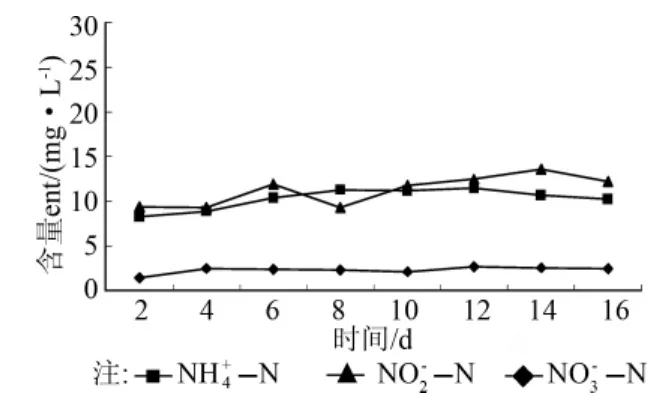
图7 阴极室内NH4+-N,NO2--N,NO3--N含量变化
对比该MFC系统和分开的阳极室、阴极室内NH4+-N、NO3--N、NO2--N和COD浓度变化,可分析、比较耦合阳极氧化和阴极还原对COD去除和生物脱氮的协同促进作用。在厌氧条件下,分开的阴极室内NH4+-N主要是通过厌氧氨氧化途径被去除,以分开阴极室内COD去除率最高的时间点(12d)为例进行计算:此时 NH4+-N 是11.45mg/L,去除了7.64mg/L,通过厌氧氨氧化途径消耗的NO2--N也应为7.64mg/L左右;此时阴极室内NO2--N、NO3--N分别为2.68和12.44mg/L,因此通过反硝化途径直接去除的NO3--N为6.89mg/L;以C6H12O6作为电子供体进行反硝化时,每彻底还原1mol NO3--N成N2约需要消耗 0.208mol C6H12O6,生成1mol NO2--N需要消耗0.083mol C6H12O6[13],因此消耗的C6H12O6换算成COD为31.20mg/L,而阴极室COD的总的去除率为194.14mg/L,剩下的162.94mg/L可能是通过厌氧消化途径被去除的,这与0~12d内分开阴极室内COD的去除率逐渐由8.5%增加到40.7%相一致(图5),这表明在阴级上可能逐渐附着生长了厌氧消化菌。这与当COD/NOx--N介于8.86~53时,反硝化和厌氧消化过程同时存在的结论也一致[13]。而在该 MFC系统中,NH4+-N、NO3--N和COD的去除率均明显高于分开的阳极室和阴极室,这表明该MFC运行时一部分有机物在阳极区被厌氧微生物氧化,产生的质子、电子传递给阴极,促进阴极上反硝化菌进行反硝化脱氮;同时,一部分有机物作为碳源在阴极被反硝化菌直接消耗掉。可见该无质子膜MFC污水处理系统通过耦合阳极氧化和阴极还原过程,有机污染物和含氮污染物的去除过程具有明显的相互协同、促进作用。
3 结 论
1)以间距180μm的不锈钢网为电极作为阴、阳极,分别由附着在阳极、阴极的厌氧消化菌、反硝化菌组成生物阳极和生物阴极,构建双室型无质子交换膜MFC污水处理系统,耦合阳极氧化和和阴极还原过程,实现有机污染物和含氮污染物的同时、高效去除,降低了微生物燃料电池的使用成本,提高了MFC在污水处理中的运用价值。
2)在进水中COD、NH4+-N和 NO3--N浓度分别为477、19.09和29.65mg/L时,该 MFC系统的最大产电能力为126.6mV,此时出水中COD、NH4+-N和 NO3--N的浓度分别为50.18、0.95和0.55mg/L,这表明该污水处理系统具有良好的COD类污染物和含氮污染物的协同去除能力。
3)比较阳极室和阴极室分开时COD、NH4+-N和NO3--N的去除效果,结果表明分开的阳极室和阴极室出水中COD、NH4+-N和NO3--N的去除率均明显低于阳极室和阴极室连通组成MFC系统时的去除效果,这说明无质子膜的MFC系统通过耦合阳极氧化和阴极还原过程,具有明显的污染物协同去除能力。
[1]Logan B E,Regan J M.Microbial fuel cells-challenges and applications [J]. Environmental Science &Technology,2006,40(17):5172-5180.
[2]Aelterman P, Rabaey K, Thepham H,et al.Continuous electricity generation at high voltages and currents using stacked microbial fuel cells [J].Environmental Science & Technology,2006,40(10):3388-3394.
[3]Fan Y Z,Hu H Q,Liu H.Sustainable power generation in microbial fuel cells using bicarbonate buffer and proton transfer mechanisms [J].Environmental Science & Technology,2007,41(23):8154-8158.
[4]冯玉杰,王鑫,李贺,等.乙酸钠为基质的微生物燃料电池产电过程 [J].哈尔滨工业大学学报,2007,39(12):1890-1894.FENG Yujie,WANG Xin,LI He,et al.Research on electricity generation process in microbial fuel cell based on sodium acetate[J].Journal of Harbin Institute of Technology,2007,39(12):1890-1894.
[5]张金娜,赵庆良,尤世界,等.生物阴极微生物燃料电池不同阴极材料产电特性 [J].高等学校化学学报,2010,31(6):162-166.ZHANG Jinna,ZHAO Qingliang,YOU Shijie,et al.Power generation in bio-cathode microbial fuel cell with different cathode materials [J].Chemical Journal of Chinese Universities,2010,31(6):162-166.
[6]黄霞,梁鹏,曹效鑫,等.无介体微生物燃料电池的研究进展 [J].中国给水排水,2007,23(4):1-6.HUANG Xia,LIANG Peng,CAO Xiaoxin,et al.Progress in research of mediator-less microbial fuel cells[J].China Water & Wastewater,2007,23(4):1-6.
[7]Clauwaert P,Rabaey K,Aelterman P,et al.Biological denitrification in microbial fuel cells[J].Environmental Science & Technology,2007,41(9):3354-3360.
[8]温青,吴英,王贵领,等.双极室联合处理啤酒废水的微生物燃料电池 [J].高等学校化学学报,2010,31(1):1231-1234.WEN Qing, WU Ying, WANG Guiling,et al.Microbial fuel cell using sequential anode-cathode to treat brewery wastewater [J].Chemical Journal of Chinese Universities,2010,31(1):1231-1234.
[9]梁鹏,张玲,黄霞,等.双筒型微生物燃料电池生物阴极反硝化研究 [J].环境科学,2010,31(8):1932-1936.LIANG Peng,ZHANG Ling,HUANG Xia,et al.Biocathode denitrification in a two-columnar microbial fuel cell[J].Environmental Science,2010,31(8):1932-1936.
[10]邹勇进,孙立贤,徐芬,等.以新亚甲基蓝为电子媒介体的大肠杆菌微生物燃料电池的研究[J].高等学校化学学报,2007,28(3):510-513.ZOU Yongjin,SUN Lixian,XU Fen,et al.E.coli microbial fuel cell using new methylene blue as electron mediator[J].Chemical Journal of Chinese Universities,2007,28(3):510-513.
[11]王万成,陶冠红.微生物燃料电池运行条件的优化[J].环境化学,2008,27(4):527-530.WANG Wancheng,TAO Guanhong.Optimization of factors affecting the performance of microbial fuel cells[J].Environmental Chemistry,2008,27(4):527-530.
[12]毛艳萍,蔡兰坤,张乐华,等.生物阴极微生物燃料电池 [J].化学进展,2009,21(7/8):1672-1677.MAO Yanping,CAI Lankun,ZHANG Lehua,et al.Biocathodes in microbial fuel cells [J].Progress in Chemistry,2009,21(7/8):1672-1677.
[13]Akunna J C,Bizeau C,Moletta R.Denitrification in anaerobic digesters:possibilities and influence of wastewater COD/N-NOxratio [J]. Environmental Technology,1992,13(9):825-836.
[14]于芳芳,伍健东.氨氮对厌氧颗粒污泥产甲烷菌的毒性研究 [J].化学与生物工程,2008,25(4):75-78.YU Fangfang, WU Jiangdong.Toxicity study of ammonium on methanogenic bacteria in anaerobic granular sludge [J].Chemistry & Bioengineering,2008,25(4):75-78.
