amiRNA-Snai1 逆转人胃癌细胞株SGC7901/DDP对顺铂的耐药性及其机制研究*
2012-11-08许春红郭慧敏李建琦邹晓平
许春红 郭慧敏 王 军 李建琦 陈 敏 邹晓平
南京医科大学附属鼓楼临床医学院消化科1(210008)南京大学医学院附属鼓楼医院消化科2
多药耐药是恶性肿瘤化疗失败的主要原因。Snai1 为锌指转录因子Snail 家族成员之一,研究显示其可通过调控下游靶基因E-钙黏蛋白(Ecadherin)等的表达介导肿瘤细胞发生上皮间质转化(epithelial-mesenchymal transition,EMT),促进肿瘤侵袭转移[1~3]。此外,有研究发现包括Snai1 及其调控的信号通路在内的EMT 相关基因与肿瘤耐药相关,肿瘤细胞发生EMT 可促成肿瘤对化疗耐药[4~6]。本研究以人工合成microRNA(artificial microRNA,amiRNA)-Snai1 质粒转染对顺铂(cisplatin,DDP)耐药的人胃癌细胞株SGC7901/DDP 以沉默Snai1 基因表达,通过观察SGC7901/DDP 细胞中Snai1、Ecadherin和耐药基因切除修复交叉互补基因1(ERCC1)蛋白表达的变化及其对DDP 敏感性的变化,探讨amiRNA-Snai1 逆转SGC7901/DDP 细胞对DDP 耐药性的作用及其可能机制,为进一步明确Snai1 及其调控的信号通路在胃癌多药耐药中的作用提供实验依据。
材料与方法
一、肿瘤细胞株和主要试剂
人中分化胃腺癌细胞株SGC7901、SGC7901/DDP和amiRNA-Snai1 真核表达质粒为南京医科大学附属鼓楼临床医学院消化科实验室冻存或构建;DDP(齐鲁制药有限公司);LipofectamineTM2000转染试剂、杀稻瘟素、荧光二抗、DAPI(invitrogenTM,Life Technologies Corporation);兔抗人Snai1+Snai2多克隆抗体、小鼠抗人ERCC1 单克隆抗体(Abcam plc.),兔抗人E-cadherin 单克隆抗体(Cell Signaling Technology,Inc.);CCK-8 试剂盒(日本株式会社同仁化学研究所)。
二、实验方法
1.细胞培养:SGC7901、SGC7901/DDP 细胞以含10%胎牛血清的RPMI1640 培养基培养于37 ℃、5% CO2培养箱中,常规消化传代。SGC7901/DDP细胞培养基中含终浓度0.1 mg/L 的DDP。
2.稳定转染细胞株的构建和鉴定:取对数生长期SGC7901/DDP 细胞,参照LipofectamineTM2000 转染试剂说明书将amiRNA-Snai1 真核表达质粒和阴性对照质粒分别转染入细胞中(SGC7901/DDP-amiRNA组和SGC7901/DDP-Mock组),转染24 h 后以杀稻瘟素(5 μg/mL)筛选,采用有限稀释法将存活细胞接种于96 孔板培养15 d,获得稳定转染单克隆,以含杀稻瘟素维持浓度2.5 μg/mL 的培养基继续培养。蛋白质印迹法和免疫荧光法检测稳定转染细胞株的Snai1 蛋白表达,以明确amiRNA的沉默效应。
3.CCK-8 法检测细胞存活率:此实验步骤设SGC7901/DDP-amiRNA、SGC7901/DDP-Mock、SGC7901/DDP 三组。将细胞悬液(1×104/mL)接种于96 孔板,200 μL/孔。细胞贴壁后,弃原培养基,加入含终浓度0.01、0.1、1.0、10.0 mg/L DDP的培养基,另设不加药物的对照组和不接种细胞、仅加入培养基的调零孔,每组设3个复孔。细胞培养24 h后,弃含药培养基,加入新鲜配制的CCK-8 溶液100 μL/孔,继续培养1 h 后终止培养,于酶标仪450 nm 波长处读取各孔A 值,取3个复孔的均值。实验重复3 次。细胞存活率=A实验组/A对照组×100%。绘制不同药物浓度的细胞相对存活率曲线,计算DDP 对细胞的半数抑制浓度(IC50)。
4.蛋白质印迹法检测Snai1、ERCC1、E-cadherin 蛋白表达:细胞以PBS 漂洗,加入细胞裂解液,冰浴震荡30 min,4 ℃12 000 r/min 离心10 min(离心半径7.5 cm),收集上清,BCA 法测定蛋白浓度。取30 μg 总蛋白上样,蛋白变性后电泳,转膜,封闭。分别加入Snai1 一抗(1∶1000 稀释)、ERCC1一抗(1∶500 稀释)、E-cadherin 一抗(1∶1000 稀释)4 ℃孵育过夜,洗膜后加入1∶2000 稀释的羊抗兔IgG(检测Snai1、E-cadherin)或羊抗鼠IgG(检测ERCC1),室温孵育2 h,洗膜后加入ECL 试剂,暗室曝光,显影,定影。以α-tubulin(1∶1000 稀释)为内参照,应用Quantity One 4.4.0 凝胶图像分析软件分析目的蛋白相对表达量。
5.免疫荧光法检测Snai1、ERCC1、E-cadherin蛋白表达:将0.3%明胶预处理玻片置入6 孔板中,每孔接种2×105个细胞,培养24 h 后取出玻片,冷丙酮固定30 min,山羊血清封闭1 h,Snai1 一抗(1∶100 稀释)、ERCC1 一抗(1∶50 稀释)、E-cadherin 一抗(1∶100 稀释)4 ℃孵育过夜,荧光二抗(1∶75 稀释)孵育1 h,DAPI(2 μg/mL)细胞核染色,l h 内荧光显微镜摄影。
三、统计学分析
结 果
一、SGC7901/DDP 细 胞Snai1、ERCC1、E-cadherin 蛋白表达变化
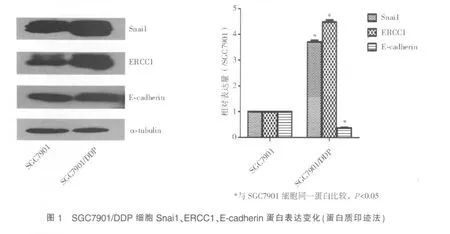
蛋白质印迹法检测显示,DDP 耐药SGC7901/DDP 细胞中的Snai1、ERCC1 蛋白相对表达量分别增高至DDP 敏感亲本SGC7901 细胞的(3.702±0.126)倍、(4.489±0.140)倍,E-cadherin 蛋白相对表达量降低至DDP 敏感亲本SGC7901 细胞的(0.375±0.049)倍,差异均有统计学意义(P<0.05)(见图1)。
二、稳定转染amiRNA-Snai1 的SGC7901/DDP细胞Snai1、ERCC1、E-cadherin 蛋白表达变化
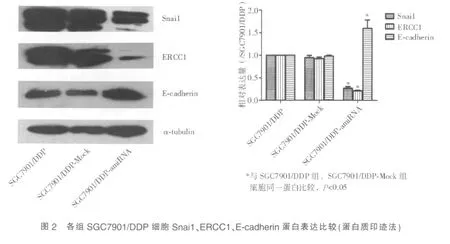
蛋白质印迹法和免疫荧光法检测显示,稳定转染amiRNA-Snai1 的SGC7901/DDP-amiRNA组 细胞,Snai1、ERCC1 蛋白相对表达量显著低于转染阴性对照质粒的SGC7901/DDP-Mock组细胞(Snai1:0.268±0.035 对0.947±0.049,P<0.05;ERCC1:0.211±0.012 对0.925±0.033,P<0.05),荧光强度较SGC7901/DDP组细胞明显减弱;E-cadherin 蛋白相对表达量显著高于SGC7901/DDP-Mock组细胞(1.591±0.186对0.979±0.022,P<0.05),荧光强度较SGC7901/DDP组细胞明显增强(见图2、图3)。

三、稳定转染amiRNA-Snai1 对SGC7901/DDP细胞对DDP 敏感性的影响
经不同浓度(0.01、0.1、1.0、10.0 mg/L)DDP 作用24 h,稳定转染amiRNA-Snai1 的SGC7901/DDPamiRNA组细胞相对存活率分别为82.43%±0.06%、55.06%±0.06%、16.59%±0.06%、6.68%±0.06%,IC50值为(0.116±0.017)mg/L;而经上述浓度DDP 作用的转染阴性对照质粒的SGC7901/DDP-Mock组细胞,相对存活率分别为95.96%±0.05%、87.87%±0.07%、60.20%±0.08%、9.60%±0.06%,IC50值 为(2.344±0.155)mg/L。DDP 对SGC7901/DDP-amiRNA组细胞的IC50值显著低于SGC7901/DDP-Mock组细胞(P<0.05)(见图4)。
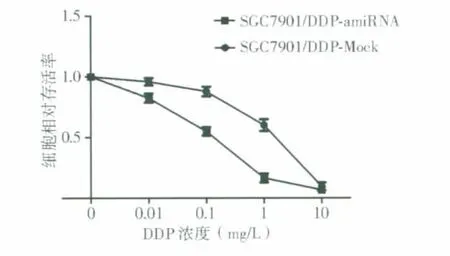
图4 稳定转染amiRNA-Snai1 对SGC7901/DDP 细胞对DDP 敏感性的影响
讨 论
在肿瘤的发生、发展过程中,肿瘤细胞可发生EMT,即上皮性肿瘤细胞失去极性,转分化为具有运动能力的间质细胞[7]。EMT 使肿瘤细胞具有间质细胞表型,从而影响肿瘤的分化、侵袭、转移等多种生物学行为,并使肿瘤对化疗产生抵抗[4~6]。然而,EMT 的发生涉及多个信号通路和复杂的分子机制,其引起肿瘤耐药的确切机制尚未完全阐明[8~10]。
锌指转录因子Snail 家族是生物体内的一类碱性螺旋-环-螺旋(basic helix-loop-helix,bHLH)转录因子,其家族成员,尤其是Snai1 被认为是肿瘤细胞发生EMT 的重要调控因子,可通过与上皮细胞黏附分子E-cadherin 启动子区的E-box 作用元件结合而抑制E-cadherin 基因转录,下调E-cadherin表达,使上皮细胞向间质细胞表型转化,最终引起EMT[1,2]。本研究蛋白质印迹法检测显示,DDP 耐药SGC7901/DDP 细胞中的Snai1 蛋白相对表达量较DDP 敏感亲本SGC7901 细胞显著增高,且有研究[11]发现抑制E-cadherin 可通过诱导EMT 增强肿瘤细胞的耐药性,由此推测SGC7901/DDP 细胞中Ecadherin 蛋白呈低水平表达。本研究蛋白质印迹法检测验证了这一推测。
胃癌细胞株经DDP 诱导建立耐药株后,其对DDP 的耐受性增强与细胞对DNA 损伤的修复能力增强有关,ERCC1 基因在其中起关键作用[12]。研究[13]显示Snai1 可直接调节ERCC1 基因转录,通过上调ERCC1 表达促成肿瘤对DDP 耐药。本研究蛋白质印迹法检测证实DDP 耐药SGC7901/DDP 细胞中的Snai1、ERCC1 蛋白相对表达量较DDP 敏感亲本SGC7901 细胞显著增高。
为进一步明确Snai1 及其调控的信号通路在胃癌多药耐药中的作用,本研究以amiRNA-Snai1沉默DDP 耐药SGC7901/DDP 细胞的Snai1 基因表 达,通过观察SGC7901/DDP 细胞中Snai1、Ecadherin、ERCC1 蛋白表达的变化及其对DDP 敏感性的变化,探讨amiRNA-Snai1 逆转SGC7901/DDP细胞对DDP 耐药性的作用及其可能机制。蛋白质印迹法检测显示,稳定转染amiRNA-Snai1 的SGC7901/DDP 细胞Snai1、ERCC1 蛋白相对表达量显著降低,E-cadherin 蛋白相对表达量显著增高,免疫荧光法检测结果与蛋白质印迹法呈相同趋势。DDP 对稳定转染amiRNA-Snai1 SGC7901/DDP 细胞的IC50值显著降低,表明amiRNA-Snai1 能增加SGC7901/DDP 细胞对DDP 的敏感性。
综上所述,以amiRNA-Snai1 沉默Snai1 基因表达可能通过下调ERCC1 表达、上调E-cadherin表达而逆转耐药人胃癌细胞株SGC7901/DDP 对DDP 的耐药性。由此提示Snai1 上调ERCC1 表达、下调E-cadherin 表达是胃癌细胞发生EMT、促成胃癌对DDP 耐药的关键因素,这一发现为克服胃癌治疗中的DDP 耐药提供了新的研究思路。目前EMT 引起肿瘤耐药的确切机制尚未完全阐明,逆转肿瘤对DDP 耐药的调控通路仍有待进一步研究。
1 Nieto MA.The snail superfamily of zinc-finger transcription factors[J].Nat Rev Mol Cell Biol,2002,3(3):155-166.
2 Cano A,Pérez-Moreno MA,Rodrigo I,et al.The transcription factor snail controls epithelial-mesenchymal transitions by repressing E-cadherin expression[J].Nat Cell Biol,2000,2 (2):76-83.
3 Medici D,Hay ED,Olsen BR.Snail and Slug promote epithelial-mesenchymal transition through beta-catenin-Tcell factor-4-dependent expression of transforming growth factor-beta3[J].Mol Biol Cell,2008,19 (11):4875-4887.
4 Haslehurst AM,Koti M,Dharsee M,et al.EMT transcription factors snail and slug directly contribute to cisplatin resistance in ovarian cancer[J].BMC Cancer,2012,12 (1):91.
5 Arumugam T,Ramachandran V,Fournier KF,et al.Epithelial to mesenchymal transition contributes to drug resistance in pancreatic cancer[J].Cancer Res,2009,69(14):5820-5828.
6 Saxena M,Stephens MA,Pathak H,et al.Transcription factors that mediate epithelial-mesenchymal transition lead to multidrug resistance by upregulating ABC transporters[J].Cell Death Dis,2011,2 (7):e179.
7 Thiery JP.Epithelial-mesenchymal transitions in tumour progression[J].Nat Rev Cancer,2002,2 (6):442-454.
8 Shah AN,Summy JM,Zhang J,et al.Development and characterization of gemcitabine-resistant pancreatic tumor cells[J].Ann Surg Oncol,2007,14 (12):3629-3637.
9 Rosanò L,Cianfrocca R,Spinella F,et al.Acquisition of chemoresistance and EMT phenotype is linked with activation of the endothelin A receptor pathway in ovarian carcinoma cells[J].Clin Cancer Res,2011,17 (8):2350-2360.
11 Chen X,Wang Y,Xia H,et al.Loss of E-cadherin promotes the growth,invasion and drug resistance of colorectal cancer cells and is associated with liver metastasis[J].Mol Biol Rep.2012 Feb 7.Epub ahead of print.
12 Li Q,Dang CX,Liu ZG,et al.ERCC1 expression is a predictor of survival in gastric cancer patients treated with surgery and adjuvant chemotherapy[J].Chinese-German Journal of Clinical Oncology,2011,10 (2):92-95.
13 Hsu DS,Lan HY,Huang CH,et al.Regulation of excision repair cross-complementation group 1 by Snail contributes to cisplatin resistance in head and neck cancer[J].Clin Cancer Res,2010,16 (18):4561-4571.
