应用双球囊灌注导管局部注射紫杉醇对犬冠状动脉支架内再狭窄的预防作用
2012-11-08王锦达杨庭树孙志军陈韵岱
王锦达,杨庭树,孙志军,郭 军,田 峰,陈韵岱
中国人民解放军总医院心内科心脏介入中心,北京100853
冠状动脉植入支架与单纯球囊扩张相比,可显著降低血管夹层、急性闭塞的发生率,但支架内再狭窄问题日益突出[1-2]。组织学研究显示,与传统的球囊成形术相比,支架植入更明显地触发了血管新生内膜的增殖,且动脉内皮细胞增殖过程显著延长。动物实验显示支架金属丝对动脉的损伤程度与新生内膜厚度、支架内狭窄程度之间显著相关[3]。因此,支架内再狭窄的主要机制是长期过度的血管内膜、平滑肌细胞增殖和细胞外基质形成的结果[4]。药物洗脱支架与金属裸支架相比,可显著降低再狭窄率,但随着药物洗脱支架的大量应用,逐渐出现支架部位血管瘤样扩张、晚期血栓形成等致死性并发症的报道[5-6],分析其原因可能主要与支架上的多聚物涂层有关。
双球囊灌注导管可以将紫杉醇直接灌注到靶病变部位,且紫杉醇为脂溶性药物,具有高亲脂性的特点,可以快速转移到血管内膜,达到抑制内膜、平滑肌增殖,减轻支架内再狭窄发生的效果,并且在冠状动脉腔内不留有任何药物载体,避免了多聚物的不良反应。本研究旨在利用动物实验模型,评价应用双球囊灌注导管在冠状动脉内局部灌注紫杉醇预防支架内再狭窄的有效性和安全性。
材料和方法
主要试剂与仪器
紫杉醇:取0.1 ml的紫杉醇溶解于34.9 ml的生理盐水中,制备成20 μmol/L的实验用药。
双球囊灌注导管:本研究使用的双球囊灌注导管 (瑞士Acrostak公司)均为3.0 mm×20 mm,导管直径为3F(图1)。最远端的灌注部分包括2个阻塞球囊和球囊中间的灌注区域,灌注时,阻塞球囊直径达到3 mm,灌注区域直径为2 mm;远端球囊的内侧分布有3个侧孔用来灌注药物,此灌注部分通过中心腔和末端连接口连接于压力泵;灌注球囊的工作压为303 kPa。
动物模型本研究在解放军总医院动物实验室完成,随机选取15只杂种犬作为实验组,5只作为对照组。冠状动脉损伤模型的制作方法参照Schneider等[7]的方法进行。实验动物术前12 h喂食阿司匹林和硫酸氢氯吡格雷,静脉全身麻醉,给予心电监护,穿刺右侧股动脉植入6F动脉鞘,按照1 mg/kg的剂量动脉内注射普通肝素。调整指引导管进入左主干开口,行左冠状动脉造影显示前降支和回旋支,选择直径为2.75~3.0 mm且无直径大于1 mm分支的冠状动脉作为靶血管段,送入3.0~3.5 mm×8 mm的预扩张球囊到达靶血管段,以1010~1616 kPa的压强反复扩张3~4次,每次持续15 s,每次间隔2 min。实验组用高压注射器抽取配制好的20 μmol/L紫杉醇溶液10 ml,并连接于双球囊灌注导管的末端,沿冠状动脉成形术 (percutaneous transluminal coronary angioplasty,PTCA)导丝送入双球囊灌注导管到达预损伤的靶血管段,确定损伤血管段完全被灌注球囊的灌注部分覆盖,维持303 kPa灌注紫杉醇溶液,对照组抽取10 ml生理盐水对靶血管进行灌注,灌注时间为(26.45±5.18)s。最后沿导丝送入3.0 mm×8 mm的316L不锈钢金属裸支架 (LP-STENT,Boston Scientific)到达靶血管段,以808~1010 kPa的压强释放,支架膨胀良好。继续观察实验动物30 min,心率、血压无异常,送回动物饲养室观察,每天喂食阿司匹林100 mg和硫酸氢氯吡格雷50 mg。
图1 双球囊灌注导管Fig 1 Double-balloon perfusion catheter
冠状动脉造影分析支架植入3个月后首先行冠状动脉造影复查,进行冠状动脉造影计算机定量分析 (quantitative coronary angiography,QCA),测量靶血管狭窄情况,观察是否有瘤样扩张、血栓形成或血管闭塞等并发症。冠状动脉造影复查靶血管直径狭窄≥50%定义为再狭窄。
光学相干断层成像分析冠状动脉造影复查后行光学相干断层成像 (optical coherence tomography,OCT)检查,OCT成像及分析应用M2 OCT成像系统完成。应用OCT系统内的软件进行定量分析,测量工作由2名熟练技师完成,观察所有支架金属丝被内膜覆盖情况,选择每枚支架内直径最小处管腔测量各项指标,并测量此切面支架近端的距离,以便获得同一切面的病理切片进行分析。
组织学分析OCT检查结束后处死动物,快速取出心脏,用50 ml注射器抽取肝素盐水反复冲洗左冠状动脉直至血液完全被冲洗干净,保证血管内无残余血栓,用高压注射器抽取10%福尔马林溶液维持808 kPa灌注靶血管10 min,然后分离出靶血管段,用黑色细线标记血管近端。标本保存于10%福尔马林溶液,最后统一行病理切片分析,常规脱水处理后用甲基丙烯酸甲酯进行固定包埋,以专用的冠状动脉支架切片刀 (LEICA RM 2255,乐普医疗器械公司)进行切片,每张切片厚度为7 μm,采用HE染色。根据OCT记录支架内直径最小处距支架近端边缘的距离,选取此位置行病理切片并在显微镜下测量各项指标。
OCT和组织学检查测量指标(1)新生内膜厚度 (mm):测量支架每个金属丝到达血管内膜的垂直距离,取其平均值。(2)残余管腔面积 (mm2):血管腔的实际面积,边界为血管内膜。(3)新生内膜面积 (mm2):以支架为外边界,以内膜为内边界,测量其间的总面积,即支架内膜增生的面积。(4)支架面积 (mm2):以支架为边界,测定所包含的面积。(5)外弹力膜面积 (mm2):以外弹力膜为边界,测定所包含的面积。(6)狭窄程度 (%)=新生内膜面积/支架面积 (%)。
统计学处理应用统计学软件SPSS 11.0进行统计学处理。计量资料以均数±标准差表示,所有数据均符合正态分布,采用t检验;计数资料以率或百分数表示,采用卡方检验;以P<0.05为差异有统计学意义。
结 果
一般情况所有实验动物均完成本研究,双球囊灌注导管顺利完成局部药物注射。所有动物心电图均记录到ST段压低或抬高的情况,灌注结束后,ST段迅速恢复到灌注之前的形态,心率波动在140~190次/min,未出现室速、室颤等恶性心律失常。随访过程中,1例动物股动脉穿刺处出现血肿,未影响本研究进行。
冠状动脉造影结果3个月后冠状动脉造影复查发现两组均有部分支架段的影像学异常,QCA显示实验组再狭窄发生率为33.33%,对照组为60%,对照组再狭窄发生率显著高于实验组,差异有统计学意义 (P<0.05)。两组的典型QCA分析图见图2。
OCT分析结果3个月后OCT检查示两组支架均完全内皮化,无血栓、局部瘤样扩张,对照组支架内膜增生程度明显强于实验组 (表1,图3)。
组织学检查结果所有组织标本取出后均未见血管内有新鲜或者陈旧性血栓形成,行病理分析,所有标本支架内可见不同程度的内膜增生,增生成分主要以内膜增殖为主,平滑肌细胞增生及迁移不明显。未见到血栓、瘤样扩张或血管壁细胞坏死,其中一张切片有脂肪滴侵入,为切片过程中所致。所有切片支架均完全内皮化,支架金属丝基本均匀分布于血管内膜下,内膜明显增厚,血管腔变窄,部分标本内弹力纤维被支架金属丝压断,部分标本内弹力纤维被挤压变形但结构完整,两种情况平滑肌增生基本相似,未见平滑肌细胞严重增生的情况。所有标本在新生内膜和平滑肌细胞中均可见到轻度的炎症反应,炎症细胞均匀散在分布于新生组织中,支架金属丝周围未出现炎症细胞过度聚集的情况。对照组标本血管内膜增生出现不对称、管腔狭窄较重且呈不规则状的特点,实验组支架内增生明显较对照组轻 (图4),且增生基本均匀对称。实验组内膜增殖明显弱于对照组 (表2)。

图2 支架植入3个月后冠状动脉造影计算机定量分析图Fig 2 Images of quantitative coronary angiography 3 months after stent implantation
表1 支架植入3个月后冠状动脉靶血管段OCT结果 (±s)Table 1 OCT parameters of target segment of coronary artery 3 months after stent implantation(±s)

表1 支架植入3个月后冠状动脉靶血管段OCT结果 (±s)Table 1 OCT parameters of target segment of coronary artery 3 months after stent implantation(±s)
OCT:光学相干断层成像;由于OCT无法穿透支架金属丝的遮挡,不能精确测量外弹力膜面积,故表中未显示;与对照组比较,aP<0.05OCT:optical coherence tomography;Area of extra elastic lamina is absent because OCT could not measure it precisely;aP<0.05 compared with control group
组别Group新生内膜厚度Neointimal thickness(mm)残余管腔面积Lumen area(mm2)新生内膜面积Neointimal area(mm2)支架面积Stent area(mm2)狭窄程度Extent of stenosis(%)对照组Control group 0.38±0.03 2.78±0.57 2.51±0.47 5.31±0.92 47.40±4.50实验组Treatment group 0.19±0.08a 3.50±0.66a 1.52±0.49a 5.01±0.79 30.13±8.56a
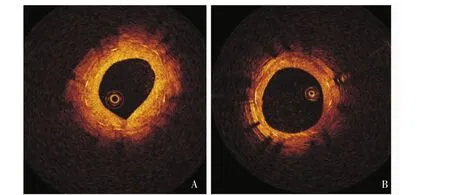
图3 支架植入3个月后冠状动脉靶血管段OCT分析图Fig 3 OCT images of target segment of coronary artery 3 months after stent implantatioin
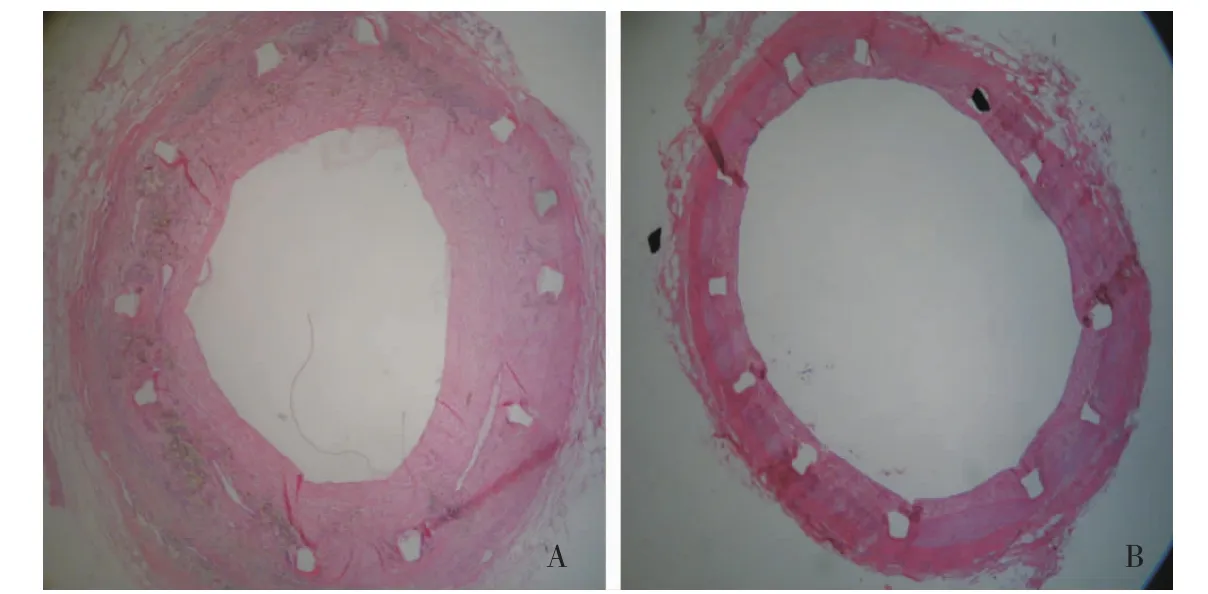
图4 支架植入3个月后冠状动脉靶血管段病理结果 (HE,×10)Fig 4 Pathological results of target segment of coronary artery 3 months after stent implantation(HE, ×10)
表2 支架植入3个月后冠状动脉靶血管段组织学检查结果(±s)Table 2 Histologic parameters of target segment of coronary artery 3 months after stent implantation(±s)

表2 支架植入3个月后冠状动脉靶血管段组织学检查结果(±s)Table 2 Histologic parameters of target segment of coronary artery 3 months after stent implantation(±s)
与对照组比较,aP<0.05aP<0.05 compared with control group
组别Group新生内膜厚度Neointimal thickness(mm)残余管腔面积Lumen area(mm2)新生内膜面积Neointimal area(mm2)外弹力膜面积Extra elastic lamina area(mm2)支架面积Stent area(mm2)狭窄程度Extent of stenosis(%)对照组Control group 0.47±0.05 1.85±0.55 3.43±0.35 6.27±0.96 5.28±0.39 65.40± 8.23实验组Treatment group 0.22±0.10a 3.15±0.43a 1.85±0.78a 6.88±0.33 4.99±0.81 36.00±10.97a
讨 论
本研究应用双球囊灌注导管在靶血管内局部灌注紫杉醇,Herdeg等[8]的基础研究显示,通过这种双球囊灌注导管可以有效地将紫杉醇转运到冠状动脉血管壁中,达到抑制内膜和平滑肌增殖的有效浓度,而且其作用可以维持14 d。这种方法最大的安全隐患为阻断血流,有可能导致严重心肌缺血、心律失常等并发症,有研究表明,恶性心律失常高发于阻断冠状动脉血流5~20 min时。本研究中采用的灌注时间平均为 (26.45±5.18)s,并且在此时间内,紫杉醇能够有效转移到血管壁中发挥作用,在球囊阻断血流的过程中尽管出现心电图ST段变化,但是未发生恶性心律失常、死亡等严重并发症,提示本研究采用的方法是安全的。
紫杉醇通过促进微管蛋白聚合,抑制解聚,保持微管蛋白稳定性,抑制细胞有丝分裂,从而抑制细胞增殖[9]。本研究就是利用了紫杉醇抑制冠状动脉内膜及平滑肌增殖的作用。关于紫杉醇的毒副作用,目前报道的有白细胞减少、外周神经毒性等,也有无症状、一过性心动过缓的报道,这些都是在针对恶性肿瘤患者的大剂量化疗时表现出来的,其药物浓度为本研究的100~1000倍,而且都是长时间给药。本研究使用的紫杉醇浓度和剂量极低,用药后在外周血中几乎测不到紫杉醇的浓度,所以基本不会产生毒副作用。在术后3个月的时间内,所有动物均存活,经相关检查未发现血栓、血管正性重构、支架内皮化不全等并发症,也说明这种方法的安全性。
目前评价支架有效性的方法包括冠状动脉造影再狭窄率以及近年来应用的OCT评价方法,评价指标包括支架内膜覆盖的程度和厚度等[10-11]。本研究中术后3个月时冠状动脉造影发现对照组再狭窄率明显高于实验组,OCT和病理检查也均发现对照组内膜增生厚度、面积、狭窄程度均显著高于实验组,结果提示应用双球囊灌注导管局部注射紫杉醇可以显著降低裸支架再狭窄的发生率。
本研究给药方法的一大优点是药物可以充分均匀地作用到整个靶血管壁,有别于药物洗脱支架将药物携带于金属丝表面,对血管壁的药物作用是支架的印记效应。本研究在OCT和病理分析中发现实验组支架表面的内膜增生厚度和对照组相比,较为均一。但本研究未设置药物洗脱支架组并与其进行对比,这是本研究的不足之处。
OCT可以在活体上精确评价支架植入后的内膜覆盖程度和厚度,所以OCT正逐渐被用来评价支架植入安全性和有效性,本研究中应用OCT也验证了实验组处理方法的有效性,其测量结果与病理学方法相一致。应用OCT评价支架术后内膜增生情况是该研究的一个创新点。
总之,本研究结果显示:应用双球囊灌注导管在靶血管内局部灌注紫杉醇,可以安全、有效地降低裸支架内内膜增殖,获得较大的管腔面积。
[1]Lemos PA,Saia F,Ligthart JM,et al.Coronary restenosis after sirolimus-eluting stent implantation:morphological description and mechanistic analysis from a consecutive series of cases[J].Circulation,2003,108(3):257-260.
[2]Colombo A,Orlic D,Stankovic G,et al.Preliminary observations regarding angiographic pattern of restenosis after rapamycin-eluting stent implantation [J].Circulation,2003,107(17):2178-2180.
[3]Schwartz RS,Huber KC,Murphy JG,et al.Restenosis and the proportional neointimal response to coronary artery injury:results in a porcine model [J].J Am Coll Cardiol,1992,19(2):267-274.
[4]Mohan S,Dhall A.A comparative study of restenosis rates in bare metal and drug-eluting stents [J].Int J Angiol,2010,19(2):e66-e72.
[5]陈玉东,王青海.支架置入术后冠状动脉瘤样扩张的临床研究[J].中国介入心脏病学杂志,2011,19(3):153-155.
[6]柳弘,吕树铮,陈韵岱,等.雷帕霉素洗脱支架远期致冠状动脉局部血管瘤样扩张四例报告[J].中华心血管病杂志,2007,35(1):44-46.
[7]Schneider JE,Berk BC,Gravanis MB,et al.Probucol decreases neointimal formation in a swine model of coronary artery balloon injure [J].Circulation,1993,88(2):628-637.
[8]Herdeg C,Oberhoff M,Baumbach A,et al.Local paclitaxel delivery for the prevention of restenosis:biological effects and efficacy in vivo [J].J Am Coll Cardiol,2000,35(7):1969-1976.
[9]Wang Y,Li X,Wang L,et al.Formulation and pharmacokinetic evaluation of a paclitaxel nanosuspension for intravenous delivery[J].Int J Nanomedicine,2011,6:1497-1507.
[10]Nishiguchi T,Kitabata H,Tanaka A,et al.Very late stent thrombosis after drug-eluting stent in segment with neointimal tissue coverage [J].JACC Cardiovasc Imaging,2010,3(4):445-446.
[11]Kubo T,Akasaka T.Optical coherence tomography imaging:current status and future perspectives-current and future developments in OCT [J].Cardiovasc Intervent Therapeutics,2009,25(1):2-10.
