荧光分光光度法测定福建野生金线莲中总黄酮含量
2012-11-07吴水华
吴水华
(福建生物工程职业技术学院中药系,福建 福州 350002)
荧光分光光度法测定福建野生金线莲中总黄酮含量
吴水华*
(福建生物工程职业技术学院中药系,福建 福州 350002)
目的:根据黄酮类化合物与Al3+形成稳定的荧光络合物原理,建立一种准确测定金线莲中总黄酮的方法。方法:采用超声提取法用95%乙醇提取福建野生金线莲中的总黄酮,以槲皮素为对照品,用荧光分光光度法测定总黄酮的含量,并进行回收率试验。结果:在选定的条件下,槲皮素浓度与荧光强度呈正相关,线性范围2~400 ng·mL-1,检出限为0.4 ng·mL-1,线性方程Y=2 098.1X+4.167 8,r=0.999 8,平均回收率为98.4%,RSD=1.5%。结论:本法操作简便、快速、准确,适用于金线莲中总黄酮的含量测定。
金线莲;荧光法;总黄酮
金线莲Anoectochilus roxburghii(Wall.)Lindl.,别名金蚕、金石松、树草莲、鸟人参、金线虎头蕉、金线入骨消,是兰科开唇兰属的植物[1]。金线莲在降血糖[2]、降血压[3]、保肝护肝[4]等方面具有显著的药理作用,是闽南民间常用要药。金线莲中含有多糖、黄酮、挥发油等多种成分,其中黄酮类化合物主要由槲皮素、异鼠李素及其糖苷组成[5-9]。目前,有关总黄酮的含量测定国内外没有公开的标准方法,《中国药典》中收载较多的是可见-紫外分光光度法,通常选用芦丁作为对照品,此法操作简便,但杂质干扰大,测定误差较大。近年来,荧光分光光度法测定总黄酮含量具有简便、快速、专属性好等特点,得到了众多学者的关注。目前,对金线莲中的总黄酮的测定,尚未见有应用荧光法的文献报道。本文根据文献[10]选用槲皮素作为对照品,采用荧光法对福建野生金线莲中的总黄酮含量进行测定。
1 仪器与试药
1.1 仪器
Cary Eclipse型荧光分光光度计(美国瓦里安);AL204型万分之一分析电子天平[梅特勒-托利多仪器(上海)有限公司];AKRY-UP-Ⅲ-10艾柯超纯水机(成都康宁实验专用纯水设备厂);KQ-100B超声波清洗机(昆山市超声仪器有限公司)。所用玻璃仪器均用重铬酸钾洗液浸泡24 h后用自来水冲洗干净,并用超纯去离子水充分冲洗干净。
1.2 试剂与药材
槲皮素对照品(中国食品药品检定研究院,97.4%);冰醋酸(AR,江苏永华精细化学品有限公司);石油醚(60~90℃)、95%乙醇(AR,天津市巴斯夫化工有限公司);结晶氯化铝(AR,天津市科密欧化学试剂有限公司);所用蒸馏水均为超纯去离子水。
野生金线莲,采自福建德化地区,由福建农林大学张大鹏教授鉴定为兰科开唇兰属植物花叶开唇兰Anoectochilus roxburghii(Wall.)Lindl.,干燥后粉碎过2号筛。
2 方法
2.1 溶液制备
2.1.1 槲皮素对照品溶液制备 精密称取槲皮素对照品10 mg,置于小烧杯中,用少量95%乙醇溶解,并转入100 mL容量瓶中,用95%乙醇定容至刻度,摇匀,制得质量浓度为0.1 mg·mL-1的槲皮素对照品溶液。
2.1.2 样品溶液制备 精密称取福建野生金线莲药粉0.5 g,置于具塞锥形瓶中,加入石油醚20 mL浸泡24 h,滤除石油醚,药渣挥干,加入10 mL 95%乙醇超声处理0.5 h,共3次,滤液并入50 mL容量瓶,并用95%乙醇定容至刻度,摇匀。
2.1.3 试剂溶液制备 醋酸溶液:精密移取1.43 mL冰醋酸置50 mL容量瓶中,用95%乙醇稀释定容至刻度,摇匀,制得0.5 mol·L-1的醋酸乙醇溶液,备用。
三氯化铝溶液:精密称取0.912 2 g AlCl3·6H2O置小烧杯中,用95%乙醇溶解,转入50 mL容量瓶中,稀释定容至刻度,摇匀,制得10 mg·mL-1的三氯化铝乙醇溶液,备用。
2.2 实验条件选择
2.2.1 测定波长选择 分别取槲皮素对照溶液及样品溶液适量,加入适量醋酸及三氯化铝显色后进行激发和发射光谱扫描,所得谱图如图1所示。由图1可知,试剂空白溶液在此条件下对实验结果无干扰,槲皮素和样品溶液在酸性条件下都与三氯化铝络合反应产生荧光物质,各自的激发波长分别为λex=435 nm和λex=433 nm,发射波长为λex=485 nm和λex=479 nm。本实验选择测定荧光条件为:激发波长435 nm,发射波长485 nm,狭缝宽度为5 nm。

图1 荧光光谱
2.2.2 体系醋酸加入量 在槲皮素、三氯化铝的条件不变的情况下,考察了体系中不同醋酸浓度对荧光强度的影响,见图2所示。由图2可知,在本实验中,当体系中醋酸的摩尔浓度较低时,随醋酸摩尔浓度的增大,它们的荧光强度迅速增加,当加入醋酸的摩尔浓度达到0.05 mol·L-1时,荧光强度达到最大值,然后随着醋酸摩尔浓度的增大,荧光强度降低,所以本实验确定加入醋酸的量使体系的醋酸浓度达到 0.05 mol·L-1。
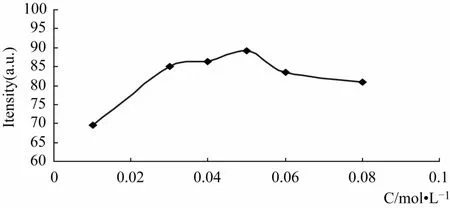
图2 醋酸浓度的影响
2.2.3 体系三氯化铝加入量 在固定体系槲皮素、醋酸的浓度的情况下,考察了体系中不同三氯化铝浓度对荧光强度的影响,见图3所示。在本实验中,当体系中三氯化铝的质量浓度较低时,随三氯化铝浓度的增大,荧光强度增强,当加入三氯化铝的质量浓度在0.6~0.7mg·mL-1时,荧光强度达到最大值(RSD=0.5%),然后随着三氯化铝质量浓度的增强,荧光强度缓慢降低。本实验选择加入三氯化铝的量为使体系中三氯化铝的浓度为0.6 mg·mL-1。

图3 三氯化铝浓度的影响
2.2.4 乙醇量对荧光强度的影响 在槲皮素、醋酸和三氯化铝的条件不变的情况下,考察了不同容量百分数的乙醇对荧光强度的影响,见图4所示。由图4可知,乙醇的容量百分数对荧光强度的影响比较大,乙醇的容量百分数越高,荧光强度越强,所以本实验选择95%的乙醇为溶剂。

图4 乙醇浓度的影响
2.2.5 试剂加入顺序影响 在其余条件固定的条件下,按实验方法考察了试剂加入顺序对荧光强度的影响,结果表明:分别按槲皮素+醋酸+三氯化铝、三氯化铝+醋酸+槲皮素、醋酸+槲皮素+三氯化铝的顺序加入,三者荧光强度均较强,无显著差别(RSD=1.0%),而其余组合顺序的荧光强度均比较弱。本实验选择按槲皮素+醋酸+三氯化铝的顺序加入。
2.2.6 体系稳定性 槲皮素和样品溶液荧光体系在不同测定时间内荧光强度的变化情况见图5。由图5可知,二者荧光强度开始时迅速增强,5~15 min达到稳定,而后随着时间的延长,荧光强度平缓下降,故显色后5~15 min为最佳测定时间,本实验选择显色10 min时测定。

图5 放置时间影响
2.3 测定方法
2.3.1 标准曲线 精密量取1 mL槲皮素对照品溶液,置于50 mL容量瓶中,用95%乙醇稀释定容至刻度,摇匀。精密移取不同体积的上述槲皮素溶液置于10 mL的容量瓶中,依次加入0.5 mol·L-1的醋酸乙醇溶液1 mL,10 mg·mL-1三氯化铝乙醇溶液0.6 mL,用95%的乙醇水溶液稀释定容至刻度,室温放置10 min,在激发波长435 nm,发射波长485 nm,狭缝宽度为5 nm的条件下测定荧光强度(Y),并对相应的浓度(X)绘制工作曲线,用最小二乘法求算出回归方程(Y=2 098.1X+4.167 8)。
2.3.2 回收率试验 为了验证实验的准确性,采取加样回收法进行了回收率试验。精密称取已知含量的供试品0.5 g,制备供试品溶液,加入0.1 mg·mL-1槲皮素对照品溶液0.7 mL,按上述最佳实验条件测定荧光强度,并根据回归方程求算出样品中总黄酮的浓度,计算回收率,结果见表1。
2.3.3 样品含量测定 精密移取1 mL样品溶液置于10 mL容量瓶中,按上述最佳实验条件测定荧光强度,并根据回归方程求算出样品中总黄酮的浓度,最后算出含量,见表2。

表2 野生金线莲中总黄酮含量测定
3 结果与讨论
3.1 结果
根据黄酮类化合物能与铝离子形成稳定的荧光络合物的原理,采用石油醚浸泡除去叶绿素后,用95%乙醇超声提取台湾金线莲中的总黄酮,以槲皮素为对照品,用荧光分光光度法测定总黄酮的含量,在选定的条件下,槲皮素浓度与荧光强度呈正相关,金线莲中总黄酮的含量测得为139.4μg·g-1。
3.2 讨论
金线莲全草中含有大量的叶绿素,干扰测定,直接提取测定会使结果偏高,本文采用石油醚浸泡除去叶绿素,消除干扰,并考察了体系中醋酸浓度、三氯化铝用量、溶剂、试剂加入顺序、放置时间对荧光强度的影响,确定最佳的测定条件,进一步提高了测定结果的准确性。与三价铝离子络合产生荧光络合物必须具备3-羟基,4-羰基、5-羟基,4-羰基或邻二酚羟基的结构,根据查阅相关金线莲化学成分的报道文献[5-9],除了阿魏酸外,尚未在金线莲中发现有非黄酮类的多酚物质,而阿魏酸不具备上述结构特点,对本测定方法不会产生干扰。
实验结果表明,本法操作简便、快速,测定准确、可靠、灵敏,检出限比UV法及HPLC法低了两个数量级,适用于福建野生金线莲中总黄酮的测定,为进一步正确制定其质量标准及开发利用提供依据。
[1]孔祥海.“药王”金线莲的自然资源初步研究[J].中草药,2001,32(2):155-157.
[2]陈卓,黄自强.金线莲及其提取物降血糖实验研究[J].福建医科大学学报,2000,34(4):350-352.
[3]李葆华,陈以旺.金线莲提取物ARL对肾血管性高血压大鼠血压、血浆血管紧张素Ⅱ、一氧化氮和内皮素的影响[J].中国分子心脏病学杂志,2006,6(3):132-135.
[4]黄立峰,卢若艳,苏志敏,等.福建金线莲提取物对CCl4所致小鼠急慢性肝损伤的保护作用[J].解放军药学学报,2007,23(4):278-281.
[5]何春年,王春兰,郭顺星,等.福建金线莲的化学成分研究[J].中国药学杂志,2005,40(8):581-583.
[6]何春年,王春兰,郭顺星,等.福建金线莲的化学成分研究Ⅱ[J].中国中药杂志,2005,30(10):761-763.
[7]关璟,王春兰,郭顺星.福建产金线莲中黄酮苷成分的研究[J].中草药,2005,36(10):1450-1453.
[8]杨秀伟,韩美华,靳彦平.金线莲化学成分的研究[J].中药材,2007,30(7):797-800.
[9]何春年,王春兰,郭顺星,等.福建金线莲的化学成分研究Ⅲ[J].天然产物研究与开发,2005,17(3):259-262.
[10]郭玉梅,杨景和,吴霞.银杏叶提取物中总黄酮含量的分析方法研究[J].山东大学学报(理学版),2009,44(5):40-44.
Determ ination of Total Flavanoid in W ild Anoectochilus roxburghii(W all.)Lind l.from Fujian by Spectrofluorometry
WU Shui-hua
(Fujian Biological Engineering Vocational College,Fuzhou350002,China)
Objective:Themethod of determining total flavanoid in wildAnoectochilus roxburghii(Wall.)Lindl.based on thereaction of flavanoid and alumimum(Ⅲ).M ethods:The total flavanoid extracted from the samples with 95%ethanol under sonication.The content was measured by spectrofluorometry with quecetin as control.The recovery was also studied.Results:On the optimal conditions,the fluorescence intensity variations showed a linear relationshi Pwith the concentration of quercetin at2~400 ng·mL-1.Detection limitwas0.4 ng·mL-1(signal-to-noise ratio of3,n=11).The linear regression equation wasY=2 098.1X+4.167 8(r=0.999 8),the recovery of 98.4% (RSD=1.5%).Conclusion:The proposed method,which is suitable for themeasurement of the total flavanoid in wildAnoectochilus roxburghii(Wall.)Lindl,is simple,rapid and reliable.
Anoectochilus roxburghii(Wall.)Lindl.;Spectrofluorometry;Total flavanoid
*[通讯作者]吴水华,E-mail:lwshpw@sina.com
2012-03-07)
