药物性肝炎患者的临床特征及治疗分析
2012-11-06谢志毅周雨峡
谢志毅,乔 峤,周雨峡
(无锡市第四人民医院消化内科,江苏无锡,214062)
目前,随着新药的不断研制,临床用药的不规范,特别是抗生素的滥用,药物使用的品种与剂量的增加,药物性肝炎呈现出逐年增多的趋势。其中药物性肝炎约占所有药物损害病象的10%~15%[1],其发生率仅次于皮肤粘膜损害和药物热。西方国家由药物引起的急性肝功能衰竭约占全部肝功能衰竭的10%~52%[2],病死率约为11.9%[3]。由于药物性肝炎临床特征复杂,病理变化多样,实验室检查无特异性,极易发生漏诊、误诊。为了加深对药物性肝炎的了解,本文通过对86例住院治疗的药物肝炎患者进行综合分析,现汇总如下。
1 材料和方法
1.1 一般资料
2005年1月—2010年12月作者收治的药物性肝炎患者92例,其中男 55例,女 37例,男∶女=1.5∶1,年龄23~78岁,平均(51.3±12.9)岁。
1.2 诊断方法[4]
①病前1~8周或更长时间内有明确用药史;②部分患者有发热、皮疹;③血常规检查嗜酸性粒细胞≥6%;④有肝实质细胞损害或肝内胆汁淤积的临床表现;⑤排除其他原因所致肝炎或黄疸,部分患者原有肝病基础如乙肝标志物阳性、脂肪肝、血吸虫肝病,但服药前检查肝功能正常;⑥停用药物即好转。
1.3 诊断标准
按照Maria(1997年)药物性肝损害的诊断标准[5],53例评分在10~13分,36例评分在14~17分,3例>17分,92例患者均符合药物性肝炎的诊断。
1.4 研究方法
回顾性调阅92例药物性肝炎患者住院病历,详细分析了患者原发病、服药史、临床特征、肝功能、血常规、肝炎病毒血清标志物及临床治疗等各项指标进行综合分析评价。
2 结 果
2.1 临床特征
92例药物性肝炎患者中 ,有73例患(79.3%)出现不同程度的乏力、纳差、恶心、呕吐等胃肠道症状,63例患者(68.5%)出现隐性或显性黄疸,27例患者(29.3%)出现发热、18例患者(19.6%)出现瘙痒,12例患者(13.0%)出现皮疹等症状。实验室检查丙氨酸氨基转移酶(ALT)升高92例(100%)碱性磷酸酶(ALP)升高62例(67.4%),总胆红素TB升高44例(47.8%)。
2.2 临床分型
参照国际药物性肝炎临床分型标准分型[6],肝细胞型共48例(52.2%),临床以肝细胞型常见;胆汁淤积型 30例(32.6%),混合型 14例(15.2%)。
2.3 导致药物性肝炎的相关药物分析
本组92例患者中,相关药物从高到低依次如下:中草药类、抗生素类、抗肿瘤药类、抗结核药类、解热镇痛药,其他。详见表1。
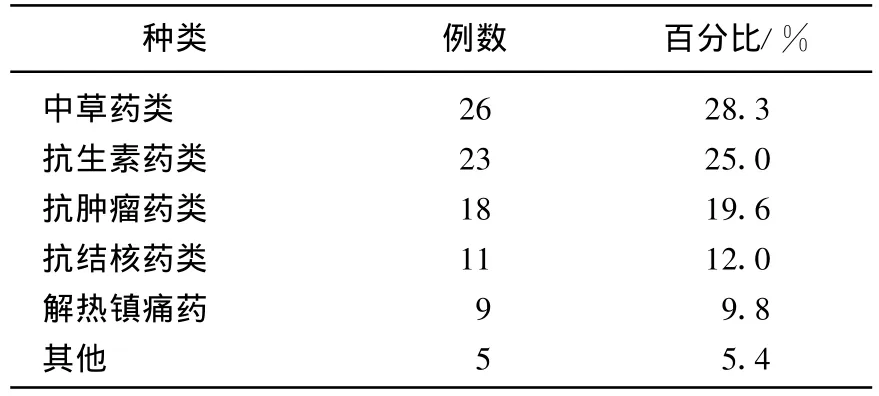
表1 导致药物性肝炎的相关药物分类表
2.4 发生时间
不同类型药物导致药物性肝炎发生的时间略有不同,见表2。
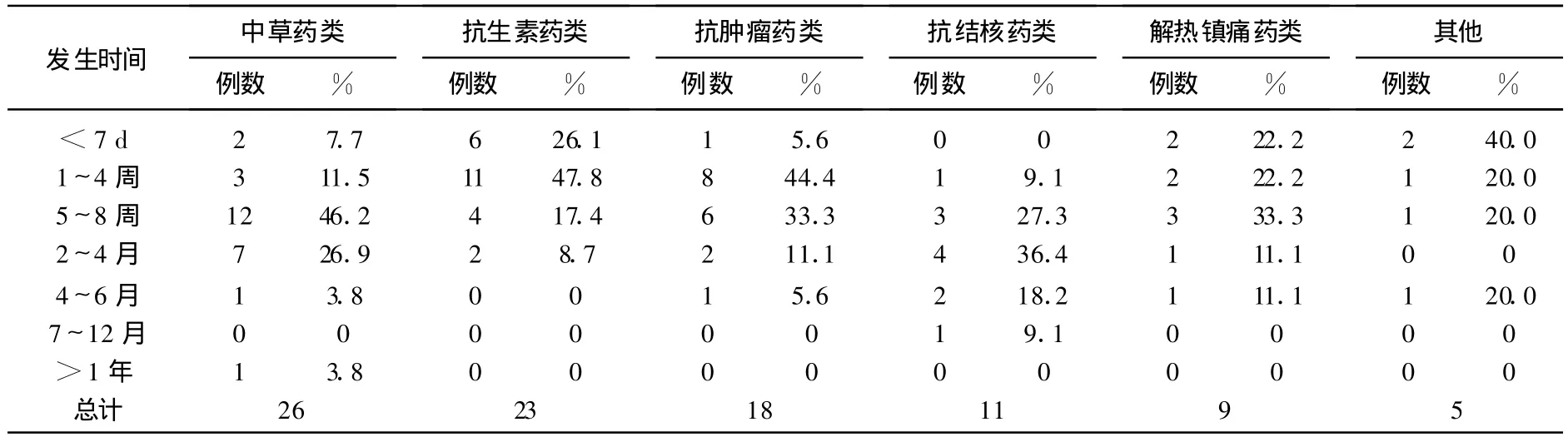
表2 不同类型药物导致药物性肝炎发生的时间
2.5 治疗效果
92例患者在确认后,立即进行护肝、退黄、降酶等治疗措施对症治疗,其中临床治愈75例(81.5%),好转9例(9.8%),自动出院5例(5.4%),死亡3例(3.3%)。存活85例患者治疗前后肝功能比较,ALT、AST、ALP、TB等指标均比治疗前有明显好转。
86例药物性肝炎患者治疗前后肝功能比较,详见表3。
表3 86例药物性肝炎患者治疗前后肝功能比较()
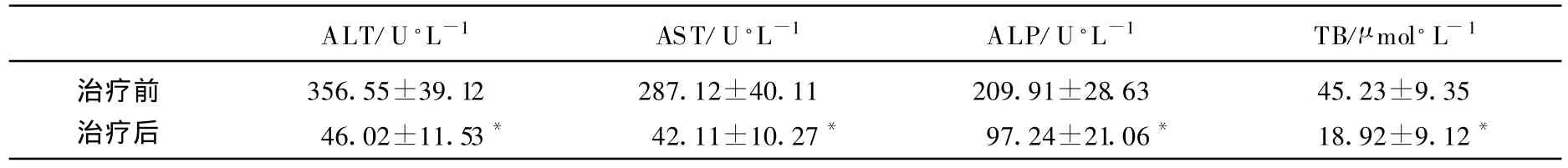
表3 86例药物性肝炎患者治疗前后肝功能比较()
*P<0.05。
ALT/U·L-1 AST/U·L-1 ALP/U·L-1 TB/μ mol·L-1治疗前 356.55±39.12 287.12±40.11 209.91±28.63 45.23±9.35治疗后 46.02±11.53* 42.11±10.27* 97.24±21.06* 18.92±9.12*
3 讨 论
当前人类暴露于6万种以上化学物质的威胁中,其中3万种以上为药品和保健品[7]。目前已发现可造成肝脏不同程度损害的药物至少有500~1000种,几乎遍及各类药物[8]。经消化道吸收的药物,经门静脉进入肝脏,大多数药物在肝内的代谢过程包括转化与结合两个时相即Ⅰ相代谢及Ⅱ相代谢。Ⅰ相代谢反应主要包括氧化、还原和水解反应,药物经过此相反应后极性增高,即水溶性增大,易于排出体外,参与Ⅰ相代谢的酶主要是细胞色素P450(CYP);Ⅱ相代谢反应主要为结合反应,经过此相反应后,药物可与葡萄糖醛酸、甲基、硫基、甘氨酸等基团结合,形成极性更强的物质,通过胆汁或尿液排出体外。有些药物仅需Ⅰ相代谢,有些药物则需要Ⅰ相及Ⅱ相代谢才能完成。肝脏中Ⅰ相及Ⅱ相代谢酶的基因在人群中具有为多态性,因此,不同个体对药物的耐受性及敏感性也有很大差异。在有些个体,有些药物在此代谢过程中会产生有毒或致癌的物质,进一步造成肝损伤,或原本不具抗原性的药物,在肝内转化后形成具有抗原性的代谢产物,引起免疫性肝损伤。
当前,中草药引起的肝损害的报道也呈逐年上升趋势,现已发现至少有60种以上的中草药能引起肝损害[9],如单味中药有黄药子、三七、何首乌、大黄、雷公藤、丹参、苍耳子 、白果等等,一些保健品中,中草药所占成分较大,本组患者中中草药导致药物性肝炎的比例最高,达到28.3%,与患者主观认为中草药安全、无毒有关,应加强中草药、中成药的药理研究,增加对中成药、汤剂、减肥药、保健品人群肝功能的检测,在群众与医务工作者思想上树立“中草药”也可导致药物性肝炎意识,合理、谨慎使用中草药。抗生素药物是DILI常见致病因素已得到大家的认同,本研究组中占25.0%,其次是抗肿瘤类药,达到19.6%,目前中国肿瘤的发病率呈上升趋势,与空气、环境、水质、食品安全等因素有关,抗肿瘤药物的大量使用,所致DILI的发生率也不断增高,肿瘤患者出现肝功能损害,应排除药物因素,如果是药物引起,必须立即停止相关药物、或换药、减量等措施。
药物性肝损伤的发生时间因药物类型不同而有所不同,并多见于女性[10],与本研究组相同。DILI发生时间与用药时间长短不成正比,因药物不同导致发生DILI的时间有所不同,从本研究组中看出,抗生素药与抗肿瘤药物短期内易发生DILI。中草药、抗结核药物及抗甲状素药物在使用1年后仍有可能导致DILI的发生,对长期使用这三类药物的人群要定期肝功能监测,随时预防DILI的发生。
对DILI药物诱导损伤因素目前仍不确定,国内缺少规范的流行病学调查,没有制订出适合我国人群的药物性肝病诊断标准,药物性肝炎的研究还需要进一步深入,建立和健全DILI致病药物数据库显得如此迫切。加强公众教育,避免滥用、长期大量用药,谨慎、合理使用可能损害肝脏的药物,如中草药类、抗生素类等等。用药过程中定期检测肝功能,提高公众及临床医师对DILI的警惕性,密切注意肝功能变化,发现DILI症状,应立即停药、换药或者减量,并且采取护肝等对症治疗。
[1]伍百贺,詹俊.药物性肝病的诊断与治疗进展[J].国际消化病杂志,2008,20(5):413.
[2]Larrey D,Pageaux G P.Drug-induced acute liver failure[J].Eur J Gastroenterol Hepatol,2005,17(2):141.
[3]Ibá?ez L,Pé rez E,Vidal X,et al.Prospective surveillance of acute serious liver disease unrelated to infectious,obstructive,or metabolic diseases:epidemiological and clinical features,and exposure to drugs[J].J Hepatol,2002,37(5):592.
[4]Zimmerman H J,Ishak K G.General aspects of drug-induced liver disease.[J].astroenterol Clin North Am.1995,24(4):739.
[5]陈成伟.药物性肝损害的诊断[J].肝脏,2001,6(1):49.
[6]kaplowitz N.Mechanisms of liver cell injury[J].J Hepatol.2000,32(1 Suppl):39.
[7]陈成伟.重视药物性肝病[J].肝脏,2006,11(5):301.
[8]梁斌,余国梅,毛静.药物性肝炎及其治疗的研究进展[J].解放军药学学报,2011,27(2):175.
[9]Wolters L M,Van Buuren H R.Rosuvastatin-associated hepatitis with autoimmune features[J].Eur J Gastroenterol Hepatol,2005,17(5):589.
[10]Akoglu H,Yilmaz R,Kirkpantur A,et al.Combined organ failure with combination antihyperlipidemic treatment:a case of hepatic injury and acute renal failure[J].Ann Pharmacother,2007,41(1):143.
