麦冬多糖对2型糖尿病大鼠肾脏的保护作用
2012-11-06陆小元
陆小元
(江苏省姜堰市中医院药剂科,江苏姜堰,225400)
近年来,氧化应激与糖尿病肾病(DN)的关系日益受到关注[1]。研究[2]表明,氧化损伤在DN病理过程中发挥重要作用,尼克酰胺腺嘌呤二核苷酸(NADPH)氧化酶是产生活性氧簇(ROS)的重要来源,可以NADPH作为电子供体,将氧催化为O2-[3]。麦冬具有生津养阴、清热润燥、除烦消渴的功效,而麦冬多糖为麦冬的主要成分之一,近年来,研究[4-5]表明其具有抗炎、抗心肌缺血、降血糖、耐缺氧、抗过敏等作用。最新研究[6]表明,麦冬多糖还具有抗氧化作用。本研究观察麦冬多糖对糖尿病大鼠肾脏NADPH氧化酶亚单位p47phox和核因子-κB(NF-κB)表达的影响 ,探讨其对糖尿病大鼠肾脏的保护作用及机制。
1 材料与方法
1.1 材料
雄性SD大鼠,体质量180~220 g(南京青龙山实验动物中心);链脲佐菌素(美国Sigma公司);麦冬多糖(西安金绿生物工程技术有限公司);肌酐、尿素氮检测试剂盒(南京建成生物工程研究所);总抗氧化能力、过氧化氢检测试剂盒(江苏碧云天生物技术研究所);小鼠抗大鼠p47phox单克隆抗体、小鼠抗大鼠NF-κB单克隆抗体、小鼠抗大鼠β-actin单克隆抗体及山羊抗鼠辣根过氧化物酶(HRP)标记二抗(美国Santa Cruz公司)。
1.2 糖尿病大鼠模型复制及分组
健康雄性SD大鼠适应性喂养1周,随机分为对照组与糖尿病组。对照组喂以普通饲料,糖尿病组则喂以高脂饲料(高脂饲料由78.5%普通饲料、10%蛋黄粉、10%猪油、1%胆固醇和胆盐0.5%混合而成)。饲养4周后禁食12 h,模型组大鼠一次性腹腔注射35 mg/kg链脲佐菌素(STZ)溶液(pH4.5的柠檬酸钠-柠檬酸缓冲液冰浴中新鲜配制),对照组大鼠则腹腔注射等体积的柠檬酸缓冲液。72h后检测血糖,凡连续5 d测得随机血糖≥13 mmol/L者初步确认糖尿病模型成立,血糖不符合要求者则剔除。选造模成功的糖尿病大鼠随机分为模型组、麦冬多糖(200、400、800 mg/kg)剂量组 。另设对照组 ,每组8只。灌胃给药,连续给药6周。对照组和模型组给予等体积蒸馏水。
1.3 空腹血糖(FBG)测定
给药前及给药期间每2周测定1次FBG,采血当天各组大鼠禁食(不禁水)12 h,以采血针刺破大鼠尾尖,毛细血管采血,按说明书用血糖仪和血糖试纸测定大鼠FBG。
1.4 标本采集
给药6周后用2%戊巴比妥钠60 mg/kg腹腔注射麻醉大鼠。颈动脉采血,用于血肌酐、尿素氮的测定。游离左、右肾组织,精确称重,分别计算左、右肾脏指数(肾脏指数=肾重量/体质量)。左、右肾组织-80℃冰箱保存用于相应指标的检测。
1.5 血清肌酐、尿素氮测定
颈动脉采血4mL,以3500 r/min、4℃离心20 min,收集血清,按试剂盒说明书测定血清中肌酐(Scr)、尿素氮(BUN)的含量。
1.6 肾组织总抗氧化能力(T-AOC)及过氧化氢(H2O2)坚持测
准确称取100 mg肾组织(左、右肾各50 mg)加入1 mL预冷的磷酸盐缓冲液(PBS)溶液中,制备10%的组织匀浆。12000 r/min、4℃离心5 min,按试剂盒说明书测定肾组织中T-AOC、H2O2的含量;二辛可酸(BCA)法测定肾组织蛋白浓度。
1.7 Western blot检测肾 p47phox、NF-κB 蛋白表达
低温提取组织或细胞蛋白,BCA法测定蛋白浓度。每孔上样50 μg蛋白,12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离样品,转膜 ,封闭 ,分别加入p47phox(1∶500)、NF-κB(1∶1000)和 β-actin(1∶2000)一抗,4 ℃过夜。洗膜,加入二抗(1∶2000)室温孵育1 h。洗膜后将高灵敏的LunimataTMCrescendo发光剂加到膜的正面,采用Bio-Rad ChemiDoc XRS+成像系统进行拍照。图像用Image J 1.43(National Institutes of Health)软件进行灰度值分析,以β-actin为内参蛋白,计算蛋白表达水平相对值。计算方法:蛋白表达相对值=目的蛋白灰度值/内参蛋白灰度值。实验重复3次。
2 结 果
2.1 对FBG的影响
给药前与对照组比较,模型组、麦冬多糖(200、400、800mg/kg)组FBG均显著升高(P<0.01),说明模型成功。给药后与模型组比较,麦冬多糖800 mg/kg组给药2周后,以及麦冬多糖400mg/kg组给药4周后,FBG均明显降低(P<0.05或 P<0.01);麦冬多糖 200 mg/kg组大鼠FBG也降低,但未出现显著差异。以上结果表明麦冬多糖可降低2型糖尿病大鼠FBG。见表1。
表1 各组FBG水平变化(,n=8)

表1 各组FBG水平变化(,n=8)
与对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别 给药前 给药2周 给药4周 给药6周对照组 5.68±0.61 5.34±0.38 6.01±0.42 5.93±0.51模型组 19.88±2.72** 19.86±3.31** 20.96±2.79** 19.69±4.41**麦冬多糖200 mg/kg组 20.81±3.54 16.89±5.36 14.35±4.25 15.48±3.29麦冬多糖400 mg/kg组 20.26±2.66 15.57±4.34 13.73±3.28# 13.01±2.34##麦冬多糖800 mg/kg组 19.55±2.85 13.32±2.89# 12.02±2.48## 12.45±2.39##
2.2 对肾脏指数的影响
与对照组比较,模型组大鼠左、右肾脏指数均显著升高(P<0.01)。与模型组比较,麦冬多糖各剂量组大鼠左、右肾脏指数均显著降低(P<0.05或 P<0.01)。见表2。
表2 各组肾脏指数、Scr及BUN水平变化(,n=8)

表2 各组肾脏指数、Scr及BUN水平变化(,n=8)
与对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别 左肾指数/mg·g-1 右肾指数/mg·g-1 Scr/μ mol·L-1 BUN/mmol·L-1对照组 2.89±0.25 3.05±0.29 42.59±4.85 4.57±0.75模型组 8.87±0.71** 9.11±0.87** 79.58±8.79** 13.33±2.47**麦冬多糖200 mg/kg组 5.66±0.58# 6.22±0.63# 64.69±9.22# 10.91±1.33#麦冬多糖400 mg/kg组 4.96±0.41## 5.53±0.57## 56.01±5.78## 9.84±1.02##麦冬多糖800 mg/kg组 4.45±0.39## 5.31±0.49## 54.18±5.48## 9.44±0.95##
2.3 对Scr及BUN的影响
与对照组比较,模型组大鼠Scr、BUN水平均显著升高(P<0.01)。与模型组比较,麦冬多糖各剂量组大鼠Scr、BUN均显著降低(P<0.05或P<0.01)。见表2。
2.4 对肾脏p47phox、NF-κB蛋白表达的影响
与对照组比较,模型组大鼠肾脏p47phox、NF-κB蛋白均显著升高(P<0.01)。与模型组组比较,麦冬多糖各剂量组大鼠肾脏 p47phox、NF-κB蛋白均显著降低(P<0.05或 P<0.01)。见图1、表 3。
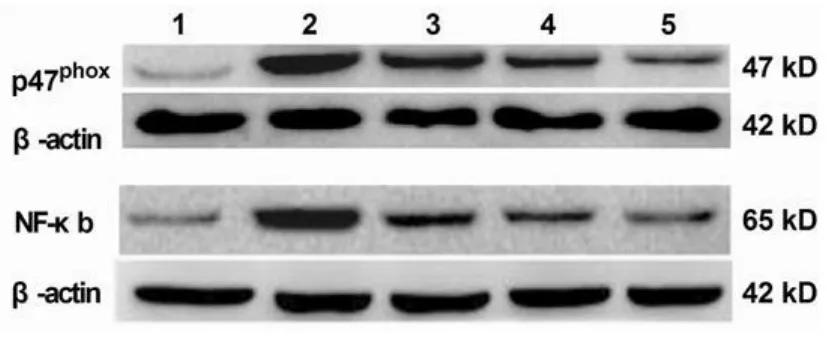
图1 麦冬多糖对2型糖尿病大鼠肾脏p47phox、NF-κB蛋白表达的影响
表3 各组肾脏p47phox、NF-κB蛋白表达以及T-AOC、含量H2O2变化(,n=8)

表3 各组肾脏p47phox、NF-κB蛋白表达以及T-AOC、含量H2O2变化(,n=8)
与对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别 p47phox蛋白水平 NF-κB蛋白水平 T-AOC/mmol·g-1 H2O2/μ mol·L-1对照组 1.03±0.11 1.12±0.14 3.97±0.37 457.43±51.46模型组 3.98±0.42** 3.21±0.35** 2.08±0.31** 649.79±60.85**麦冬多糖200 mg/kg组 2.85±0.29# 2.55±0.23# 2.67±0.35# 584.61±59.85#麦冬多糖400 mg/kg组 2.51±0.26## 2.37±0.29## 2.93±0.26## 554.76±63.63##麦冬多糖800 mg/kg组 2.38±0.23## 2.13±0.22## 2.94±0.34## 510.83±47.26##
2.5 对肾脏T-AOC、H2O2含量的影响
与对照组比较,模型组大鼠肾脏T-AOC及H2O2含量显著升高(P<0.01)。与模型组比较,麦冬多糖各剂量组大鼠肾脏T-AOC及H2O2含量显著降低(P<0.05或 P<0.01)。见表3。
3 讨 论
DN是糖尿病患者最主要的微血管病变之一,早期病理改变为肾小球肥大、基底膜增厚及细胞外基质的积聚,晚期则表现为肾小球硬化和肾间质纤维化,一旦发展到终末阶段,其疗效及预后均较差。本研究结果显示,麦冬多糖可明显降低糖尿病大鼠FBG,与文献[7]报道一致。同时,本研究还发现,随着病程进展,糖尿病组大鼠Scr、BUN及肾脏指数明显升高,而麦冬多糖组Scr、BUN水平及肾脏指数明显下降,表明麦冬多糖对2型糖尿病大鼠肾脏具有保护作用。
近年来,DN被视为是一种由氧化应激引起的炎症性疾病[8]。糖尿病大鼠肾脏组织内的氧化应激水平显著升高,细胞内产生的高水平活性氧(ROS)可以通过增强对NF-κB的抑制蛋白ⅠκB的解离,激活 NF-κB与 DNA 的结合活性,进一步激活NF-κB相关的转录因子[9]。活化的NF-κB可进入细胞核内并与含有基因转录序列的DNA结合,促进细胞因子、生长因子、趋化因子、炎症介质、黏附分子等相关基因表达,造成细胞外基质合成增多,降解减少,促进细胞间质纤维化[10]。本研究结果显示,糖尿病大鼠肾脏组织中的H2O2水平、NF-κB表达均高于正常大鼠,而肾脏总抗氧化能力明显降低,而麦冬多糖能明显提高肾脏的总抗氧化能力、降低H2O2水平及NF-κB的表达。
已有研究[11]表明,NADPH氧化酶的过度活化是细胞内高水平ROS产生的重要来源,p47phox是NADPH氧化酶发挥活性的关键亚基,具有影响NADPH氧化酶介导ROS产生的作用,并且还可促进NADPH氧化酶与NF-κB的紧密连接,直接激活NF-κB[12],因此,抑制 p47phox活性可有效的降低ROS的产生及NF-κB的活性,减轻糖尿病肾脏病变。本研究表明,麦冬多糖能下调糖尿病大鼠肾脏中p47phox活的表达,抑制NADPH氧化酶的活性,减少ROS产生,降低 NF-κB的活化减轻了糖尿病肾脏病变,为临床应用麦冬多糖防治糖尿病肾病提供实验依据。
综上所述,糖尿病大鼠肾脏氧化应激水平升高并伴随着肾功能的降低。麦冬多糖能抑制抑制糖尿病大鼠肾组织中 p47phox、NF-κB蛋白的表达,进一步改善氧化应激反应,延缓大鼠DN的发展,但其具体机制尚需进一步研究。
[1]Waggiallah H,Alzohairy M.T he effect of oxidative stress onhuman red cells glutathione peroxidase,glutathione reductase level,and prevalence of anemia among diabetics[J].N Am J Med Sci,2011,3(7):344.
[2]Song P,Zou M H.Regulation of NAD(P)H oxidases by AMPK in cardiovascular systems[J].Free Radic Biol Med,2012,52(9):1607.
[3]Satoh M,Fujimoto S,Haruna Y,et al.NAD(P)H oxidase and uncoupled nitric oxide synthase are major sources of glomerular superoxide in rats with experimental diabetic nephropathy[J].Am J Physiol Renal Physiol,2005,288(6):F1144.
[4]范俊,张旭.麦冬多糖药理研究进展[J].中医药学刊,2006,4(24):626.
[5]黄琦,许家鸾.麦冬多糖对2型糖尿病血糖及胰岛素抵抗的影响[J].浙江中西医结合杂志,2002,2(12):81.
[6]黄妮,熊双丽,卢飞.绵麦冬多糖的分离纯化及自由基清除活性[J].林产化学与工业,2011,1(31):68.
[7]王源,王硕,王令仪,等.麦冬多糖MDG-1对糖尿病小鼠模型的降糖作用[J].上海中医药大学学报,2011,4(25):66.
[8]Luis-Rodr í guez D,Martínez-Castelao A,Górriz J L,et al.Pathophysiological role and therapeutic implications of inflammation in diabetic nephropathy[J].World J Diabetes,2012,3(1):7.
[9]Wang Y P,Pan X D,Jiang S Y,et al.Oxidative stress induces apoptosis via NF-kappaB-inos-nitric oxide pathway in pancreatic beta-cells[J].Zhongguo Ying Yong Sheng Li Xue Za Zhi,2009,25(2):255.
[10]Son G,Iimuro Y,Seki E,et al.Selective inactivation of NF-kappaB in the liver using NF-kappaB decoy suppresses CCl4-induced liver injury and fibrosis[J].Am J Physiol Gastrointest Liver Physiol,2007,293(3):G631.
[11]Newsholme P,Haber E P,Hirabara S M,et al.Diabetes associated cell stress and dysfunction:role of mitochondrial and non-mitochondrial ROS production and activity[J].J Physiol,2007,583(Pt 1):9.
[12]Yuan H,Zhang X,Huang X,et al.NADPH oxidase 2-derived reactive oxygen species mediate FFAs-induced dysfunction and apoptosis of β-cells via JNK,p38 MAPK and p53 pathways[J].PLoS One,2010,5(12):e15726.
