离子液辅助制备二氧化锰及催化性能研究
2012-11-06李秀萍赵荣祥刘春生
李秀萍 ,赵荣祥 ,刘春生
(1. 辽宁石油化工大学化学与材料学院,辽宁 抚顺 113001; 2. 辽宁石油化工大学石油化工学院,辽宁 抚顺 113001)
离子液辅助制备二氧化锰及催化性能研究
李秀萍1,赵荣祥2,刘春生1
(1. 辽宁石油化工大学化学与材料学院,辽宁 抚顺 113001; 2. 辽宁石油化工大学石油化工学院,辽宁 抚顺 113001)
以高锰酸钾和三乙醇胺型离子液为原料合成了二氧化锰,采用X射线衍射技术和扫描电子显微镜考察了二氧化锰的相组成和形貌,并以酸性品红为降解对象考察了二氧化锰的催化性能。结果表明:催化剂的加入量,双氧水的加入量,pH值和焙烧温度对于催化剂的降解活性都有显著的影响,酸性品红降解的最佳条件为:0.05 g的二氧化锰,pH等于7,双氧水的加入量为2 mL。实验还表明催化剂高温煅烧后活性会下降。
二氧化锰;水热;催化剂;品红
氧化锰纳米材料在分子筛、催化材料、锂离子二次电池的正极材料和新型磁性材料等催化、电化学、吸附和磁性质等应用领域显示了广阔的前景[1-3]。氧化锰纳米材料常常以 MnO, MnO2, MnOOH,Mn2O3和Mn3O4等不同的结构形式存在, 其中MnO2以其结构的特殊性而在催化等领域有广泛应用。研究者通过水热法、溶剂热法、模板法和气相沉积法等技术[4-7]制备了大量不同晶型和形貌的 MnO2纳米材料。
近年来,一种被称为“绿色溶剂”的离子液受到了科学界的广泛关注[8-12]。离子液体具有很多优点,如低挥发性、低熔点、宽液程、较强的静电场、较宽的电化学窗口。将离子液与无机物结合, 来制备特殊性能的纳米材料,可以克服了目前常用的高温裂解法制备纳米晶的缺陷, 因此该法得到快速的发展。在本文中,我们以高锰酸钾和三乙醇胺型离子液作为反应物合成了二氧化锰,以酸性品红为目标降解物评价了二氧化锰的催化活性,考察了影响催化效果的因素。
1 实验部分
1.1 仪器及试剂
试剂:三乙醇胺、氟硼酸、高锰酸钾、品红、双氧水、浓盐酸等均为分析纯。
仪器:采用D8 Advance Bruker型X射线衍射仪(功率为 40 kV×40 mA,选用 CuKa辐射,λ=0.15406 nm,采用连续扫描方式收集衍射数据,阶宽0.02°,步扫时间为0.5 s)分析产物的物相组成及结构 ;采用 AMRAY 1840型扫描电子显微镜(SEM,加速电压15 kV)观察产物的形貌及分散情况。
1.2 二氧化锰的合成路线
(1)用量筒取氟硼酸100 mL,再量取三乙醇胺70 mL,将三乙醇胺向氟硼酸中慢慢滴加并保持搅拌30 min,形成三乙醇胺离子液,然后用旋转蒸发仪蒸发掉水分。
(2)秤取高锰酸钾0.474 1 g于烧杯中,加入100 mL去离子水,形成0.03 mol/L的高锰酸钾溶液,将三乙醇胺离子液5 mL溶于100 mL水中,用高锰酸钾溶液缓慢滴入三乙醇胺离子液中在 40 ℃的水浴中搅拌2 h。
(3)将反应后的混合物倒入到聚四氟乙烯的水热釜内,120 ℃下加热12 h,用离子水和无水乙醇对产品洗涤几遍,100 ℃下烘干4 h。
1.3 离子液形成的机理
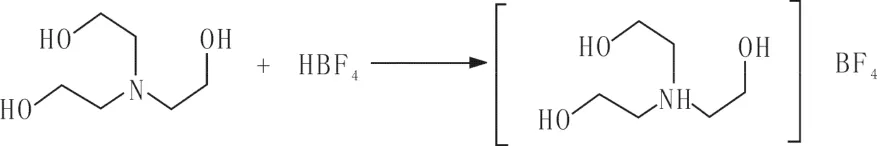
1.4 品红降解性能测定
取品红60 mL、双氧水2 mL和0.010 g二氧化锰粉末于烧杯中,用搅拌器搅拌,每10 min,用胶头滴管吸取上层的清夜,放入80-2型离心机中离心5分钟,将分光光度计的波长调到546 nm,测定品红的吸光度。
2 结果与讨论
2.1 样品的XRD和SEM
图 1 是样品 XRD 图谱,所有在 2θ=12.7◦,18.0◦,28.6◦, 37.5◦,41.9◦,49.7◦, 60.1◦,69.3◦处的衍射峰都与α-MnO2[JCPDS 44-0141]相一致。图2是样品的SEM照片,可以看出所形成的是粒状的MnO2。
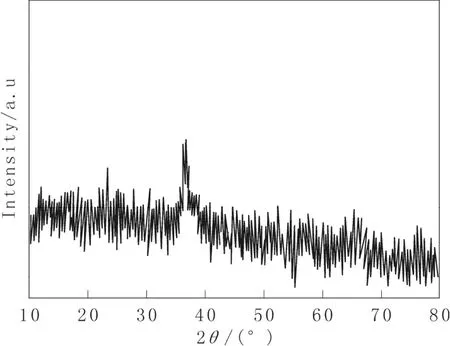
图1 二氧化锰的XRDFig.1 XRD of manganese dioxide

图2 二氧化锰的SEM照片Fig.2 SEM of manganese dioxide
2.2 二氧化锰对品红的降解性能
2.2.1 催化剂用量对催化效果的影响
图3是在反应条件为双氧水的加入量为3 mL,pH值为中性时,考察二氧化锰加入量对吸光度的影响,从图3中可以看出,当不加入催化剂时,品红的讲解率很低,随着二氧化锰加入量的增加,吸光度明显下降,作者认为, MnO2纳米棒催化过氧化氢降解酸性品红的催化反应机制如下:首先, H2O2和酸性品红被吸附到MnO2纳米棒表面;第二步H2O2被MnO2纳米棒表面的活性中心催化分解为自由基,这些初生的自由基一部分在催化剂表面扩散并且和吸附的酸性品红分子反应使其氧化降解, 另一部分自由基从催化剂表面解吸并扩撒到溶液中与溶液中的酸性品红反应, 氧化降解酸性品红; 最后从催化剂表面吸附解吸进入溶液, 使催化剂表面的活性位恢复[13]。
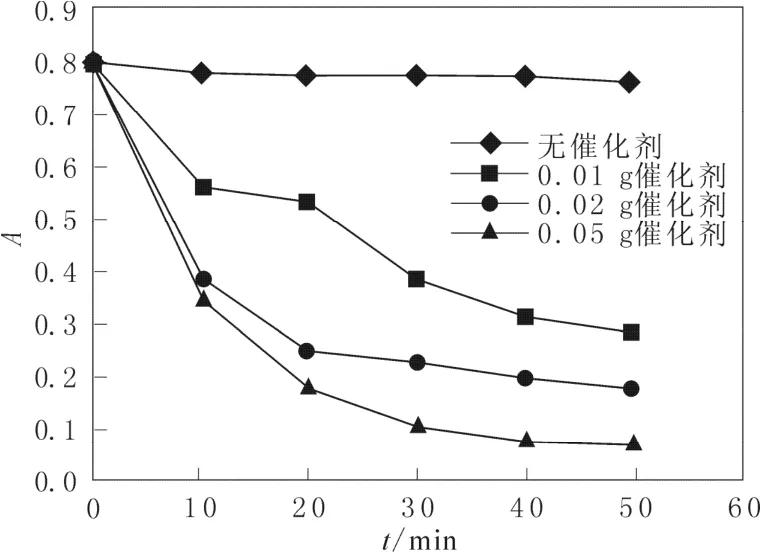
图3 催化剂加入量对吸光度的影响Fig.3 Effect of catalyst dosage on absorbance
2.2.2 双氧水加入量对吸光度的影响
图4 是催化剂加入量为0.05 g时,双氧水加入量对品红吸光度的影响,从图4中可以看出,加入一定量的双氧水品红的降解效果变好,但是加入过多时。双氧水催化效果反而变差,这可能是由于H2O2浓度过大时,催化剂表面吸附的H2O2数量已经达到了极限,限制了酸性品红在催化剂表面的吸附[13]。
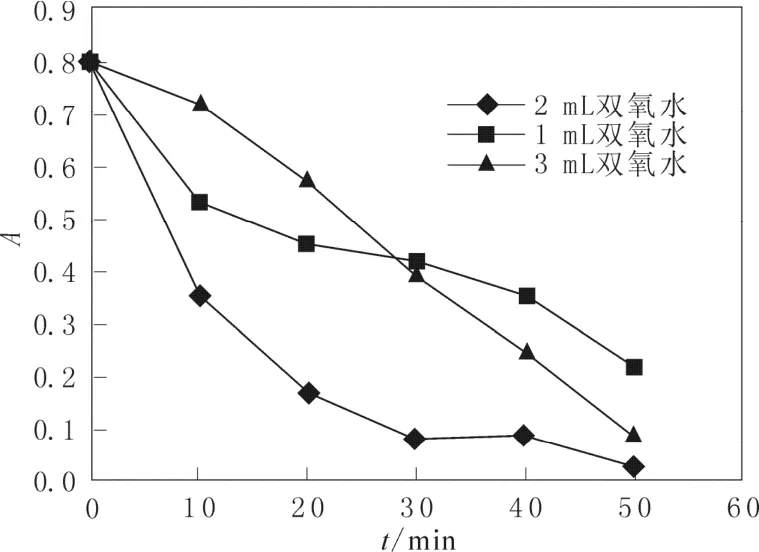
图4 双氧水加入量对吸光度的影响Fig.4 Effect of hydrogen peroxide dosage on absorbance
2.2.3 不同pH值对吸光度的影响
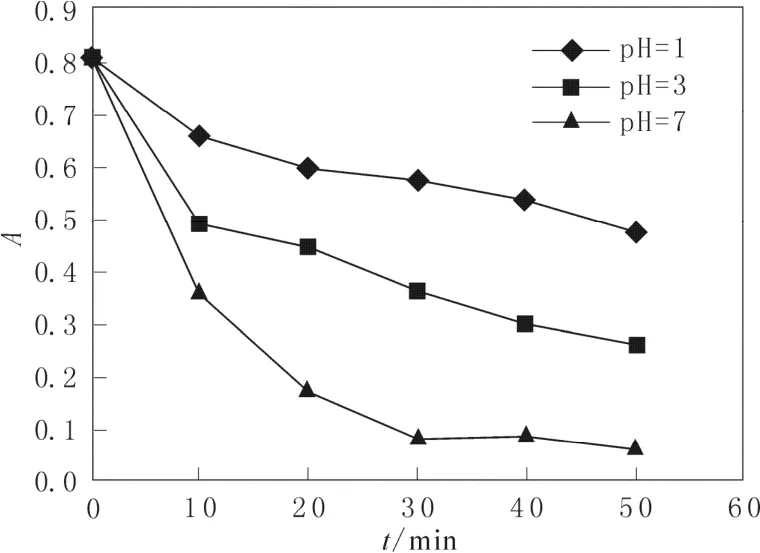
图 5 pH值对吸光度的影响Fig.5 Effect of pH value on absorbance
图5 催化剂的加入量为0.05 g,双氧水的加入量为2 mL时,品红溶液pH值对品红吸光度的影响。从图5中可以看出,当溶液的pH值由1变为7时,品红降解得十分完全,50 min的时间内其吸光值为0.07。有研究表明Mn2+离子催化分解H2O2的活性低,10 min内反应速率即降为0。在反应进行过程中,随着溶液中酸性的增加越来越多的 MnO2被还原为低活性的Mn2+离子,酸性品红的脱色效果也随之变差[13]。
2.2.4 不同温度下煅烧的二氧化锰对吸光度的影响对所得的二氧化锰在不同的温度下进行煅烧,考察煅烧温度对其降解品红活性的影响。结果如图6所示。
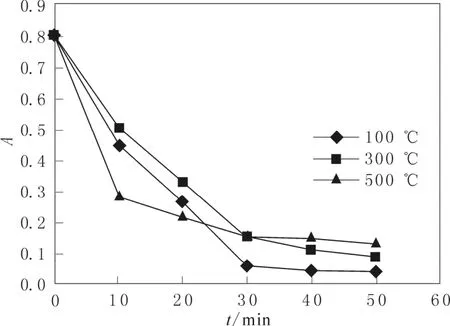
图6 煅烧温度对吸光度的影响Fig.6 Effect of calcination temperature on absorbance
从图中可以看出,较低的煅烧温度有利于品红的降解,50 min内品红的吸光度可以下降到0.035。原因可能在于随着温度的升高,晶粒进一步增大会导致催化剂活性表面积下降,引起催化剂的活性下降。当温度过高时,催化剂甚至会出现明显的烧结,催化活性会明显下降[14]。
3 结 论
本文中,笔者以高锰酸钾和三乙醇胺型离子液作为反应物合成了二氧化锰,并对催化剂的加入双氧水的加入量,pH值,煅烧温度的因素对品红降解效果进行了考察。实验表明,通过高锰酸钾与三乙醇胺型离子液合成的二氧化锰具有较高的催化降解品红的活性。
[1] Shi W, Peng H, Wang N, et al. Free-standing Single Crystal Silicon Nanoribbons[J]. J. Am. Chem. Soc., 2001, 123: 11095-11096.
[2] Xia Y, Yang P, Sun Y, et al. One-Dimensional Nanostructures: Synthesis,Characterization, and Applications [J]. J. Adv. Mater. , 2003, 15:353-388.
[3] Liu Z H, Ooi K. Preparation and Alkali-Metal Ion Extraction/Insertion Reactions with Nanofibrous Manganese Oxide Having 2 × 4 Tunnel Structure [J]. Chem. Mater. , 2003, 15: 3696-3703.
[4]R Ma, Y Bando, L Zhang, et al. Layered MnO2Nanobelts: Hydrothermal Synthesis and Electrochemical Measurements [J]. Adv. Mater., 2004, 16:918-922.
[5] Xi G, Peng Y, Zhu Y, et al. Preparation of β-MnO2nanorods through a γ-MnOOH precursor route [J]. Mater. Res. Bull. , 2004, 39:1641-1648.
[6] Zhang L, Liu Z H, Tang X , et al. Synthesis and characterization of β-MnO2single crystals with novel tetragonous morphology [J]. Mater. Res. Bull.,2007, 42:1432-1439.
[7] Zhang L, Liu Z H, Lü H, et al. Shape-Controllable Synthesis and Electrochemical Properties of Nanostructured Manganese Oxides[J]. J.Phys. Chem.C , 2007, 111: 8418-8423.
[8] Dai S, Ju H Y, Gao H J, et al. Preparation of silica aerogel using ionic liquids as solvents[J]. Chem. Commun., 2000, (3): 243-244.
[9] Jacob D S, Joseph A, Mallenahalli S P, et al. Rapid Synthesis in Ionic Liquids of Room-Temperature-Conducting Solid Microsilica Spheres[J].Angew. Chem. Int. Ed, 2005, 44:6560-6563.
[10] Knang D B, Brezesinski T, Smarsly B. Hierarchical Porous Silica Materials with a Trimodal Pore System Using Surfactant Templates[J]. J.Am. Chem. Soc., 2004, 126, 10534-10535.
[11] Ma Z, Yu J H, Dai S. Preparation of Inorganic Materials Using Ionic Liquids[J]. Adv. Mater., 2010, 22( 2) : 261-285.
[12] Zheng W J, Liu X D, Yan Z Y, et al. Ionic Liquid-Assisted Synthesis of Large-Scale TiO2Nanoparticles with Controllable Phase by Hydrolysis of TiCl4[J]. ACS Nano, 2009,3( 1) :115-122.
[13] 李秀萍,赵荣祥.二氧化锰纳米棒的制备和催化性能研究[J].当代化工,2011,40(1):33-45.
[14] 吴玉琪, 吕功煊, 李树本. 纳米WO3粉体的制备与光催化活性研究[J].化学学报, 2004, 62(12):1134-1138.
Ionic Liquids Assisted Preparation of Manganese Dioxide and Its Catalytic Properties
LI Xiu-ping1,ZHAO Rong-xiang2,LIU Chun-Sheng1
(1. School of Chemistry and Materials Science, Liaoning Shihua University, Fushun Liaoning 113001, China;2. School of Petrochemical Engineering,Liaoning Shihua University, Fushun Liaoning 113001, China)
Manganese dioxide was synthesized from potassium permanganate solution and triethanolamine ionic liquid.Phase composition and morphology of manganese dioxide were studied by XRD and scanning electron microscopy. Using acid fuchsin as a degradation object, catalytic property of manganese dioxide was studied. The results show that catalyst dosage, hydrogen peroxide dosage, pH value and calcination temperature have significant impact on the degradation activity of the catalyst. The optimal degradation conditions of acid fuchsin are as follows:manganese dioxide 0.05 g, pH 7, hydrogen peroxide 2 mL. Experiments also show that high-temperature calcination can reduce the catalyst activity.
Manganese dioxide;Ionic liquids; Catalyst;Acid fuchsin
TQ 267+.2
A
1671-0460(2012)01-0026-03
2011-10-09
李秀萍(1975-),女,辽宁沈阳人,讲师,硕士,2001年毕业于辽宁石油化工大学分析化学专业,研究方向:纳米材料制备。
E-mail:zhaorongxiang@sina.com,电话:024-56865249。
