食管癌放射抗拒与P-gp、HER-2及microRNA-296表达的相关性*
2012-11-06吴清明
朱 睿, 吴清明, 龙 辉, 程 静, 李 欢
(1武汉科技大学,2武汉科技大学附属天佑医院,湖北 武汉 430064)
1000-4718(2012)03-0550-04
2011-10-09
2011-12-05
湖北省自然科学基金资助项目(No.2010CDB03505)
△通讯作者 Tel:027-51164093;E-mail:wuhe9224@sina.com
食管癌放射抗拒与P-gp、HER-2及microRNA-296表达的相关性*
朱 睿1, 吴清明2△, 龙 辉2, 程 静2, 李 欢2
(1武汉科技大学,2武汉科技大学附属天佑医院,湖北 武汉 430064)
目的探讨P-糖蛋白(P-gp)、人表皮生长因子受体2(HER-2)及microRNA-296的表达与食管癌放射抗拒的相关性。方法将人食管癌细胞Eca109分为对照组和处理组,处理组通过X射线反复照射(累计放射剂量60 Gy),采用MTT法检测2组细胞的增殖抑制率。免疫细胞化学法测定P-gp和HER-2的表达。Northern blotting法测定microRNA-296的表达。结果处理组细胞较对照组显示出明显的放射抗性,增殖抑制率明显低于对照组细胞。免疫细胞化学测定P-gp和HER-2在处理组中较对照组表达显著增加。2组细胞中microRNA-296表达无显著差异。结论P-gp、HER-2可能与食管癌放射抗拒有关;暂不能说明microRNA-296与食管癌细胞Eca109放射抗拒具有相关性。
食管肿瘤; 放射抗拒; microRNA-296; 受体,人表皮生长因子
食管癌是常见的恶性肿瘤之一,发展迅速且预后较差[1],全世界每年约有48万新发病例,随着人口的增加,其发病总数还在不断增加。其生物学特点具有侵润性、早期转移和放、化疗抵抗性[2],对于其机制尚不明确。
P-糖蛋白(P-glycoprotein,P-gp)是由多药耐药基因1(multidrug resistance 1,MDR1)编码的一种能量依赖跨膜糖蛋白,在多药耐药基因MDR1高表达的肿瘤细胞中,表达显著增加[3],两者间呈高度相关性。P-gp可通过稳定线粒体膜电位,上调肿瘤细胞线粒体膜通透性而抑制X射线的凋亡效应。
人表皮生长因子受体 2(human epidermal growth facotr receptor 2,HER-2)是人表皮生长因子受体家族中的重要成员之一,在很多恶性肿瘤中都表现为过表达或基因扩增。HER-2通过PI3k/Akt通路,调节NF-κB活性以及c-Myc,发挥放射抗拒效应。
微小RNA(microRNA)是一种广泛存在于真核生物中、大小约21~25个核苷酸的内源性单链小分子RNA[4]。这类小分子在恶性肿瘤内异常表达,通过抑制mRNA的降解和翻译[5]发挥作用。MicroRNA-296(miR-296)是长度为21 nt的微小RNA,具有胚胎干细胞特异性[6]。有研究发现,miR-296与食管癌化疗耐药性的发生有关[2]。到目前为止,尚没有与食管癌放射抗拒的相关研究,本实验采用对食管癌Eca109细胞进行反复照射,诱导细胞产生放射抗拒性,用以探讨miR-296与食管癌放射抗拒是否相关。
材 料 和 方 法
1实验仪器
CO2恒温细胞培养箱(Heal Force),倒置显微镜(Olympus),超净工作台(苏州净化),酶联免疫检测仪(ELX800),超速低温离心机(Sigma),37 ℃恒温水浴箱(华普达公司)。
2细胞株及主要试剂
人食管癌细胞株Eca109(由太和医院惠赠);RPMI-1640培养粉(Gibco),胰蛋白酶粉(Amresco),新生胎牛血清(杭州四季青有限公司),MTT、DMSO(Sigma),P-gp单克隆抗体(鼠抗人)、HER-2单克隆抗体(兔抗人)均购自Santa Cruz,SP试剂盒(北京中杉生物技术有限公司)。
3主要方法
3.1细胞培养 人食管癌Eca109细胞株常规培养于含10%胎牛血清、1×105U/L青霉素及1×105U/L链霉素的RPMI-1640培养基中,置37 ℃、5%CO2培养箱内培养。
3.2食管癌细胞株的处理 采用Varian 2300直线加速器6MV-X线照射,表面加1.5 cm标准等效填充物,放射源至标本距离100 cm,照射野10 cm×10 cm,吸收剂量率为1.5 Gy/min。取对数生长期的亲本Eca109细胞X射线照射8 Gy,立即放回培养箱中继续培养,待照射后的细胞增长至接近长满瓶底时,0.25%胰蛋白酶消化细胞,重新接种培养。细胞长至对数期后,再次X射线照射8 Gy。重复以上过程,累计照射剂量至60 Gy后进行检测[7]。
3.3MTT实验测定增殖抑制率 取对照组(未处理食管癌Eca109细胞)和处理组(X射线处理)同时给予0、2、4、6、8 Gy的剂量照射。照射完毕后,立即制成细胞悬液,按5 000 cells/well接种于96孔板,6个复孔,同时设空白组(无细胞的培养液),5%CO2、37 ℃条件下培养。于72 h加入5 g/L MTT 20 μL,37℃继续孵育4 h,终止培养。小心吸去孔内上清液,加入DMSO 150 μL,置摇床上振荡10 min,使结晶体充分溶解,在酶标仪上选择490 nm滤光片测定A值,并记录结果。
3.4细胞免疫组化 取对数生长期的对照组和处理组细胞,按5×107cells/L的细胞密度接种于6孔板中已灭菌处理的盖玻片上,每孔2 mL,孵育24 h后取出盖玻片,4%多聚甲醛固定,3%H2O2-甲醇去除内源性过氧化酶活性,10%正常山羊血清封闭15 min,分别加入鼠抗人P-gpⅠ抗、兔抗人HER-2Ⅰ抗,4 ℃湿盒过夜,加入相应的Ⅱ抗,DAB显色,置于显微镜下观察,待显色充分后,流水冲洗终止反应。苏木素复染,盐酸乙醇分化,二甲苯透明,树胶封片,镜下观察,照相。P-gp蛋白阳性产物主要位于细胞浆,HER-2蛋白阳性产物主要位于细胞膜,在显微镜下随机计数5个高倍视野的细胞。免疫细胞化学结果判定按文献介绍的染色强度指数计算法,综合阳性细胞及染色强度所占百分比2个方面进行半定量分析。染色强度评分:0分:无或染色极淡(阴性-);1分:浅棕黄色(弱阳性+);2分:棕黄色(阳性++);3分:棕褐色(强阳性+++)。阳性细胞百分比(A、B、C、D)分别是-、+、++、+++各种染色强度细胞的百分比。染色强度指数=A×0+B×1+C×2+D×3。
那么,什么是“危机意识”呢? 在此,就必须与徐复观先生所提出的“忧患意识”进行对比分析。 所谓“忧患意识”,首先,它不是来源于对人所无法解决的末日的恐怖与对神的拯救的祈求,而是通过现实的人的行为去寻求解决当前困境或即将发生的困境的思路,以一种预见或假设的方式为其规划自己尚未实行的实际行为以求得对困境的解决。 正因为有着现实存在的社会忧患,身为当事者的人才会对此进行一种反应,并在不断的预设中发现自身行为对结果所产生的影响。 从而产生出对自身行为及行为所能够引发的结果的重视,即责任感。[5]85-89
3.5Northern blotting检测 取对数生长期的对照组和处理组食管癌Eca109细胞,按Trizol操作手册提取细胞总RNA后,用紫外分光光度计和琼脂糖电泳检测RNA的完整性。准备12% 7 mol/L尿素变性胶,在0.5×TBE中350~400V预电泳1 h,每组样品各15 μL总RNA上样,电泳,当溴酚蓝电泳至4/5处停止电泳;半干转印至尼龙膜;1 200 mJ UV照射;膜于57℃预杂交30min;然后在杂交液中加入100 μg/L的miR-296探针(按照Roche的Dig Oligonucleotide 3’-End Labeling Kit的说明书进行地高辛标记),杂交过夜。杂交结束后室温下5%SDS,1×SSC洗10 min,57 ℃下同样溶液洗3次,压磷屏过夜,Typhoon同位素成像仪(GE)扫描同位素信号。
4统计学处理

结 果
12组细胞增殖抑制率变化
2组细胞在放疗72 h后,处理组的细胞增殖抑制率明显低于对照组(P<0.05),见表1,说明处理组细胞比对照组放射敏感性低,具有一定的放射抗拒性。

表1 放疗后的增殖抑制率
P-gp阳性染色主要位于胞膜和胞浆,HER-2阳性染色主要位于胞膜,2组细胞中P-gp和HER-2均有表达,见图1、2。根据文献查阅细胞免疫化学染色指数评定,P-gp在对照组染色强度指数为0.718±0.123,处理组染色强度指数为1.524±0.423;HER-2在对照组染色强度指数为0.402±0.089,处理组染色强度指数为1.196±0.230,差异有统计学意义(P<0.01)。
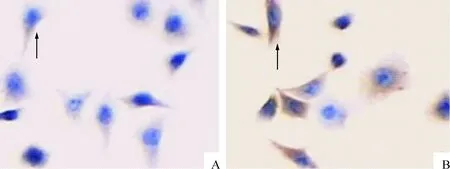
Figure 1. The expression of HER-2 in esophageal squamous carcinoma cells Eca109(×200).A: control group; B: treatment group.
图1HER-2在食管癌细胞Eca109中的表达
Figure 2. The expression of P-gp in esophageal squamous carcinoma cells Eca109(×200).A: control group; B: treatment group.
图2P-gp在食管癌细胞Eca109中的表达
3Northernblotting检测miR-296的表达
2组细胞中均有miR-296表达,见图3,由于U6基因含量的稳定性,选取U6作为非特异性基因条带,与miR-296特异性基因条带进行密度比值分析,对照组miR-29相对值为0.032500±0.001590,处理组的相对值为0.034127±0.003151,两者差异无统计学意义(P>0.05)。

Figure 3. The miR-296 expression detected by Northern blotting.1,3,5:control group; 2,4,6:treatment group.
图3Northernblotting检测miR-296的表达
讨 论
目前我们对于食管癌的诊治情况较前取得了很大的改善,但其5年生存率仍在20%左右。导致肿瘤治疗失败的原因是肿瘤细胞对治疗的抵抗性以及肿瘤的局部复发和远处转移[6]。放射抗拒是一个多基因参与的过程,前期我们在食管癌的放射抗拒机制方面的研究中,推测食管癌的放射抗拒性与MDR1/P糖蛋白等有关。
本实验通过分次照射、克隆培养,得到具有放射抗性的处理组细胞。MTT实验检测2组细胞的增殖抑制率,结果显示处理组细胞株的增殖抑制率低,即放射敏感性低。免疫细胞化学法2组细胞中P-gp和HER-2均有表达,但处理组细胞中,两者表达显著增加(P<0.01)。进一步证实了处理组细胞的放射抗性。HER-2的过表达对乳腺癌放射抗拒性的产生已有证实,而对于HER-2的过表达与食管癌中的放射抗拒性尚无相关报道。通过本实验,提示HER-2可能与食管癌放射抗拒有关。
Hristo等[6]采用Northern blotting分析胚胎干细胞中microRNA的表达,发现miR-296具有胚胎干细胞特异性。Hong等[2]在食管癌旁组织、食管原位癌及食管鳞状细胞癌中测定miR-296有表达,且呈递增型。说明miR-296可能与食管癌的发生、发展密切相关。并且指出,miR-296与食管癌的化疗耐药相关,其机制是因为MDR1 可能是miR-296的目标调节基因,下调miR-296,MDR1的表达随之下调。对于miR-296与食管癌的放射抗拒是否相关,目前暂无报道。本实验采用Northern blotting测定食管癌细胞和X射线诱导出有一定放射抗性的细胞中miR-296的表达情况,发现两者间并无明显差异(P>0.05),暂不能说明miR-296与放射抗拒间具有相关性。
分析其原因,可能有以下几种情况:其一,miR-296与食管癌放射抗拒确无相关性,不参与食管癌放射抗拒机制的产生。MiR-296调节MDR1,而MDR1与P-gp高度相关,但有文献[8]指出,MDR1基因扩增并不总是能促进蛋白的过度表达,而蛋白的过度表达也不一定依赖基因扩增引起,两者之间存在着其它未知的作用机制参与MDR1的转录、翻译的调控。其二,miR-296与食管癌放射抗拒相关。但放射抗拒的产生是一个复杂的过程,有多种基因参与。射线照射后,会立即出现一系列快速反应蛋白,而在后期表达恢复。miR-296可能参与射线照射后的快速反应机制。其三,DNA也具有自我修复功能,对于紫外照射所形成的DNA碱基二聚体,例如T-T二聚体,细胞可通过光修复作用解聚或切除修复。另外,文献显示[9]人脑肿瘤的血管内皮细胞相比正常脑血管内皮细胞,miR-296的表达升高。在体内异种移植miR-296抑制物,血管生成减少。此外,在NIH3T3细胞中,经UVB照射后,miR-296表现为低表达。说明miR-296可能参与DNA的损伤修复[10]。
[1] Hongo M, Nagasaki Y, Shoji T. Epidemiology of esophageal cancer: Orient to Occident. Effects of chronology, geography and ethnicity[J].J Gastroen Hepatol,2009,24(5):729-735.
[2] Hong L, Han Y, Zhang H, et al. The prognostic and chemotherapeutic value of miR-296 in esophageal squamous cell carcinoma[J]. Ann Surg,2010,251(6):1056-1063.
[3] 王 艳,吴清明,童 强,等.食管癌放射抗拒细胞P-gp和GST-π表达的研究[J].重庆医学,2008,37(8):825-827.
[4] 黄金明,叶 进,陈立波. MicroRNA与HBV相关性肝癌发生发展关系的研究进展[J].世界华人消化杂志,2008,16(6):645-652.
[5] Yoon A, Gao R, Kaul Z, et al. MicroRNA-296 is enriched in cancer cells and downregulates p21WAF1mRNA expression via interaction with its 3’ untranslated region[J]. Nucleic Acids Res,2011,39(18):8078-8091.
[6] Houbaviy HB,Murray MF,Sharp PA. Embryonic stem cell-specific microRNAs[J]. Dev Cell,2003,5(2):351-358.
[7] 金 曙,吴清明,于皆平.NS398对放射抗拒食管鳞癌细胞的放射增敏作用[J].医药导报,2006,25(7):613-615.
[8] 徐晓妹,林惠忠,鲁 杰,等.多药耐药基因MDR1及P-pg蛋白在乳腺癌组织中的表达及临床意义[J].肿瘤防治杂志,2005,12(15):1150-1153.
[9] Würdinger T, Tannous BA, Saydam O, et al. miR-296 regulates growth factor receptor overexpression in angiogenic endothelial cells[J]. Cancer Cell,2008,14(5):382-393.
[10]Guo L, Huang ZX, Chen XW, et al. Differential expression profiles of microRNAs in NIH3T3 cells in response to UVB irradiation[J]. Photochem Photobiol,2009,85(3):765-773.
ExpressionofP-gp,HER-2andmicroRNA-296isassociatedwithradiationresistanceinesophagealcarcinoma
ZHU Rui1, WU Qing-ming2, LONG Hui2, CHENG Jing2, LI huan2
(1WuhanUniversityofScienceandTechnology,2TianyouHospitalAffiliatedtoWuhanUniversityofScienceandTechnology,Wuhan430064,China.E-mail:wuhe9224@sina.com)
AIM: To investigate whether the expression of P-glycoprotein (P-gp),human epidermal growth factor receptor 2(HER-2)and microRNA-296 is associated with the radiation resistance in esophageal cancer.METHODSThe human esophageal squamous carcinoma cell line Eca109 was divided into control group and treatment group. The cells in treatment group were irradiated by X-ray repetitiously (cumulative radiation dose 60 Gy). The difference of the cell proliferation inhibition between the 2 groups was determined by MTT assay. The expression of P-gp and HER-2 in the cells was detected by immunocytochemical method. The differential expression of microRNA-296 in the cells of the 2 groups were identified by Northern blotting.RESULTSCompared with control group, a clear radiation resistance and lower growth inhibition were observed in treatment group. The expression of P-gp and HER-2 in treatment group increased significantly than that in control group. No significant difference of microRNA-296 expression between the 2 groups was observed.CONCLUSIONP-gp and HER-2 are relevant with radiation resistance in esophageal cancer. No significant association between microRNA-296 and radiation resistance in Eca109 cells is showed.
Esophageal neoplasms; Radiation resistance; microRNA-296; Receptors,human epidermal growth factor
R735.1
A
10.3969/j.issn.1000-4718.2012.03.030
