食药用真菌粗提物促血管内皮活性的筛选及对高糖损伤内皮的保护作用*
2012-11-06黄华玮余惠珍朱鹏立叶章正阮景明
黄华玮, 余惠珍, 朱鹏立, 叶章正, 阮景明, 林 帆
(福建医科大学省立临床医学院,福建省立医院,福建 福州 350001)
1000-4718(2012)03-0499-07
2011-12-16
2012-02-13
福建省医学创新基金资助项目(No. 2011-CXB-3)
△通讯作者 Tel: 0591-87557768-7058; E-mail: vivian198543@163.com
食药用真菌粗提物促血管内皮活性的筛选及对高糖损伤内皮的保护作用*
黄华玮, 余惠珍, 朱鹏立△, 叶章正, 阮景明, 林 帆
(福建医科大学省立临床医学院,福建省立医院,福建 福州 350001)
目的观察古尼虫草、花脸香菇、冬虫夏草和巴西革耳4种食药用真菌粗提物对高糖诱导的人脐静脉内皮细胞(HUVECs)增殖活性的作用,筛选具有保护内皮细胞活性的有效菌菇并探讨其对HUVECs细胞周期及活性氧簇(ROS)水平的影响。方法体外培养HUVECs,分为对照组 (M199正常培养液)、高糖组(33 mmol/L高糖培养液)、4种食药用真菌(古尼虫草、花脸香菇、冬虫夏草和巴西革耳)粗提物干预组 (每种粗提物以终浓度12.5、25、50、100 mg/L+高糖培养液),以四甲基偶氮唑蓝(MTT)比色法检测细胞增殖活性,流式细胞术检测细胞周期及细胞内ROS水平。结果与对照组相比,高糖组HUVECs 的MTT吸光度值显著下降,G0/G1期的细胞百分率明显增加,S+G2/M期的细胞百分率明显下降,且ROS水平亦增加(均P<0.05)。与高糖组相比,花脸香菇和巴西革耳粗提物干预降低了细胞吸光度值(P<0.05),且抑制效应呈剂量依赖性增强,而古尼虫草粗提物对其无影响。冬虫夏草粗提物(12.5~50 mg/L)显著提高了HUVECs的增殖活性(P<0,05),减少了G0/G1期细胞百分率,提高了S+G2/M期的细胞百分率(P<0.05),降低了细胞内ROS水平(均P<0.05),且效应呈剂量依赖性增强。结论4种食药用真菌粗提物经MTT比色法筛选后,仅冬虫夏草粗提物对高糖诱导的HUVECs有显著保护作用,其可能通过促进内皮细胞增殖、进入细胞周期及降低细胞内活性氧水平途径。
食药用真菌; 高糖; 人脐静脉内皮细胞; 冬虫夏草; 细胞周期; 活性氧簇
氧化应激是糖尿病血管并发症的重要发病机制之一[1],且血管内皮细胞是高糖毒性作用的主要靶细胞[2]。因此,减轻内皮细胞氧化应激水平,可改善内皮功能不全,进而预防、延缓和改善糖尿病血管并发症病程进展。目前,很多人工合成抗氧化剂在有效抑制细胞活性氧簇(reactive oxygen species,ROS)生成的同时,亦干扰了机体正常氧化还原反应,毒副作用大,因而临床应用明显受限[3],故开发安全有效的天然抗氧化剂已成为现今研究热点。
食药用真菌具有食用价值及抗菌、抗病毒、免疫调节、抗肿瘤等多种生物活性[4],与人类生活密切相关。近年来,发现一些食药用真菌可通过降压[5]、降脂[6]、降糖[7]、清除自由基[3]等作用发挥卓越的心血管保护作用,但其针对血管内皮细胞的研究甚少。因此,本实验选取花脸香菇、巴西革耳、古尼虫草、冬虫夏草4种食药用真菌粗提物,筛选出具有血管内皮细胞保护作用的菌菇,并探讨其作用机制,为临床应用天然中草药防治糖尿病血管病变提供理论依据。
材 料 和 方 法
1材料
花脸香菇(Lepistalentinusextract,LLE)、巴西革耳 (Lentinusstriguellusextract,LSE)、冬虫夏草(Cordycepssinensisextract,CSE)和古尼虫草粗提物(Cordycepsgunniiextract,CGE)由福建师范大学生命科学院提供,用二甲基亚砜(dimethyl sulfoxide,DMSO)溶解(DMSO浓度<0.1%);M199干粉培养基、胎牛血清(FBS)和0.25%胰蛋白酶/EDTA购自Gibco,胶原酶Ⅰ型购自Invitrogen,贝复济(basic fibroblast growth factor, bFGF)购自珠海亿胜生物制药有限公司,兔抗人第八因子相关抗原免疫组化多克隆抗体及相关Ⅱ抗购自福州迈新公司,D-葡萄糖粉、DMSO、四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)和碘化丙啶(propidium iodide,PI)购自Sigma,活性氧检测试剂盒购自碧云天公司。
2方法
2.1人脐静脉内皮细胞(human umbilical vein endothelial cells ,HUVECs)的培养及鉴定 无菌操作下取行剖宫产术的健康产妇的脐带,约30~40 cm。尽快于超净台中,75%乙醇擦拭脐带表面及两端,剪去夹痕,进行脐带插管,用无菌PBS冲洗静脉腔残血,再注入预温的1%胶原酶使之充盈,于培养箱中孵育15min后收集消化液,并用PBS冲洗静脉腔,合并两液,1 000 r/min离心10 min,弃上清,以M199完全培养液(含10%胎牛血清、青霉素1×105U/L、链霉素100 mg/L、100 mg/L贝复剂 、2 mmol/L谷氨酰胺、1×105U/L肝素)重悬细胞后,接种于25 cm2培养瓶,置于37 ℃、5%CO2培养箱。24 h后换液以去除未贴壁细胞和红细胞,以后隔天换液,待细胞融合至80%,用0.25%胰酶+0.02%EDTA消化传代,选2~5代细胞用于实验 。采用显微镜下肉眼观察结合免疫细胞化学染色法(利用兔抗人Ⅷ因子相关抗原免疫组化多克隆抗体及相关Ⅱ抗检测Ⅷ因子)进行内皮细胞鉴定。细胞形态呈鹅卵石形态,及Ⅷ因子免疫荧光标记95%以上为阳性时可用于实验。
2.2实验分组及处理方法 将培养的细胞分成:(1)正常对照组:培养液为含10%血清的M199完全培养液;(2)高糖组:培养液为含33 mmol/L D-葡萄糖的10%血清M199培养液;(3)真菌粗提物+高糖组:含终浓度为12.5、25、50、100 mg/L的4种食药用真菌粗提物+高糖M199完全培养液。按实验分组,分别加入相应处理因素,孵育48 h后检测相关指标。
2.3MTT比色法测定HUVECs增殖活力 收集对数生长期HUVECs,按密度5 000 cells/well接种于96孔板中,每孔200 μL,置于37 ℃、5%CO2培养箱孵育24 h后同步化24 h,再根据上述实验分组,每组6个复孔,并设空白对照孔(只加培养液),同样设6个复孔,继续培养48 h后终止。加20 μL/well浓度0.5 g/L MTT,置于培养箱继续培养4 h。小心吸取各孔培养液,加入150 μL/well DMSO,微振荡15 min,选择490 nm为测定波长,在酶联免疫检测仪下测吸光度(A值),取均数反映细胞增殖活性。
2.4流式细胞仪检测细胞周期 将细胞培养于6孔板中,同步化后按上述分组干预HUVECs 48 h后,收集各组细胞,PBS洗涤细胞2次,用70%冰乙醇5 mL固定细胞过夜,800 r/min离心5 min,PBS洗涤细胞2次,加入含RNase A的PBS 500 μL(终浓度 50 mg/L),37 ℃水浴孵育30 min,再加入碘化丙啶PI使其终浓度为50 mg/L,4 ℃避光30 min,300目尼龙网过筛,上流式细胞仪检测和分析。
2.5流式细胞仪检测细胞内ROS水平 将细胞培养于6孔板中同步化后,按上述分组干预培养48 h。将处理好的细胞用PBS洗3次,每孔加入含10 μmol/L的H2DCF-DA的培养液1 mL,37 ℃避光孵育20 min;弃含荧光探针的培养液,PBS洗3次,胰酶消化,收集细胞,用流式细胞仪计数10 000个细胞,以检测细胞内平均荧光强度反映细胞内ROS水平。
3统计学处理
结 果
1人脐静脉内皮细胞形态及鉴定
倒置相差显微镜下观察发现,原代培养的脐静脉内皮细胞最初呈圆形,单个或聚集成团。培养2~3 d,细胞生长迅速,集落增大,并开始汇合成排列较疏松的单细胞,此时细胞较大,细胞核呈椭圆形,常有2~5个核仁。4 d后,完全汇合形成连续的单层细胞,融合成片后外观呈特征性的“鹅卵石”样形态,排列致密,胞浆丰富,见图1A。
免疫组化检测Ⅷ因子相关抗原,在显微镜下可观察到HUVECs阳性着色位于胞浆内和细胞核周围,呈棕红色,核质界限清晰,可清楚反映细胞核的形状,见图1B。

Figure 1. Characterization of HUVECs. A: Typical appearance of primary cultured HUVECs (×200). B: Immunohistochemistry revealed that the majority of HUVECs were factor Ⅷ relative antigen positive reaction (×200).
图1人脐静脉内皮细胞形态及鉴定
24种食药用真菌粗提物对HUVECs增殖活性的影响
高糖(33 mmol/L)作用48 h后, HUVECs 的A值显著低于正常对照组(P<0.05)。 与高糖组相比,CGE(12.5~100 mg/L)干预后HUVECs的A值无明显改变(P>0.05);LSE及LLE随着干预浓度增加(12.5~100 mg/L),各组A值均显著降低(P<0.05),并呈剂量依赖性递减趋势;而CSE(12.5~50 mg/L)干预后, HUVECs的A值显著增加(P<0.05),并呈剂量依赖性;但在100 mg/L CSE作用下,A值反而稍下降,但较高糖组仍有所上升,且有统计学差异(P<0.05),见图2。
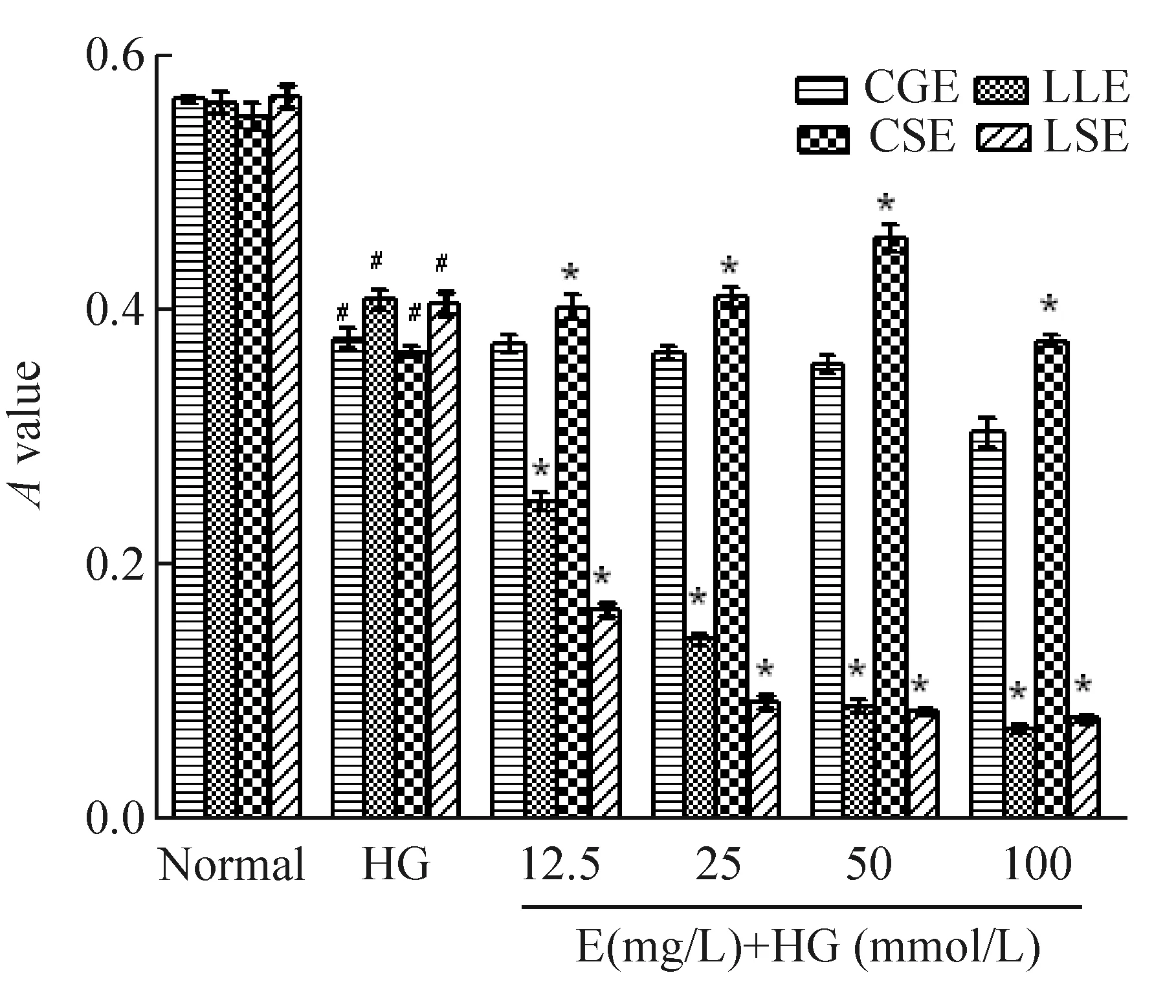

图24种食药用真菌粗提物对HUVECs吸光度(A值)的影响
3冬虫夏草粗提物对HUVECs细胞周期的影响
由图3显示,与正常对照组比较,高糖作用48 h后,促使更多HUVECs阻滞于G0/G1期(P<0.05),并显著减少进入合成期(S)和分裂期(G2/M)的HUVECs(P<0.05)。而与高糖组相比,随CSE干预浓度增加(12.5~50 mg/L),HUVECs进入细胞S期和G2/M期的比例呈递增趋势(P<0.05),且HUVECs处于G0/G1期的比例呈递减趋势(P<0.05);但100 mg/L CSE对细胞周期的影响反而减少,但处于G0/G1期的细胞百分率仍低于高糖组(P<0.05),S+G2/M期的细胞百分率亦仍高于高糖组(P<0.05)。
4冬虫夏草对高糖诱导的HUVECs内ROS水平的影响
以DCFH-DA为荧光探针,用流式细胞仪检测HUVECs内ROS水平。结果表明,高糖干预48 h后HUVECs内的DCF荧光强度显著高于对照组(P<0.05)。与高糖组相比,随着CSE干预浓度的增加(12.5~50 mg/L),细胞内的DCF荧光强度逐渐下降(P<0.05),但100 mg/L CSE的荧光强度反而略升高,但仍低于高糖组(P<0.05),见图4。
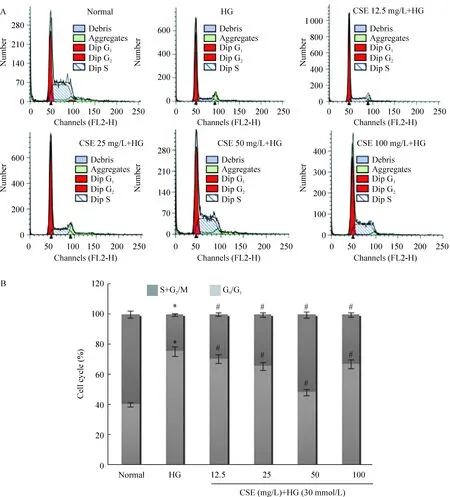

图3冬虫夏草粗提物对HUVECs细胞周期分布的影响
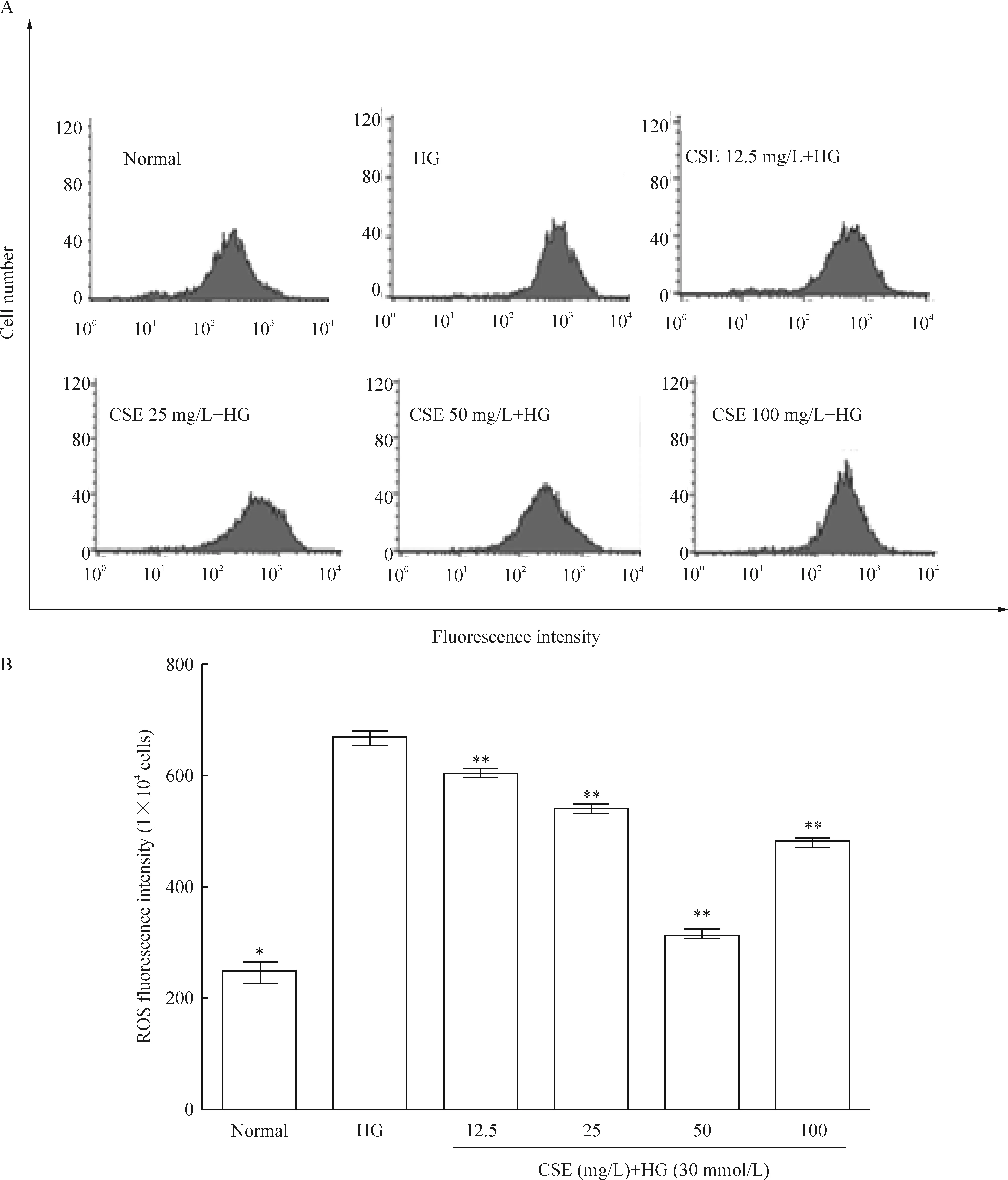

图4冬虫夏草粗提物对HUVECs活性氧的影响
讨 论
微血管及大血管病变是糖尿病患者致残和死亡的首要原因[8-9]。目前认为,氧化应激、糖脂代谢紊乱、胰岛素抵抗、炎症反应、糖基化反应等多种因素贯穿发病始末,紧密关联,并形成正反馈循环[8-9]。而血管内皮功能障碍广泛存在于糖尿病患者中,是糖尿病血管病变的早期重要事件[10],由此阻断糖尿病血管病变相应致病环节,打破多个致病因素交互而形成的恶性循环,从而改善血管内皮功能,对防治糖尿病血管病变发生发展,提高患者生存率及生活质量尤为重要。
因此,本实验选用高糖刺激的HUVECs损伤,模拟糖尿病时血管内皮发生的病理改变。MTT比色法是测定活细胞线粒体中的琥珀酸脱氢酶含量,其与细胞数量、细胞活性成正比,已广泛应用于检测多种生物活性因子的活性,药物毒性等,也因其具有简单、快捷、经济、准确等优点,成为药物活性体外筛选的常用方法。本实验应用MTT法发现,高糖刺激明显降低了血管内皮细胞的增殖活性,花脸香菇和巴西革耳粗提物可进一步抑制高糖诱导的HUVECs的活性,且抑制作用呈浓度依赖性;而古尼虫草粗提物对内皮细胞的增殖活性无明显影响。该结果提示,花脸香菇、古尼虫草、巴西革耳从药效学角度可能被视为无效。但食药用真菌成分复杂,含有丰富多样的生物活性物质,如:多糖、肽类、萜类、腺苷等,且不同单体可各自发挥着不同甚至相互拮抗的生物学效应。因此,虽然中草药的粗提物形式能很大程度地反映药物的组成和功用,但由于不同食药用真菌具有生物活性或医疗效用的单体成分的组成比例存在差异,故粗提物无保护血管内皮的药理学效应,并不意味着它们就不具有可发挥保护内皮作用的单体成分。所以,本实验尚不能排除花脸香菇、巴西革耳以及古尼虫草在保护血管内皮领域的潜在可能性,是否再通过其它的检测手段,有待于进一步研究证实。
冬虫夏草是我国一种名贵的中草药,其富含核苷类、虫草酸、多糖及多种氨基酸、维生素和微量元素等生物活性成分,在抗肿瘤、保护调节肾脏、肝脏及心肺功能等领域有较为明确的作用[8]。以国产宁心宝胶囊为代表的虫草制剂已广泛使用于临床,在抗心律失常、降血脂、血压方及心肌保护方面取得良好疗效[11]。近年来的动物实验发现冬虫夏草可改善肾性高血压大鼠的血管重构[12]及行颈动脉球囊剥脱术SD大鼠的大动脉平滑肌迁移和增生[13]等血管病理改变,但至今国内外关于冬虫夏草对血管内皮细胞发挥直接保护作用却鲜有报道。与此同时,冬虫夏草应用于糖尿病及并发症的研究亦成为新的热点[14],故冬虫夏草能否防治糖尿病血管病变值得探讨。本研究发现,冬虫夏草粗提物可改善高糖对HUVECs增殖活性的抑制作用。业已证实,细胞能否顺利通过G1-S限制点和G2-M限制点是细胞能否进入增殖状态的关键,其中前者作为细胞内、外信号传递并整合汇入细胞核对细胞增殖进行调控的关键点更为重要。若G1-S限制点被抑制,进入细胞周期的细胞数减少,细胞更多地停滞于G0/G1期,S期和G2/M期细胞比例降低,抑制细胞增殖,诱导细胞凋亡。本研究发现高糖诱导后HUVECs阻滞于G0/G1期的百分比明显增高,S期和G2/M期细胞百分比下降,而冬虫夏草干预后逆转了高糖诱导的细胞周期分布情况,提示冬虫夏草通过促进更多细胞进入细胞周期,从而改善高糖损伤后内皮细胞活力。推测此现象可能与冬虫夏草富含氮、磷等元素有关,这为DNA合成分裂提供大量的可利用性营养;亦可能通过影响细胞周期相关调控蛋白如P53、P21等的表达而影响细胞周期,促进内皮细胞的增殖活性。正常血管内皮细胞凋亡率和增殖率都很低,且两者平衡以保持血管内皮稳态,而高糖损伤的内皮细胞在凋亡加速的同时,伴随增殖活力下降,无法对损伤的内皮细胞进行及时修复,内皮微环境的平衡被打破[15]。而冬虫夏草可能通过增加内皮细胞增殖活力,减少细胞凋亡,重建内皮稳态。本研究中,发现低、中剂量的冬虫夏草粗提物(12.5~50 mg/L)可拮抗高糖对HUVECs增殖的抑制作用,减少细胞凋亡的发生,且具有量效依赖性。而高剂量(100 mg/L)冬虫夏草粗提物对细胞的保护作用反而下降,可推测在更高剂量下,其可能具有细胞毒作用,故此现象也客观地反映了药物的“双刃剑”作用。
高血糖使机体系统和局部血管内皮细胞内ROS生成增多,包括超氧阴离子、羟自由基和H2O2等,同时抗氧化蛋白(如Cu/Zn-SOD)因糖基化作用而失活导致抗氧化防御屏障减弱,机体氧化-抗氧化失衡,ROS蓄积形成氧化应激状态[16-17],并与糖代谢紊乱形成恶性循环,贯穿糖尿病的始终。ROS可通过脂质过氧化、激活转录因子(如NF-κB)、干扰NO的生物利用度等直接损伤内皮;也可通过氧化LDL,形成AGEs、激活血小板和单核细胞等间接损伤内皮细胞[8]。目前,已有大量药理学研究以内皮细胞氧化应激水平为靶点,抑制血管内皮损伤进而干扰糖尿病血管并发症的发生发展。因此抗氧化治疗将打破氧化应激与糖代谢紊乱的恶性循环,成为糖尿病治疗的新策略。本研究尚显示,冬虫夏草不同程度地降低了内皮细胞内的ROS水平,故认为冬虫夏草卓越的抗氧化作用可能是其发挥内皮保护作用的重要机制之一,推测可能与直接清除自由及增强细胞内抗氧化系统的抗氧化能力两种途径有关。
总之,本研究经过MTT法筛选发现,冬虫夏草可以通过促进细胞增殖活性、改变细胞周期分布及细胞内氧化应激水平来改善HUVECs损伤,从而可能发挥保护血管内皮细胞效应。而花脸香菇、巴西革耳、古尼虫草对高糖损伤的人脐内皮细胞增殖活性并无改善作用。
[1] Gao L, Mann GE. Vascular NAD(P)H oxidase activation in diabetes: a double-edged sword in redox signalling[J]. Cardiovasc Res,2009,82(1):9-20.
[2] Han J, Mandal AK, Hiebert LM. Endothelial cell injury by high glucose and heparanase is prevented by insulin, heparin and basic fibroblast growth factor[J]. Cardiovasc Diabetol,2005,4(1):12.
[3] Moon EY, Oh JM, Kim YH, et al. Clitocybins, novel isoindolinone free radical scavengers, from mushroom Clitocybe aurantiaca inhibit apoptotic cell death and cellular senescence[J]. Biol Pharm Bull,2009,32(10):1689-1694.
[4] 范 黎. 食药用真菌:天然抗氧化剂的重要来源[J]. 微生物学通报,2011,38(6):957.
[5] Koyama T, Taka A, Togashi H. Cardiovascular effects produced by a traditional fungal medicine,Fuscoporiaobliquaextract, and microvessels in the left ventricular wall of stroke-prone spontaneously hypertensive rat (SHRSP)[J]. Clin Hemorheol Microcirc,2006,35(4):491-498.
[6] Mori K, Kobayashi C, Tomita T, et al. Antiatherosclerotic effect of the edible mushroomsPleurotuseryngii(Eringi),Grifolafrondosa(Maitake), andHypsizygusmarmoreus(Bunashimeji) in apolipoprotein E-deficient mice[J]. Nutr Res,2008,28(5):335-342.
[7] 陶美华,章卫民,潘清灵,等. 几种药用真菌粗多糖降血糖作用研究[J]. 食用菌学报,2009, 16(1):59-62.
[8] Stehouwer CD, Lambert J, Donker AJ, et al. Endothelial dysfunction and pathogenesis of diabetic angiopathy[J]. Cardiovasc Res,1997,34(1):55-68.
[9] 金惠铭,胡仁明. 糖尿病性微血管病的临床病理生理[J]. 中国病理生理杂志,2007,23(2):399-402.
[10]薛 莉,单 江,徐 耕,等. 高糖诱导内皮细胞氧化型低密度脂蛋白受体表达[J]. 中国病理生理杂志,2004, 20(6): 1092-1096.
[11]李国平. 虫草制剂治疗心血管病的临床及实验研究进展[J]. 中国中医药科技,2007,14(6):472-473.
[12]吴秀香,王国秋,马克玲,等. 冬虫夏草对肾性高血压大鼠心血管功能的影响[J]. 中西医结合心脑血管病杂志,2005, 3(2):137-138.
[13]Chang W, Lim S, Song H, et al. Cordycepin inhibits vascular smooth muscle cell proliferation[J]. Eur J Pharmacol,2008,597(1-3):64-69.
[14]Lo HC, Hsu TH, Tu ST, et al. Anti-hyperglycemic activity of natural and fermented Cordyceps sinensis in rats with diabetes induced by nicotinamide and streptozotocin[J]. Am J Chin Med,2006,34(5):819-832.
[15]庞 燕,羊惠君,韦纯义,等. 高糖条件下血管内皮细胞增殖与凋亡的研究[J]. 中华眼底病杂志,2000, 16(3): 177-180.
[16]Piconi L, Quagliaro L, Assaloni R, et al. Constant and intermittent high glucose enhances endothelial cell apoptosis through mitochondrial superoxide overproduction[J]. Diabetes Metab Res Rev,2006,22(3):198-203.
[17]Quagliaro L, Piconi L, Assaloni R, et al. Intermittent high glucose enhances apoptosis related to oxidative stress in human umbilical vein endothelial cells: the role of protein kinase C and NAD(P)H-oxidase activation[J]. Diabetes,2003,52(11):2795-2804.
Effectsofedible-medicinalfunguscrudeextractsonvascularendothelialcellswithhighglucose-inducedinjury
HUANG Hua-wei, YU Hui-zhen, ZHU Peng-li, YE Zhang-zheng, RUAN Jing-ming, LIN Fan
(ProvincialClinicalCollegeofFujianMedicalUniversity,FujianProvincialHospital,Fuzhou350001,China.E-mail:vivian198543@163.com)
AIM: To investigate the effects of crude extracts ofCordycepsgunnii(CGE),Lepistalentinus(LLE),Cordycepssinensis(CSE) andLentinusstriguellus(LSE) on the proliferation of high glucose-treated human umbilical vein endothelial cells (HUVECs).METHODSThe cultured HUVECs were divided into normal control group (treated with M199 culture medium alone), high glucose group (treated with M199 culture medium containing 33 mmol/L glucose) and 4 crude extracts of edible-medicinal fungi (CGE, LLE, CSE and LSE) intervention groups (treated with the crude extract of edible-medicinal fungus at concentrations of 12.5, 25, 50, 100 mg/L in high glucose M199 culture medium). The cell proliferation was evaluated by MTT assay. The cell cycle and ROS level were measured by flow cytometry.RESULTSCompared with normal control group, the MTT absorbance value and the percentage of G0/G1stage of the HUVECs in high glucose group were significantly decreased (P<0.05), while the percentage of S+G2/M and ROS level were significantly increased (P<0.05). Compared with high glucose group, treatment with the crude extracts ofLepistalentinusandLentinusstriguellusdecreased the cell absorbance value (P<0.05), and the inhibitory effect was enhanced in a dose-dependent manner. However,Cordycepsgunniihad no effect (P>0.05). The crude extracts ofCordycepssinensis(12.5~50 mg/L) significantly enhanced the proliferative activity of HUVECs, decreased the percentage of G0/G1stage of HUVECs, increased the percentage of S+G2/M of HUVECs, and reduced the intercellular ROS level (P<0.05).CONCLUSIONOnlyCordycepssinensiscrude extract effectively protects the HUVECs in high glucose-induced injury, which might be due to promoting more cells to enter to the cell cycle and down-regulating oxidative stress.
Edible-medicinal fungi; High glucose; Human umbilical vein endothelial cells;Cordycepssinensis; Cell cycle; Reactive oxygen species
R363
A
10.3969/j.issn.1000-4718.2012.03.020
