脂联素对大鼠缺血再灌注心肌缝隙连接蛋白43表达的影响
2012-11-06乔英艳王晋青
乔英艳, 王晋青, 张 玖
(1山西医科大学第二医院超声科,山西 太原 030001;2太原市第二人民医院麻醉科,山西 太原 030002)
1000-4718(2012)03-0464-06
2011-08-11
2011-12-02
△通讯作者 Tel:0351-3365624;E-mail:qiaoyingyan@163.com
脂联素对大鼠缺血再灌注心肌缝隙连接蛋白43表达的影响
乔英艳1△, 王晋青2, 张 玖1
(1山西医科大学第二医院超声科,山西 太原 030001;2太原市第二人民医院麻醉科,山西 太原 030002)
目的观察脂联素(APN)对大鼠缺血再灌注心肌缝隙连接蛋白43(Cx43)表达的影响,进一步探讨其抗心律失常的可能机制。方法将48只雄性Wistar大鼠随机分成:(1)假手术 (SM)组;(2)缺血再灌注(I/R)组:结扎冠状动脉左前降支,30 min后松开结扎线,再灌注120 min;(3)脂联素+缺血再灌注组1(I/R+APN1):先阻断血流30 min,于再灌注120 min开始时给予3.5 μg/kg APN;(4)脂联素+缺血再灌注组2(I/R+APN2):缺血前10 min给予3.5 μg/kg APN,余同I/R组。观察各组心律失常的发生情况;应用RT-PCR观察各组心室肌细胞Cx43基因表达;用免疫组织化学方法观察Cx43分布的变化;应用硫代巴比妥酸(TBA)法和黄嘌呤氧化酶法测各组动物血清中丙二醛(MDA)的含量和超氧化物歧化酶(SOD)的活性;用RT-PCR及Western blotting法分析内皮型一氧化氮合酶(eNOS)mRNA及蛋白的表达,用电镜观察各组心室肌超微结构的改变。结果(1)I/R组与SM组比较,心律失常评分和血清MDA含量显著增高(P<0.01),SOD活性降低(P<0.01);心室肌Cx43表达明显减少,差异有统计学意义(P<0.01),Cx43分布紊乱,失去正常的规律性;心肌细胞超微结构有明显损伤;心室肌eNOS mRNA及蛋白的表达明显降低,差异有统计学意义(P<0.01)。(2)无论缺血前还是缺血后使用脂联素处理,与I/R组相比,心律失常评分显著降低(P<0.01);Cx43及eNOS表达增高(P<0.01),Cx43分布紊乱的程度减轻;心肌细胞超微结构损伤明显改善。结论APN可能通过氧化应激调节Cx43的功能,从而发挥抗缺血/再灌注心律失常的作用。
脂联素; 连接蛋白43; 再灌注; 心律失常; 一氧化氮合酶
心肌缺血再灌注(ischemia-reperfusion,I/R)损伤是指当缺血心肌恢复血液灌注后,出现超微结构、功能、代谢及电生理方面的进一步损伤,其主要表现为再灌注后心律失常、微血管功能障碍、心肌顿抑及心肌细胞的损伤和凋亡或死亡[1],是临床上加重心肌损害、导致心律失常发生的重要原因,严重影响心脏病患者的生活质量和预后。缝隙连接(gap junction,GJ)结构和功能变化所引起的电脱耦联是引起缺血性心律失常的重要因素。GJ主要成分为连接蛋白(connexin,Cx),其中Cx43是哺乳动物心肌细胞间最主要的连接蛋白,Cx43的结构和功能发生改变可直接引起心肌组织的阻抗增加、电导性下降,出现GJ的电脱偶联现象,导致折返性电活动的发生, 研究表明,Cx43表达含量和分布与室性心律失常关系密切,对维持心脏传导具有重大意义[2-4]。
脂联素(adiponectin,APN)是脂肪组织分泌的血浆蛋白,具有促进葡萄糖的利用和脂肪酸的氧化、降低血糖以及改善胰岛素抵抗的功能[5-6]。近年研究表明,脂联素在心肌缺血再灌注损伤以及病理性的心室重构等心脏病理过程中发挥保护作用[7],研究表明,脂联素能减少心肌缺血再灌注性心律失常,部分机制可能通过保护缺血心肌血管内皮功能的完整性,稳定心电活动,减少心律失常的发生[8]。但是否与改善Cx43的重塑过程,从而抑制缺血引起的缝隙连接脱偶联现象,最终抑制因缺血导致的心律失常,尚未见报道。本实验在制作大鼠心脏缺血/再灌注损伤模型的同时,观察脂联素对缺血/再灌注性心律失常以及Cx43基因和蛋白表达的影响,并在此基础上探讨脂联素抗缺血/再灌注性心律失常的机制。
材 料 和 方 法
1材料
清洁级SD大鼠,体重(250±20)g,由山西医科大学实验动物中心提供。脂联素购自Sigma。Total RNA Kit购自Omega, PrimeScriptTMRT Reagent Kit和Premix Taq购自TaKaRa。Cx43抗体购自Cell Signaling。SP免疫组化试剂盒和DAB试剂盒购自北京中杉生物技术有限公司。
2方法
2.1大鼠心脏缺血/再灌注损伤模型的建立及实验分组 用30 g/L戊巴比妥钠麻醉大鼠(1.5 mL/kg,ip),气管插管,接微型动物呼吸机。而后于大鼠胸骨左缘第4~5肋间开胸,暴露心脏,剪开心包膜,在冠状动脉左前降支(left anterior descending,LAD)距左心耳下缘约2 mm处穿线(6/0丝线),再用直径约0.2 cm乳胶管穿过结扎线。心肌缺血时用止血钳夹紧结扎线,再灌注时将结扎线松开。以心电图ST段明显抬高、结扎线以下心肌颜色变暗、出现紫绀作为心肌缺血标志,再灌注时心肌缺血区颜色逐渐转为红色、紫绀消失。实验结束后取心肌缺血区置于4%多聚甲醛固定液中固定。
将48只大鼠编号,按随机原则分为4组,每组12只:(1)假手术 (sham operation,SM)组:不结扎LAD;(2)I/R组:结扎LAD, 30 min后松开结扎线,再灌注120 min;(3)I/R+APN1组:先阻断血流30 min,于再灌注120 min开始时给予3.5 μg/kg APN;(47)I/R+APN2组:缺血前10 min给予3.5μg/kg APN,余同I/R组。
2.2各组心律失常发生情况 心律失常的分析判断按照Lambeth会议标准,分别全程记录模型制备成功后1 h内心电图,观察室性心律失常[包括室性期前收缩(ventricular extrasystole,VE)、室性心动过速(ventricular tachycardia,VT)和室颤]的发生情况。室性心律失常评分(ventricular arrhythmia scores,VAS)参考文献[13]的评分规则,具体如下:各组VE数<5计为0分;≥5计为1分;只有1次<60 s的VT计为2分;有多次VT,总持续时间<60 s,或只有1次≥60 s VT均计为3分;有多次VT,总持续时间≥60 s计为4分;出现可恢复室颤计为5分;出现于观察期间不可恢复的室颤计为6分。
2.3逆转录-聚合酶链式反应(RT-PCR) 将组织充分研磨后,使用Total RNA Kit提取组织总RNA,用PrimeScriptTMRT Reagent Kit对提取的RNA进行逆转录。Cx43上游引物5’-GCGGCTTGCT GAGAACC-3’,下游引物 5’-TTGCGGCACGAGGAATT-3’,扩增片段长度为454 bp。GAPDH为内参照,上游引物5’-TCCCTCAAGATTGTCAGCAA-3’,下游引物5’-AGATCCACAACGGATACATT-3’,产物长度318 bp。内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)上游引物5’-GAGTCCTCACCGCCTTCTC-3’,下游引物5’-AGGAAGCGGGTGGCAGTA-3’,产物长度198 bp。取扩增产物各6 μL,在1.5%琼脂糖凝胶电泳,溴化乙啶染色,电压80 V,时间60 min。Kadak生物凝胶图像分析系统进行扫描,分别测Cx43、eNOS和GAPDH条带的吸光度值(absorbance,A),计算Cx43或eNOS与GAPDH的A值比。
2.4免疫组织化学染色 切片常规脱蜡至水化,按SP免疫组化试剂盒说明书进行Cx43免疫组化染色,经DAB显色,苏木精复染,脱水干燥、透明、中性树胶封片,在Olympus 40倍物镜下每张切片选取不重叠、不断裂的5个清晰视野,共选15个视野,在切片空白处测量背底,取其平均值作为校正的基础值。测定每个视野下阳性物质的平均吸光度。各测量数据由计算机自动统计得出。
2.5Western blotting检测eNOS蛋白表达 提取组织蛋白,用Bradford方法测定蛋白浓度。制作12%的分离胶和5%的积层胶,每泳道上样量60 μg,电泳结束后,将蛋白转移至PVDF膜, 5%脱脂奶粉溶液(溶于TBS-T缓冲液中)室温封闭3 h,分别加入小鼠抗eNOS蛋白单克隆Ⅰ抗(1∶1 000)和小鼠抗GAPDH单克隆Ⅱ抗(1∶2 000),4 ℃孵育过夜,TBS-T溶液洗膜4次,每次15 min。室温下加相应Ⅱ抗(1∶6 000)孵育2 h,同前法洗膜4次,用增强化学发光法显色,X光片曝光显影,凝胶成像分析系统摄像分析。
2.6血清超氧化物歧化酶(superoxide dismutase,SOD)活性及丙二醛(malondialdehyde,MDA)含量的测定 再灌结束时,分离颈动脉取血5~6 mL,静置30 min,2 000×g离心15 min,取上清,利用722光栅分光光度计进行SOD活性及MDA含量的测定,分别采用采用黄嘌呤氧化酶法及硫代巴比妥酸法测定,具体按照试剂盒操作进行。
2.7超微结构观察 实验结束,于左室前壁缺血区快速剪下1 mm3大小的心肌组织数块,迅速置于4 ℃预冷的2%戊二醛溶液中,用利刀切成0.5 mm3大小的组织块,选取切割规整的组织块于4%戊二醛溶液中4 ℃固定2 h,PBS缓冲液漂洗3次,每次10 min,1%饿酸4℃后固定2 h,PBS缓冲液充分清洗3次,每次15 min,梯度乙醇(50%-70%-80%-90%-95%)脱水各1次,每次10 min,100%乙醇3次,每次15 min,包埋剂浸透37 ℃过夜,包埋,60 ℃下聚合36 h,修块,超薄切片,醋酸铀闭光染色30 min,蒸馏水漂洗,滤纸吸干,柠檬酸铅染色15 min。JEOL-100CX高分辨透射电镜观察拍照。
3统计学处理
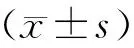
结 果
1各组室性心律失常的发生情况
结果显示,假手术组极少有室性心律失常发生,既有个别VE出现,未发生VT;缺血再灌注组心电图ST段明显抬高,大多出现VT,其中一只发生室颤经心脏按压后无效死亡,与假手术组比较,VAS评分显著增高,VT总持续时间显著延长,差异有统计学意义(P<0.01);与缺血再灌注组相比,无论缺血前还是缺血后给予脂联素处理,在再灌注期间也可出现VE和VT,但无室颤发生,VAS评分明显降低,VT总持续时间明显缩短,差异有统计学意义(P<0.01);脂联素组间比较,差异无统计学意义(P>0.05),见表1。
表1各组室性心律失常的发生情况

GroupVT(s)VF(s)VASSM2.30±6.19 00.53±0.79I/R67.05±25.51** 10.10±26.32**3.65±1.28**I/R+APN126.23±29.43**▲▲ 0▲▲2.20±1.19**▲▲I/R+APN227.13±28.05**▲▲ 0▲▲2.25±1.04**▲▲
**P<0.01vsSM group;▲▲P<0.01vsI/R group.
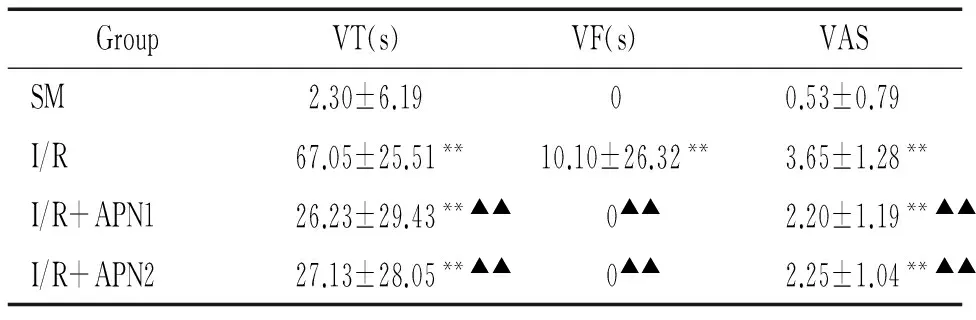
2RT-PCR半定量分析Cx43的表达
在缺血再灌注组的心肌组织内Cx43 mRNA的表达水平与假手术组相比降低,差异显著(P<0.01);脂联素处理组的心肌组织内Cx43 mRNA表达水平与缺血再灌注组相比明显增加,差异显著(P<0.01);而脂联素两组之间心肌组织内Cx43 mRNA表达水平的差异无统计学意义(P>0.05),见图1。
3免疫组化染色观察心室肌Cx43的表达
光镜下见在SM组Cx43棕黄色颗粒强表达,呈规律条带状分布,大多分布在心肌纤维长轴垂直的细胞端-端相接即闰盘处,少数位于与心肌纤维长轴平行的细胞侧-侧相接的部位,见图2A;在I/R组,Cx43表达明显减弱,着色斑点大小不一、深浅不等,分布不均,大多分布在心肌细胞侧-侧连接处或细胞质中,而闰盘处仅有少数,呈弥散点或条状,无规则,见图2B;I/R+APN1组和I/R+APN2组与I/R组相比,Cx43表达明显改善,大小较一致,分布较均一,且I/R+APN1组比I/R+APN2组Cx43表达及分布更接近于SM组,但是无显著差异,见图2C、D。图像半定量结果分析可知,后3组与SM组相比,Cx43表达降低,差异显著(P<0.01);I/R+APN组Cx43表达较I/R组明显增高(P<0.01);I/R+APN两组间无显著差异 (P>0.01),见图2、表2。
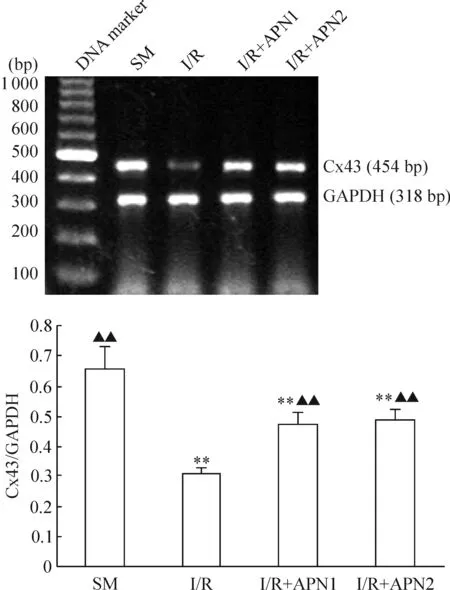

图1不同组别Cx43mRNA水平的变化
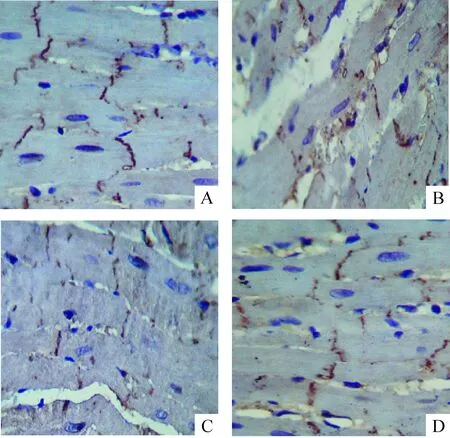
Figure 2. Comparison of connexin 43 expression in the myocardium of rats in different groups (immunohistochemistry,×400).A: SM group; B: I/R group; C: I/R+APN1 group; D: I/R+APN2 group.
图2免疫组化观察各组Cx43的表达
表2免疫组化观察各组Cx43的表达


GroupAvalueSM0.448±0.033I/R0.289±0.035I/R+APN10.342±0.021**▲▲I/R+APN20.406±0.035**▲▲
**P<0.01vsSM group;▲▲P<0.01vsI/R group.
4血清MDA和SOD的变化
与假手术组相比,缺血再灌注组血清MDA含量增高,血清SOD活性降低,与缺血再灌注组相比,I/R+APN1组及I/R+APN2组的血清MDA含量明显降低,血清SOD活性显著增高,两组间血清SOD活性及MDA含量差异无统计学意义(P>0.05),见表3。
表3各组血清SOD活性和MDA含量的变化

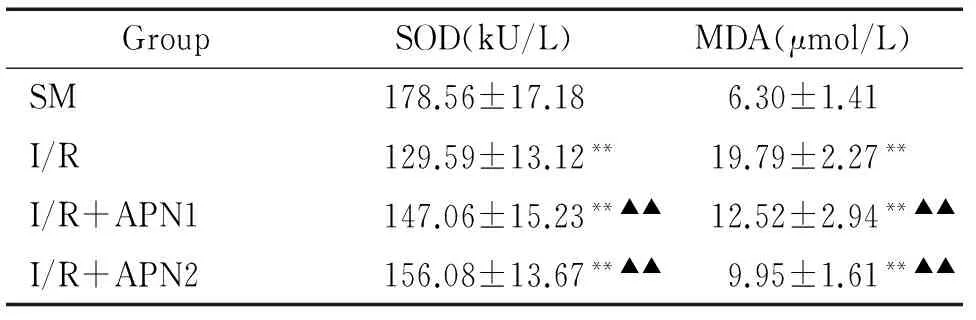
GroupSOD(kU/L)MDA(μmol/L)SM178.56±17.186.30±1.41I/R129.59±13.12**19.79±2.27**I/R+APN1147.06±15.23**▲▲12.52±2.94**▲▲I/R+APN2156.08±13.67**▲▲9.95±1.61**▲▲
**P<0.01vsSM group;▲▲P<0.01vsI/R group.
5RT-PCR及Westernblotting法分析eNOSmRNA及蛋白的表达
在缺血再灌注组的心肌组织内eNOS mRNA的表达水平与假手术组相比降低,差异显著(P<0.01);在脂联素处理组,心肌组织内eNOS mRNA表达水平与缺血再灌注组相比明显增加,差异显著(P<0.01);而在脂联素组间心肌组织内eNOS mRNA表达水平差异无统计学意义(P>0.05),蛋白表达同基因表达趋势相一致,见图3、4。
6透射电镜下观察心肌纤维形态学变化
(1)在SM组:心肌纤维排列连续规则,闰盘结构完整、清晰,可见桥粒、黏着膜和间隙连接;线粒体呈匀质样改变,峭排列整齐,见图5A。(2)I/R组:心肌损伤严重,肌丝结构排列紊乱,溶解,断裂。闰盘断裂、移位,间隙连接增宽;线粒体明显肿胀,空泡样变性,嵴排列紊乱,嵴突断裂、消失,见图5B。(3)I/R+APN组:无论缺血前还是缺血后给予APN,心肌超微结构损伤均较轻,肌丝排列整齐,肌节清晰。闰盘结构部分模糊,间隙连接略增宽,线粒体轻度水肿,空泡样变性减轻,图5C、D。
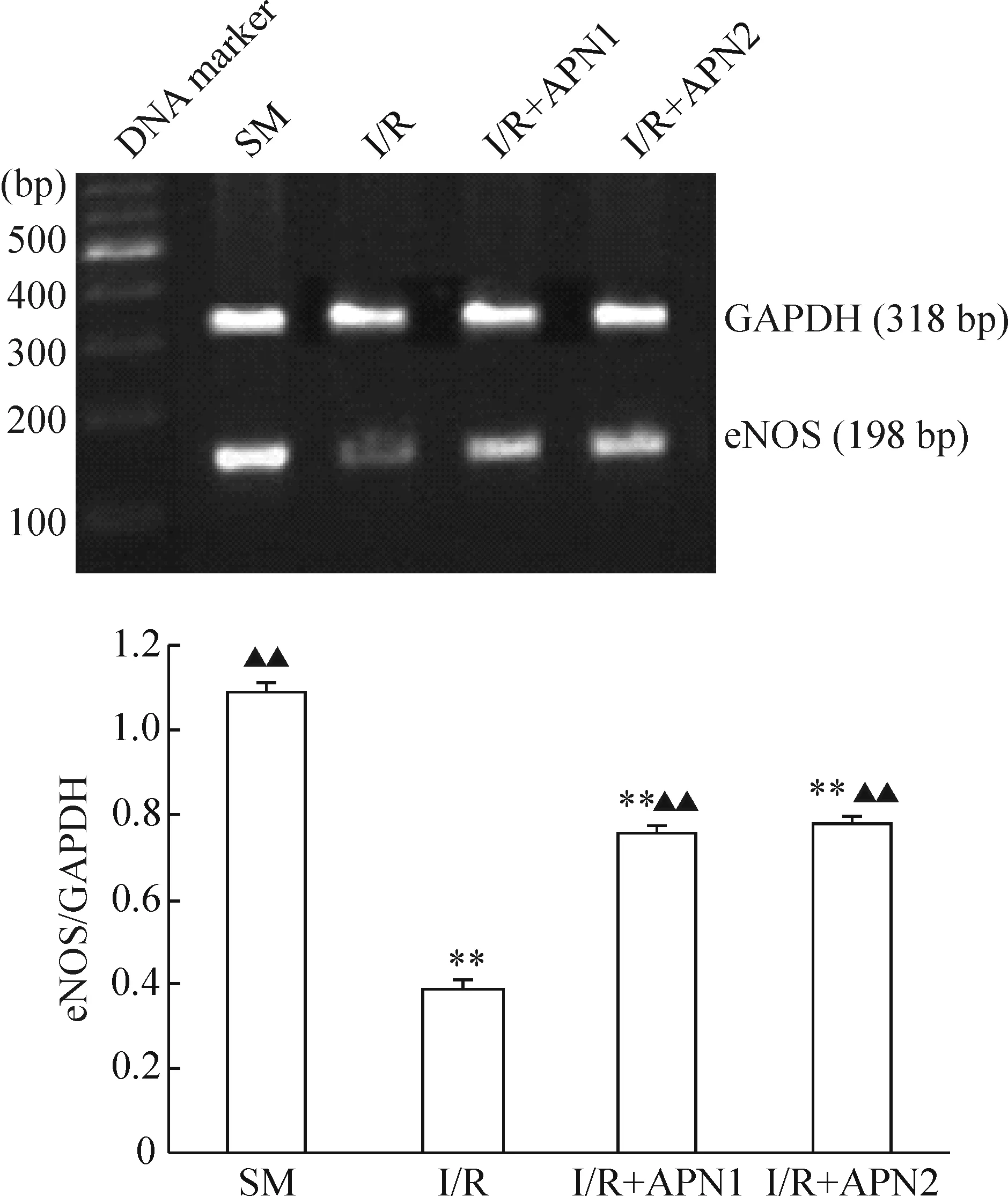

图3不同组别eNOSmRNA水平的变化
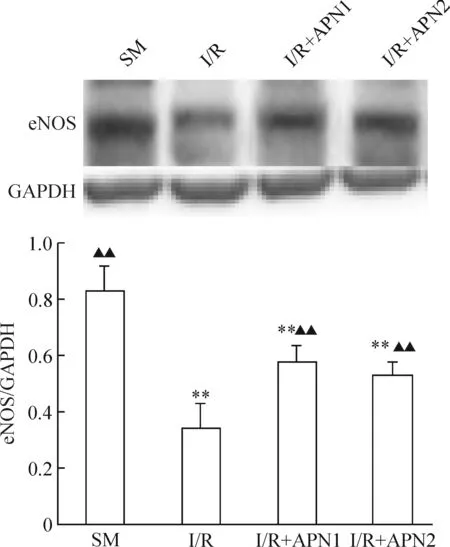

图4不同组别eNOS蛋白水平的变化
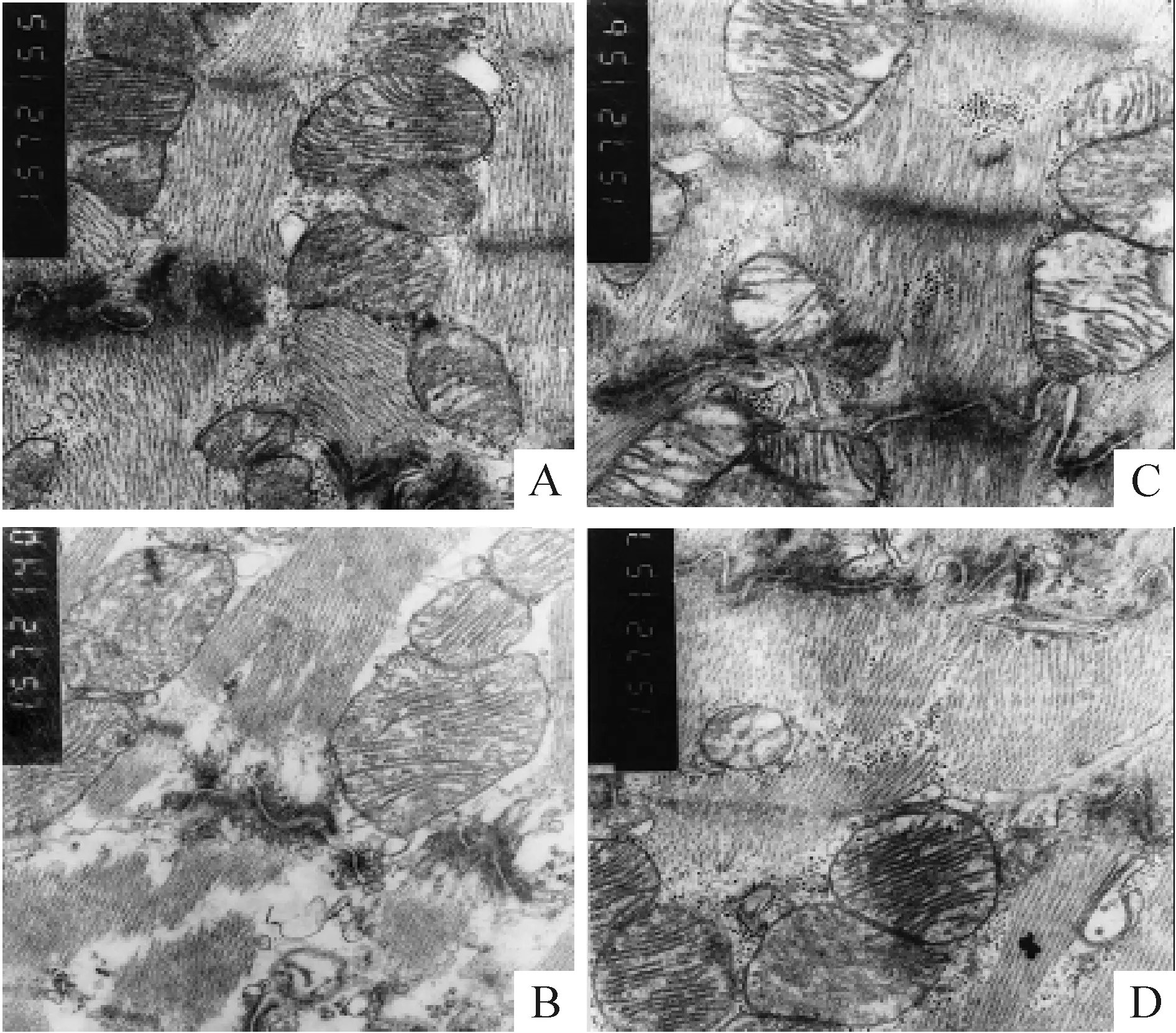
Figure 5. The morphological changes of the myocardial tissue in different groups examined by electron microscopy(×1 500). A: SM group; B: I/R group; C: I/R+APN1 group; D:I/R+APN2 group.
图5透射电镜下观察心肌纤维形态学变化
讨 论
心肌细胞GJ由相邻心肌细胞膜通过相互紧密作用形成,主要分布在闰盘。GJ的主要功能是介导相邻细胞间电和化学信号的传递,确保细胞间电偶联与机械偶联得以正常进行[9-10]。既往研究表明在心肌缺血/再灌注时,由于氧自由基生成增加、酸中毒及钙超载等因素导致心肌细胞超微结构明显破坏、心功能受损,可以发生心律失常。本实验的结果显示,正常情况下Cx43主要位于闰盘内,纵切面上呈线状、条带状排列,与细胞长轴方向垂直,少数位于细胞的侧侧连接处,与细胞长轴平行,着色斑点清晰,大小一致、分布均一,与以往的研究相同[11]。心室肌经缺血再灌注后,Cx43的表达显著减少,分布弥散至心肌细胞长轴的侧面及细胞内,且着色斑点大小不一、分布不均、深浅不等,RT-PCR 结果显示Cx43 mRNA转录水平下降,提示缺血再灌注Cx43的含量下降、分布紊乱可导致GJ脱偶联,通道电阻增加,使得局部发生传导缓慢和传导阻滞,心肌兴奋性不一致,从而诱发折返性心律失常的发生[12-13]。
APN是由脂肪细胞分泌的胶原样蛋白质,在体内通过结合其受体AdipoR1与AdipoR2,激活下游的AMPK,使之磷酸化,引发脂肪酸氧化、糖摄入和乳酸生成等反应,在外周组织发挥降低血糖、改善胰岛素抵抗等生理功能。近年研究表明,APN还参与了I/R损伤的心肌保护[14]。本实验结果表明,APN使缺血再灌注所致的心室肌Cx43的降解程度较单纯缺血再灌注组减轻,分布紊乱的状况得以改善;使缺血再灌注心室肌Cx43 mRNA转录水平明显升高,其变化趋势与免疫组化结果的Cx43含量变化一致。同时也观察到给予APN后,再灌注心律失常发生减少,室性心律失常评分降低。这提示APN有明显改善I/R造成的损伤型ST段改变的作用,同时显著减少了再灌注心律失常的发生,可能是由于APN具有改善心肌Cx43重塑的作用。
eNOS是内皮细胞中重要的功能蛋白,活化的eNOS催化L-精氨酸产生NO,后者作为重要的第二信使激活复杂的信号转导通路,进而发挥其心血管保护作用,包括舒张血管、抗细胞增殖及抗动脉粥样硬化等[15]。缺血再灌注时产生大量的氧自由基,细胞内ROS增加,氧化应激使eNOS活性降低,NO合成减少。Bopassa等[16]的研究则发现用人的eNOS基因转染大鼠后显著减少心肌胶原聚集和TUNEL染色阳性细胞,并且发现NO的保护作用伴随着NADH、NADPH氧化酶活性降低及超氧化物生成减少。本实验的结果显示,与单纯缺血再灌注组相比,APN组SOD和eNOS活性显著升高,MDA含量显著降低。研究表明,氧化应激可能参与了心肌Cx43的脱磷酸化[17]。APN可能通过保护细胞线粒体结构完整性和强大的抗氧化作用对Cx43的结构和功能产生有利作用,降低缺血再灌注引起的室性心律失常的发生率,并对缺血再灌注后心功能的稳定与恢复发挥积极作用。
总之,本研究表明APN可以通过氧化应激调节缝隙连接蛋白Cx43的功能,从而发挥抗缺血/再灌注心律失常的作用,其具体机制仍待于进一步探讨。
[1] Buja LM.Myocardial ischemia and reperfusion injury [J].Cardiovasc Pathol, 2005,14(4):170-175.
[2] Figueroa XF, Duling BR.Gap junctions in the control of vascular function [J]. Antioxid Redox Signal, 2009, 11(2):251-256.
[3] Matsushita S, Kurihara H,Watanabe M,et al.Alterations of phosphorylation state of connexin 43 during hypoxia and reoxygenation are associated with cardiac function [J].J Histochem Cytochem,2006,54(3):343-353.
[4] Lerner DL, Yamada KA, Schuessler RB, et al. Accelerated onset and increased incidence of ventricular arrhythmias induced by ischemia in Cx43-deficient mice[J]. Circulation, 2000, 101(5):547-552.
[5] Hopkins TA, Ouchi N, Shibata R, et al. Adiponectin actions in the cardiovascular system[J]. Cardiovasc Res,2007,74(1): 11-18.
[6] Shibata R, Sato K, Kumada M,et al. Adiponectin accumulates in myocardial tissue that has been damaged by ischemia-reperfusion injury via leakage from the vascular compartment[J]. Cardiovasc Res,2007,74(3): 471-479.
[7] Tao L,Gao E,Jiao X,et al. Adiponectin cardioprotection after myocardial ischemia/reperfusion involves the reduction of oxidative/nitrative stress[J]. Circulation,2007,115(11):1408-1416.
[8] Zou MH, Wu Y. AMP-activated protein kinase activation as a strategy for protecting vascular endothelial function [J]. Clin Exp Pharmacol Physiol, 2008, 35 (5-6): 535-545.
[9] Sever NJ, Bruce AF, Dupont E, et al. Remodelling of gap junctions and connexin expression in diseased myocardium [J].Cardiovasc Res, 2008,80(1): 9-19.
[10]Cao ZJ,Xu X,Que LL, et al. Dephosphorylation of cardiomyocyte Cx43 is associated with myocardial ischemia and reperfusion injury [J].J Nanjing Med Univ, 2009,23(3): 163-167.
[11]Fishman GI, Hertzberg EL, Spray DC, et al. Expression of connexin43 in the developing rat heart[J]. Circ Res, 1991, 68(3):782-787.
[12]Gao J, Fu W, Jin Z,et al.Acupuncture pretreatment protects heart from injury in rats with myocardial ischemia and reperfusion via inhibition of the β1-adrenoceptor signaling pathway[J].Life Sci, 2007,80(16): 1484-1489.
[13]Bruce AF,Rothery S,Dupont E, et al.Gap junction remodelling in human heart failure is associated with increased interaction of connexin 43 with ZO-1[J].Cardiovasc Res, 2008,77(4):757-765.
[14]Yoon MJ,Lee GY,Chung JJ,et al. Adiponectin increases fatty acid oxidation in skeletal muscle cells by sequential activation of AMP-activated protein kinase,p38 mitogen-activated protein kinase,and peroxisome proliferator-activated receptor alpha[J]. Diabetes,2006,55(9): 2562-2570.
[15]Kuboki K, Jiang ZY, Takahara N, et al. Regulation of endothelial constitutive nitric oxide synthase gene expression in endothelial cells andinvivo:a specific vascular action of insulin[J]. Circulation, 2000, 101(6): 676-681.
[16]Bopassa JC,Ferrera R,Gateau-Roesch O,et al.PI 3-kinase regulates the mitochondrial transition pore in controlled reperfusion and postconditioning [J].Cardiovasc Res,2006,69(1):178-185.
[17]Rakotovao A, Tanguy S. Selenium status as determinant of connexin-43 dephosphorylation inexvivoischemic/reperfused rat myocardium[J].J Trace Elem Med Biol, 2005,19(1):43-47.
Effectsofadiponectinonexpressionofconnexin43inratmyocardiumduringischemia-reperfusion
QIAO Ying-yan1, WANG Jin-qing2, ZHANG Jiu1
(1DepartmentofUltrasound,TheSecondHospitalofShanxiMedicalUniversity,Taiyuan030001,China;2DepartmentofAnesthesiology,TheSecondPeople’sHospitalinTaiyuan,Taiyuan030002,China.E-mail:qiaoyingyan@163.com)
AIM: To observe the effects of adiponectin(APN) on the expression of connexin 43 (Cx43) in rat myocardium during ischemia-induced arrhythmias.METHODSThe SD rats were randomly divided into 4 groups (n=12): sham operation group (SM group), ischemia and reperfusion group (I/R group), I/R+adiponectin(APN1) group: pre-ischemia with 3.5 μg/kg of APN; I/R+APN2 group: post-ischemia with 3.5 μg/kg of APN. The incidence of ventricular arrhythmias and ventricular arrhythmia score (VAS) were determined. The expression of Cx43 in the ischemic myocardium was studied by the techniques of immunohistochemistry and RT-PCR. The levels of malondialdehyde(MDA) and superoxide dismutase(SOD) were measured by the methods of xanthine oxidase and thiobarbituric acid. The expression of endothelial nitric oxide synthase (eNOS) at mRNA and protein levels was determined by RT-PCR and Western blotting,respectively.The morphological changes of the myocardial tissues were observed under electronic microscope.RESULTSThe VAS and concentration of MDA increased obviously and the activity of SOD was decreased in I/R group as compared with SM group (P<0.01). The expression of Cx43 was evidently decreased and the distribution of Cx43 in the myocardium was disturbed. The expression of eNOS at mRNA and protein levels was decreased in I/R group (P<0.05). The ultrastructure of ventricular myocardium was abnormal in I/R group. Compared with I/R group, APN obviously decreased the VAS caused by ischemia and reperfusion (P<0.01) no matter the drug was given before or after ischemia. APN increased the activity of SOD, inhibited the MDA content in serum, and resulted in normal distribution of Cx43 and increased the expression of Cx43 and eNOS. Compared with I/R group, the changes of heart ultrastructure attenuated greatly in APN group, but didn’t recover to normal state.CONCLUSIONAdiponectin antagonizes the arrhythmias during myocardial ischemia and reperfusion via inhibiting oxidative stress and regulating Cx43.
Adiponectin; Connexin 43; Reperfusion; Arrhythmias; Nitric oxide synthase
R363
A
10.3969/j.issn.1000-4718.2012.03.014
