NK细胞对不同人肝癌细胞株的杀伤作用*
2012-11-06黎建军陈诗萍古模发杨炜敏李永强王其京赵靖靖夏建川
黎建军, 陈诗萍, 古模发, 杨炜敏, 李永强, 王其京, 何 佳, 潘 科, 赵靖靖, 夏建川△
(华南肿瘤学国家重点实验室,中山大学肿瘤防治中心 1生物治疗中心,2放疗科,广东 广州 510060;3中山大学附属第一医院黄埔院区妇产科,广东 广州 510700)
1000-4718(2012)04-0638-05
2011-10-29
2012-02-17
广东省自然科学基金资助项目(No.9451008901002011)
△通讯作者 Tel:020-87343383;E-mail:xiajch@mail.sysu.edu.cn
NK细胞对不同人肝癌细胞株的杀伤作用*
黎建军1, 陈诗萍1, 古模发2, 杨炜敏3, 李永强1, 王其京1, 何 佳1, 潘 科1, 赵靖靖1, 夏建川1△
(华南肿瘤学国家重点实验室,中山大学肿瘤防治中心1生物治疗中心,2放疗科,广东 广州 510060;3中山大学附属第一医院黄埔院区妇产科,广东 广州 510700)
目的观察自然杀伤(NK)细胞对不同肝癌细胞株的体内外抑瘤作用,并检测肝癌细胞MHC-I类链相关蛋白(MIC蛋白)的表达。方法抽取志愿者外周血50 mL,分离单个核细胞,置入NK细胞试剂盒行孵化及逐级扩增。计算NK细胞对人白血病细胞株K562及人肝癌细胞株BEL7402、HepG2、SMMC7721的杀伤率。接种建立人肝癌细胞株裸鼠移植瘤,进行NK细胞瘤内及瘤周注射;计算各组裸鼠移植瘤的体积,绘制各组肿瘤生长曲线;处死裸鼠,称瘤重,计算NK细胞对各组肿瘤抑制率。检测人肝癌细胞表面 MIC蛋白表达。结果NK细胞对K562细胞杀伤最强,BEL-7402次之,SMMC-7721细胞株杀伤敏感性最低。裸鼠抑瘤实验结果显示NK细胞对于BEL-7402细胞株的抑瘤效果最好,而对于SMMC-7721细胞株的抑瘤效果较差。BEL-7402及HepG2细胞株表面表达MIC,而SMMC-7721则很少表达。结论NK细胞对于不同人肝癌细胞株体内外抑瘤作用不同,其差异可能和不同肝癌细胞株MIC的表达有关。
自然杀伤细胞; 肝肿瘤; MHC-I类链相关蛋白
原发性肝细胞肝癌(hepatocellular carcinoma, HCC)是世界上常见且难以治疗的肿瘤之一,初诊时只有少数患者能进行外科手术切除[1]。目前原发性肝癌的主要治疗方法为外科手术切除、肝移植、经肝动脉栓塞化疗(transarterial chemobolization, TACE)以及局部消融治疗[2-3]。然而,肝肿瘤行外科和局部治疗后仍然不能解决其易复发、转移的特点,故其生存率较低,预后仍然较差[4]。因此,探索新的替代或辅助治疗方法以减少复发转移率、改善预后是令人感兴趣的工作。
自然杀伤细胞(natural killer cells, NK cells)是先天性免疫系统的重要组成部分,是机体抗御感染和恶性转化细胞的第一道防线。与T、B淋巴细胞不同,NK 细胞不表达T细胞受体(T-cell receptor,TCR),也不表达B细胞受体(B-cell receptor,BCR),其对自身正常细胞无杀伤作用,无需肿瘤特异性抗原识别便可以直接杀伤肿瘤细胞,是肿瘤免疫治疗的重要效应细胞[5]。Wada等[6]通过肝癌术后病理切片检测发现淋巴细胞浸润是预后较好的标志,表明肝癌组织中的免疫细胞可能具有抗肿瘤作用。肝脏NK细胞和肝癌等的发生、发展有明确的关系[7-8]。NK细胞和自然杀伤T细胞(NKT细胞)在肝脏的免疫监控中起着极其重要的作用。有证据显示去除肝脏NK/NKT细胞,可使小鼠肝转移瘤的发生率明显升高,而增加肝脏NK/NKT细胞其转移瘤发生率明显下降[9]。Taketomi等[10]研究显示肝癌患者的NK细胞活性明显下降,而且随访认为术前检测NK细胞活性的高低有助于预测肝癌患者术后复发与否及其判断预后。有研究表明,体外培养激活的NK细胞对肝癌细胞有明显的杀伤作用[11]。Harada等[12]于2002年发现经X线处理后的Wilms瘤细胞株HFWT作为饲养细胞(feeder cells),与提取的人外周血单个核细胞(peripheral blood mononuclear cells,PBMC)或脐血单个核细胞进行培养,可激活及大量扩增NK细胞(58~401倍)。然而,NK细胞对不同肿瘤细胞杀伤效力不同,其机制尚需进一步研究,于是我们研究NK细胞对不同肿瘤细胞的杀伤作用,并观察肿瘤细胞株MT的表达,以进一步了解其相关机制。
材 料 和 方 法
1肿瘤细胞株及动物
人肝癌细胞株HepG2、BEL-7402、SMMC-7721和人白血病细胞株K562由中山大学肿瘤防治中心实验研究部保存并传代。实验用BALB/c-nu/nu裸鼠由广州南方医科大学实验动物中心提供。
2方法
2.1PBMC的提取 抽取志愿者外周静脉血50 mL,收集于肝素瓶中。用50 mL离心管离心全血,2 000 r/min离心8 min,收集自体血浆,56 ℃水浴灭活30 min,4 ℃冷水浴置15 min后,2 500 r/min离心8 min,取上清待用。将离心收集后的志愿者外周血细胞用无血清培养基重悬至60 mL,用玻璃毛细吸管将患者外周血均匀注入于离心管中的淋巴细胞分离液液面上层,每支离心管加30 mL外周血。高速低温离心机离心,800×g离心15 min,20 ℃。使用负压器吸掉离心后分离管中的血浆层大部分血浆,收获分离所得的志愿者淋巴细胞层细胞于另一支50 mL离心管中。用适量含庆大霉素1.6×105U/L的注射用生理盐水(500 mL生理盐水+8×104庆大霉素)加满到50 mL,混匀,1 800~2 000 r/min离心8 min,20 ℃,洗涤1次。弃上清液。
2.2NK细胞的培养和扩增 将分离所得的志愿者淋巴细胞置于NK纯化试剂盒(NK cell kit,Fukushima Life Sciences)中,置于饱和湿度、37 ℃、5% CO2培养。第5 d,用显微镜观察细胞生长状态,用培养液(IL-2 1×106U/L)将NK细胞传代扩瓶到2个75 cm2培养瓶中,50 mL/瓶,置于饱和湿度、37 ℃、 5% CO2培养,平均每3 d扩瓶1次。第14 d观察细胞生长状态,并将细胞抽样送检,送检验科行细菌、真菌检测,流式细胞仪检测细胞表面抗原。收集全部细胞于消毒好的250 mL离心杯中,2 500 r/min离心8 min。弃上清液,用0.9%注射用生理盐水洗涤2次,2 000 r/min离心8 min;弃上清液,将细胞收集到约150 mL 0.9%注射用生理盐水中,5 mL 20%人血白蛋白注入到细胞悬液中。
2.3NK细胞体外杀伤实验 应用乳酸脱氢酶释放实验测定NK细胞的肿瘤细胞杀伤活性,PBMC作为对照。每个实验设8个复孔,重复3板。靶细胞(人白血病细胞株K562,人肝癌细胞株HepG2、BEL7402和SMMC7721)用10%牛血清RPMI-1640稀释为1×108/L,加至96孔圆底培养板中,每孔100 μL,再按所定的效靶比例(分别设为30∶1、10∶1及3∶1)加入100 μL NK细胞。靶细胞最大释放孔每孔加100 μL 2% NP40和100 μL靶细胞。每个效应细胞均设自然释放孔。将细胞培养板移入CO2恒温培养箱,在37 ℃、5%CO2浓度和饱和湿度的条件下培养。4 h后,500 r/min离心4 min,取上清50 μL,用多孔加样枪转移至96孔培养板中。在每个孔中加入50 μL substrate buffer,室温避光作用30 min。每孔加入5 μL 终止液,在酶联免疫检测仪上,选择492 nm为检测波长,645 nm为参考波长,以培养液对照孔调零,测定各孔吸光度(A)。按下式计算CIK细胞杀伤活性。计算NK细胞对不同肿瘤细胞的杀伤率。NK细胞杀伤率(%)=(实验孔A-靶细胞自发释放孔A-效应细胞自发释放孔A)/(最大释放孔A-靶细胞自发释放孔A)×100%。
2.4NK细胞体内杀伤人肝癌细胞的动物实验
2.4.1人肝癌异位移植瘤动物模型的建立 BALB/c-nu/nu裸鼠36只,鼠龄4~5周,体重18~23 g,雌雄各半。人肝癌细胞株Bel-7402、HepG2和SMMC-7721经传代培养后,以0.2 g/L EDTA和1.25 g/L胰蛋白酶联合消化,收集细胞于无血清RPMI-1640液中;培养至对数生长期时,制成1×106/0.2 mL;接种至裸鼠右上肢背部皮下,约1~2周可见肿瘤形成。
2.4.2NK细胞抑瘤动物实验 人肝癌细胞株BALB/c-nu/nu异位移植瘤裸鼠36只,鼠龄4~5周,分为3组,每组12只。每组再分为实验组(NK细胞注射组)和对照组(PBS空白对照组),各6只裸鼠,亦为雌雄各半;实验组行NK细胞瘤内注射[参考文献及预实验,NK细胞数量约6×107/0.6 mL,肿瘤中央(2×107/0.2 mL)和肿瘤周围(4×107/0.4 mL)同时注射],5 d 1次,共3次;对照组裸鼠以PBS注射。NK细胞及PBS注射后,每隔3 d测量肿瘤长径(a)及短径(b),依据公式V=π/6×[(a+b)/2]3计算瘤体积,绘制肿瘤生长曲线;同时测各裸鼠的体重,观察其体重变化;3周后处死裸鼠,摘瘤并称瘤重,计算NK细胞对各组肿瘤的抑制率[抑瘤率(%)=(对照组瘤重均值-实验组瘤重均值)/对照组瘤重均值×100%]。
2.5流式细胞术检测不同肝癌细胞株MIC-1类链相关蛋白(MHC class I chain-related protein,MIC蛋白)的表达 胰酶消化肝癌细胞,形成单细胞悬液,浓度为1×109/L。取100 μL细胞悬液,加入FITC-Anti-MICA/B流式抗体10 μL,同时做一管同型对照。室温作用30 min。加入适量生理盐水,离心洗涤细胞。采用0.5 mL的生理盐水悬浮细胞后,流式细胞术测定MIC蛋白阳性细胞比例。
3统计学处理

结 果
1NK细胞对K562及不同人肝癌细胞株的杀伤效应
本研究杀伤实验结果显示激活的NK细胞对人白血病细胞株K562及人肝癌细胞株BEL7402、HepG2、SMMC7721等均有明显抑制作用,而且随效靶比的增加,其杀伤率亦增加。同时NK细胞对各肿瘤细胞株作用不同,K562最强,其后依次为BEL7402和HepG2,SMMC7721作用最弱,见图1。
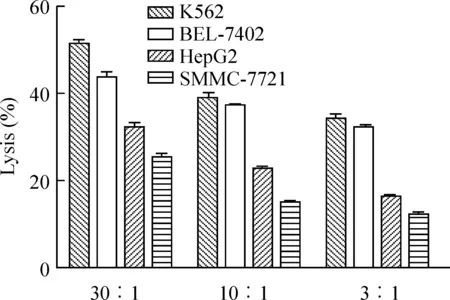
图1NK细胞对不同肿瘤细胞株杀伤作用不同,从强到弱依次为K562、BEL-7402、HepG2和SMMC-7721
2NK细胞对不同肝癌动物移植瘤的抑制作用
本研究对BALB/c-nu/nu裸鼠接种不同人肝癌细胞株后,1~2周可见肿瘤形成,生长速度由快至慢依次为SMMC-7721、BEL-7402和HepG2,其生长曲线特别是注射15 d后,实验组移植瘤较对照组均可见明显抑制,见图2。NK细胞对各肝癌细胞株动物移植瘤抑瘤率分别为46.5%(BEL-7402)、40.7%(HepG2)和36.0%(SMMC-7721),见表1。

图2不同人肝癌细胞株动物移植瘤经NK细胞注射后的生长曲线
表1NK细胞对接种不同肝癌细胞株裸鼠的抑瘤作用

*P<0.05vsNK group.
3不同肝癌细胞株表面MIC蛋白测定
流式细胞仪检测示BEL-7402细胞MIC蛋白表达比例较高,达(46.8±8.6)%,中位数48.7%,n=6;HepG2细胞次之,(29.8±5.7)%,中位数32.8%,n=6;SMMC-7721细胞表达最少,(0.88±0.33)%,中位0.9%,n=6,见图2。
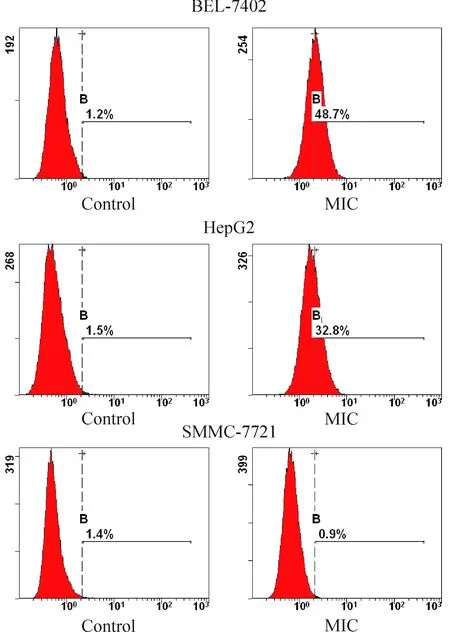
Figure 3. The MIC expression in a variety of HCC cell lines (BEL-7402:48.7%; HepG2:32.8%; SMMC-7721:0.9%).
图3不同肝癌细胞系MIC蛋白的表达
讨 论
肝癌患者肝脏NK细胞数量下降,细胞毒性亦减弱,而且和切除后预后密切相关[5]。NK细胞在体内外可以被IL-2、IL-12 、IL-15 和IFN-α、β激活[3]。龙天柱等[14]采用灌注法和消化法分离肝脏单个核细胞(liver mononuclear cells,LMNC),并应用磁珠二次分选得到全肝NK细胞,发现经IL-2激活的NK细胞其形态、超微结构明显不同并和细胞毒性相关。目前基于NK细胞的免疫治疗主要是利用细胞因子体内扩增、激活NK 细胞。从早期的大剂量IL-2治疗的严重毒副作用到随后的长期小剂量联合间断中剂量IL-2治疗证实在HIV 感染及恶性肿瘤患者中可以较好耐受。但这种治疗方法只是增强骨髓祖细胞向NK细胞分化及依赖IL-2延迟NK细胞的凋亡,而并非外周血成熟NK细胞的增生[5]。因此联合应用IL-2和其它细胞因子(如IL-12、IL-15、IFN-α、-β、-γ) 可能达到更好的体内和体外扩增NK细胞的效果[16]。
本研究采用包含经X线处理的HFWT细胞为饲养细胞,和提取的人PBMC进行联合培养,不仅培养周期短,培养效率高,而且对多种肿瘤包括肝癌细胞有明显杀伤作用[17]。
本研究对人白血病细胞株K562[缺乏对NK细胞免疫球蛋白样受体(killer cell immunoglobulin-like receptor,KIR)高度敏感的MHC-I类分子],以及人癌细胞株BEL-7402、HepG2和SMMC-7721进行体外杀伤实验并在上述肝癌细胞BALB/c-nu/nu动物模型进行抑瘤实验,结果显示激活的NK细胞对不同的肝癌细胞株均有杀伤或抑瘤作用,但其作用有明显差异,BEL7402最好,HepG2次之,SMMC7721最差。进一步流式细胞测定肿瘤细胞表面MIC表达,显示BEL-7402(48.7%)、 HepG2(32.8%)和SMMC-7721(0.9%)依次降低。因此,从初步结果看NK细胞杀伤肝癌的能力和肝癌细胞MIC呈正相关。然而,应该认识到,NK细胞和肝癌细胞的作用机制非常复杂,MIC的表达可能仅是其中的一方面。
[1] Llovet JM, Burroughs A, Bruix J. Hepatocellular carcinoma[J]. Lancet, 2003, 362(9399): 1907-1917.
[2] Yoo HY, Patt CH, Geschwind JF, et al. The outcome of liver transplantation in patients with hepatocellular carcinoma in the United States between 1988 and 2001: 5-year survival has improved significantly with time[J].J Clin Oncol,2003,21(23):4329-4335.
[3] Allgaier HP, Deibert P, Olschewski M, et al. Survival benefit of patients with inoperable hepatocellular carcinoma treated by a combination of transarterial chemoembolization and percutaneous ethanol injection- a single-center analysis including 132 patients[J]. Int J Cancer,1998, 79(6):601-605.
[4] Takayasu K, Wakao F, Moriyama N, et al. Postresection recurrence of hepatocellular carcinoma treated by arterial embolization: analysis of prognostic factors[J] Hepatology, 1992,16(4): 906-911.
[5] Farag SS, VanDeusen JB, Fehniger TA, et al. Biology and clinical impact of human natural killer cells[J]. Int J Hematol,2003, 78(1): 7-17.
[6] Wada Y, Nakashima O, Kutami R, et al. Clinicopathological study on hepatocellular carcinoma with lymphocytic infiltration[J]. Hepatology,1998,27(2): 407-414.
[7] Cai L, Zhang Z, Zhou L, et al. Functional impairment in circulating and intrahepatic NK cells and relative mechanism in hepatocellular carcinoma patients[J]. Clin Immunol,2008,129(3):428-437.
[8] Korangy F, Höchst B, Manns MP, et al. Immune responses in hepatocellular carcinoma[J]. Dig Dis,2010,28(1):150-154.
[9] Miyagi T, Takehara T, Tatsumi T, et al. CD1d-mediated stimulation of natural killer T cells selectively activates hepatic naturalkiller cells to eliminate experimentally disseminated hepatoma cells in murine liver[J]. Int J Cancer,2003,106(1):81-89.
[10]Taketomi A, Shimada M, Shirabe K,et al. Natural killer cell activity in patients with hepatocellular carcinoma: a new prognostic indicator after hepatectomy[J]. Cancer, 1998, 83(1):58-63.
[11]Du X, Bai Z, Zhang J, et al. Prolonged survival of human hepatocarcinoma cells in the liver of newborn C57BL/6 mice and resulting cellular xenorejection, especially the activation of hepatic natural killer T cells[J]. Pathobiology,2010,77(3):115-128.
[12]Harada H, Saijo K, Watanabe S, et al. Selective expansion of human natural killer cells from peripheral blood mononuclear cells by the cell line, HFWT[J]. Jpn J Cancer Res, 2002, 93(3):313-319.
[13]Wisse E, Luo D, Vermijlen D, et al. On the function of pit cells, the liver-specific natural killer cells[J]. Semin Liver Dis, 1997, 17(4): 265-286.
[14]龙天柱,李国林,吕丽虹,等.大鼠肝脏NK细胞的分离、纯化与超微结构特征[J]. 中国病理生理杂志, 2009,25(6):1240-1243.
[15]Takayama T, Sekine T, Makuuchi M, et al. Adoptive immunotherapy to lower postsurgical recurrence rates of hepatocellular carcinoma: a randomised trial[J]. Lancet, 2000, 356(9232): 802-807.
[16]Miller JS, Soignier Y, Panoskaltsis-Mortari A, et al. Successful adoptive transfer andinvivoexpansion of human haploidentical NK cells in patients with cancer[J]. Blood, 2005,105(8):3051-3057.
[17]Ishikawa E, Tsuboi K, Saijo K, et al. Autologous natural killer cell therapy for human recurrent malignant glioma[J]. Anticancer Res, 2004,24(3b): 1861-1871.
ActivatedNKcellsagainsthumanhepatocellularcarcinomacelllinesinvitroandinvivo
LI Jian-jun1, CHEN Shi-ping1,GU Mo-fa2, YANG Wei-min3, LI Yong-qiang1, WANG Qi-jing1, HE Jia1, PAN Ke1, ZHAO Jing-jing1, XIA Jian-chuan1
(1BiotherapyCenter,2DepartmentofRadiationOncology,StateKeyLaboratoryofOncologyinSouthChina,CancerCenter,SunYat-senUniversity,Guangzhou510060,China;3DepartmentofObstetricsandGynaecology,HuangpuCampus,TheFirstAffiliatedHospital,SunYat-senUniversity,Guangzhou510700,China.E-mail:xiajch@mail.sysu.edu.cn)
AIM: To evaluate the role of natural killer(NK) cells against a variety of human hepatocellular carcinoma (HCC) cell linesinvitroandinvivo, and to investigate the expression of MHC class I chain-related protein (MIC protein) in these HCC cell lines.METHODSPeripheral blood mononuclear cells (PBMC) were isolated from 50 mL peripheral blood donored by a healthy volunteer and cultured in the NK cell kit followed by amplification and cytokine activation. The release of lactate dehydrogenase (LDH) was detected by lysis experiment. Animal experiments were performed following vaccination with HCC cell lines (BEL7402, HepG2 and SMMC7721) in BALB/c-nu/nu mice. The diameters of the tumors were measured and the growth curves of difference cell lines were delineated. Three weeks later, these mice were sacrificed and the weight of the transplanted tumors was also detected. Furthermore, the expression of MIC protein was determined.RESULTSThe obvious differences of lysis effects of NK cells on different cell lines were observed, in which the lysis effect of NK cells on K562 cells was the strongest, the effect on BEL7402 cells was in the middle and the effect on SMMC7721 cells was the weakest. In animal experiments, NK cells also showed obvious and different restraining effects on a variety of HCC cell line-transplanted tumors in nude mice. The tumor inhibitory rates of NK cells were 43.5% in BEL-7402 cell-transplanted tumor, 40.7% in HepG2 cell-transplanted tumor and 36.0% in SMMC-7721 cell-transplanted tumor. The protein expression of MIC was 48.7%, 32.8% and 0.9% in the 3 cell lines,respectively.CONCLUSIONThe lysis effects of NK cells on a variety of human HCC cell lines are different. The expression of MIC in the tumor cells may play distinct role in evaluating these differences.
Natural killer cells; Liver neoplasms; MHC class I chain-related protein
R735.7
A
10.3969/j.issn.1000-4718.2012.04.011
