应用蛋白质组学和组织芯片研究annexin A2在胃癌中的表达*
2012-11-06李秀娟刘桂桃张志强张桂英李茂玉
李秀娟, 刘桂桃, 张志强, 温 浩, 张桂英, 李茂玉
(新疆医科大学 1第一附属医院消化科,2基础医学院病理生理学教研室,3第五附属医院职业病科,新疆 乌鲁木齐 830011;中南大学湘雅医院 4 消化科,5卫生部蛋白质组学重点实验室, 湖南 长沙 410008)
1000-4718(2012)04-0619-06
2011-11-20
2012-02-13
国家自然科学基金资助项目 (No.81001101);新疆维吾尔自治区自然科学基金资助项目(No.2010211B20);新疆维吾尔自治区高校科研计划青年教师科研启动基金资助项目(No.XJEDU2010S24);自治区卫生厅青年科技人才专项科研项目(No.2009Y06)
△通讯作者 Tel:0991-4362608 ;E-mail:zhiqiangzhang2011@hotmail.com
应用蛋白质组学和组织芯片研究annexin A2在胃癌中的表达*
李秀娟2, 刘桂桃3, 张志强1△, 温 浩1, 张桂英4, 李茂玉5
(新疆医科大学1第一附属医院消化科,2基础医学院病理生理学教研室,3第五附属医院职业病科,新疆 乌鲁木齐 830011;中南大学湘雅医院4消化科,5卫生部蛋白质组学重点实验室, 湖南 长沙 410008)
目的研究胃癌中膜联蛋白A2(ANXA2)的差异表达及其与胃癌临床病理参数的关系。方法激光捕获显微切割技术(LCM)纯化15例胃腺癌细胞(GAC)和其癌旁正常胃黏膜上皮细胞(NGEC),采用18O/16O分别标记2种细胞样本酶切后的多肽混合物。纳升级反相液相色谱串联质谱(Nano-RPLC-MS/MS)定量鉴定GAC和NGEC的差异表达蛋白质。Western blotting验证差异蛋白ANXA2的表达。免疫组化方法检测组织芯片中75对胃癌组织和癌旁组织中ANXA2的表达,分析ANXA2表达与胃癌临床病理参数的关系。结果共筛选出78个差异表达蛋白质,其中ANXA2蛋白的表达水平在GAC中较NGEC中明显上调(2.32∶1),Western blotting检测ANXA2蛋白表达在GAC组升高(P<0.01);免疫组化显示:ANXA2的表达与胃癌的浸润深度、淋巴结转移、分化程度、TNM分期和肿瘤大小相关(P<0.01),与年龄、性别和远处转移无关(P>0.05)。结论ANXA2蛋白的上调可能在胃癌的生物学行为中发挥重要作用。
胃肿瘤; 膜联蛋白A2; 蛋白质组
膜联蛋白A2(annexin A2,ANXA2)是Annexins多基因家族中A亚家族重要成员,具有钙离子介导的磷脂结合特性。ANXA2在人体内皮细胞、单核/巨噬细胞、某些肿瘤细胞和神经细胞等多细胞系均表达,在增生和转化细胞中高表达,在终末分化的细胞中低表达。ANXA2具有多种重要功能,包括参与膜形成、膜转运、胞吞、胞吐、信号转导、细胞迁移、DNA的合成、细胞增殖、分化和凋亡等等多种生物学行为。近年来,ANXA2已成为肿瘤细胞生物学领域中的一个新的研究热点,研究资料表明其表达失调与人类多种肿瘤的发生、发展、侵润及转移密切相关[1]。本研究采用激光捕获显微切割技术(laser capture microdissection, LCM)获得纯化的胃腺癌细胞(gastric adenocarcinoma cells, GAC)及正常胃黏膜上皮细胞(normal gastric epithelial cells, NGEC);应用18O/16O分别标记2种细胞样本酶切后的多肽混合物,纳升级反相液相色谱串联质谱(nanoliter-scale reverse-phase liquid chromatography-mass spectrometry/mass spectrometry, Nano-RPLC-MS/MS)鉴定并定量差异表达蛋白质,为进一步验证蛋白质组学的结果,Western blotting验证差异蛋白的表达;并用免疫组化(immunohistochemistry,IHC)技术检测ANXA2在组织芯片中75对胃癌组织和配对癌旁组织中的表达,分析ANXA2与患者年龄、性别、分化程度、转移、浸润深度、临床原发肿瘤-淋巴结转移-远处转移(tumor- lymph node- metastasis,TNM)分期和肿瘤大小(最大径)等临床病理参数的关系,以探讨ANXA2蛋白差异表达与胃癌发生发展及预后的关系和可能机制。
材 料 和 方 法
1材料和仪器
人类胃癌组织芯片(批号为OD-CT-DgStm01),上海芯超科技有限公司提供;甲基绿组织染色剂、琼脂糖、过硫酸铵、丙烯酰胺、亚甲双丙烯酰胺、甘氨酸、N,N,N′,N′-四甲基乙二胺、三羟甲基氨基甲烷、3-[3-(胆酰胺丙基)二甲氨基]丙磺酸内盐、十二烷基硫酸钠(sodium dodecyl sulfate, SDS)、碳酸氢铵、三氟乙酸和乙睛均为Sigma-Aldrich产品;2D Quant Kit蛋白定量试剂盒、尿素、硫脲、NP-40、Triton X-100、二硫苏糖醇(DL-dithiothreitol,DTT)、碘乙酰胺和溴酚蓝均为Amersham Biosciences产品;苏木素染色剂和伊红染色剂由福州迈新生物技术开发公司提供;OCT组织包埋剂购自Leica AS;蛋白酶抑制剂均为Indianapolis产品;98%H218O购自江苏 Huayi Isotope公司;Immobilized TPCK trypsin为Pierce产品;胰蛋白酶为Promega产品;ZipTipC18为Millipore产品。所用溶液均用 Milli-Q去离子水配制。激光捕获显微切割仪(LCM系统)、C1900冰冻切片机为Leica AS产品;ELx800自动酶标仪为Bio-Tek Instruments产品;Hoefer SE 600 垂直电泳槽为Bio-Rad产品;ESI-Q-TOF-MS质谱仪,为Micromass产品。
2方法
2.1标本采集及处理 15例胃腺癌及配对的胃黏膜组织来自2009年6月~10月新疆医科大学第一附属医院普外科手术切除标本。女性6例,男性9例,年龄40~81岁,平均56岁,TNM分期包括Ⅰ~Ⅳ期。手术标本切除30 min内,取胃癌组织及癌旁(距原发肿瘤>5 cm)胃黏膜组织,大小约1.0 cm×1.0 cm×1.0 cm,即刻生理盐水反复冲洗,去除血液和其它组织,-80 ℃冰箱保存备用于蛋白质组学和Western blotting。所有样本的获得和使用均经过患者知情同意和新疆医科大学伦理委员会的审查同意。
2.2LCM获取目的细胞及蛋白样本制备 胃腺癌组织和癌旁胃黏膜组织(8~10 μm)连续冰冻切片,贴于LCM专用薄膜载片上,75%乙醇固定,甲基绿染色;LCM仪分别切割捕获GAC和NGEC。纯化的细胞分别各自混合后加入组织细胞裂解液裂解提取总蛋白,Bradford法测定蛋白浓度。10%SDS-PAGE电泳对裂解后的GAC和NGEC总蛋白预分离,上样量均为100 μg,电泳好的凝胶行考马斯亮蓝R-250染色;按凝胶显示条带把凝胶平行切割成36对配对的蛋白凝胶条带,经洗涤、脱色、脱水、DTT还原、IAA烷基化和真空离心干燥处理后,加入胰蛋白酶溶液酶解,萃取后,合并为多肽混合物提取液,冻干;然后进行18O/16O标记:在混有immobilized trypsin的多肽混合物中加入8 μL H218O(或H216O)和2 μL乙腈,混匀后37 ℃孵育24 h;标记结束后用1 μL甲酸终止反应。
2.3蛋白质鉴定及质谱数据分析 采用Nano-RPLC-MS/MS技术,在不同含有多肽混合物的Eppendorf管中加入流动相A液(含0.1%甲酸的水溶液),振荡,离心,取上清于带锥底的小瓶中,置于UltimateFAMOS液相色谱系统自动进样器的样品架上。用辅助泵,以流动相A液,流速为20 μL/min,10 min后,将样品上样至预柱上并脱盐,后将预柱切换到与毛细管分析柱相连,梯度洗脱。溶剂梯度为:B液(水/乙腈,V/V,并加入0.1%甲酸),5%B,0~10 min;5%~90%B,55 min;90%B,5 min;90%~100%B,10 min。经过15 min平衡后,进行下一次分离。纳升级分析色谱柱的流速约250 nL/min。洗脱液直接通过ESI源离子化进入Q-TOF质谱仪进行分析。采用标准肽段Glu-Fibrino peptide B 对质谱仪进行外标校正,质谱数据经Masslynx 4.0处理产生Peaklist(pkl)文件,采用本地Mascot 2.0查询IPI数据库鉴定蛋白质。定量分析采用Masslynx软件从总离子流(TIC)图中提取包含待定量肽段的一级质谱,整合产生用于定量分析的质谱图,根据公式Equation 1[2]计算16O/18O比例。
2.4Western blotting检测差异蛋白annexin A2的表达水平 样本为15对显微切割纯化的GAC和NGEC,分别加入4 ℃预冷的组织裂解液;Vortex混匀,冰上裂解30 min;4 ℃,12 000 r/min离心30 min,吸取上清(即为细胞总蛋白质)至新离心管中;Bradford法测定蛋白浓度,-70 ℃保存待用。样本总蛋白进行10%聚丙烯酰胺凝胶电泳(SDS-PAGE)分离(上样量为40 μg),100V电泳2 h左右;蛋白电泳后转移至硝酸纤维素膜上;1∶500稀释的兔抗人annexin A2抗体4 ℃孵育过夜;1∶2 000稀释的HRP标记的羊抗鼠Ⅱ抗室温孵育2 h,ECL试剂发光、显影和定影,所得图像经扫描,采用Quantity One软件计算差异蛋白质的相对表达水平。
2.5组织芯片免疫组化染色 按链霉素抗生物素蛋白过氧化物酶法免疫组化染色(SP法)试剂盒说明书操作:150点人类胃癌组织芯片(含胃癌组织和配对的癌旁组织各75份),每点分别加入过氧化物酶阻断溶液(试剂A);加正常非免疫动物血清(试剂B);除去血清后加1∶100 annexin A2抗体;加生物标记的Ⅱ抗(试剂C);加链霉素抗生物素-过氧化物酶溶液(试剂D),每步用PBS冲洗,室温孵育;DAB显色,苏木素复染,蓝化,梯度乙醇脱水,中性树胶封固。用已知的阳性片作阳性对照;用PBS液代替Ⅰ抗作阴性对照。IHC染色评分:采用Formowitz综合计分法[3],据每张切片的染色强度和阳性细胞比例计分:着色强度:无染色0分,浅黄色1分,棕黄色2分,棕褐色3分;每点随机选取至少10个高倍镜视野(×200),至少计数1 000个细胞;细胞中染色阳性细胞数5%为0分; 5%~25%为1分;26% ~50%为2分;51%~75%为3分;>75%为4分;染色强度评分与阳性细胞数比例的评分相加之和2分为阴性(-),2~3分为弱阳性(+),4~5分为中度阳性(++),6~7分为强阳性(+++)。
3统计学处理

结 果
1GAC与NGEC的差异蛋白质的分离鉴定
经LCM技术纯化的高同质性(>90%)的GAC与NGEC,样本总蛋白经1D-SDS-PSGE分离、胶上酶切、提取及18O标记,再经Nano-RPLC-MS/MS鉴定,按照18O/16O比值在2倍以上或低于0.5倍为差异蛋白质的标准,共鉴定得到78个差异蛋白,其中42个蛋白在胃癌表达上调,36个蛋白表达降低。差异表达蛋白质涉及代谢酶类、酶解相关蛋白、细胞骨架蛋白、信号转导相关蛋白和一些功能未知蛋白等;其中ANXA2表达在GAC较NGEC高2.32倍,见图1。
2Westernblotting验证差异蛋白ANXA2的表达
Western blotting以β-actin为内参照,以条带最大灰度值作为1,其它的灰度值与其相除,作为蛋白质相对表达水平。结果显示:ANXA2在GAC中较NGEC中上调(P<0.01),据灰度分析的差异蛋白的定量关系,其结果与比较蛋白组分析基本一致,见图2、表1。
3组织芯片胃癌和癌旁组织中ANXA2蛋白的表达
IHC检测150点人类胃癌组织芯片,结果显示:ANXA2蛋白主要在胃癌组织和癌旁组织(正常胃黏膜)的胞浆中呈阳性表达,在部分胃癌细胞膜也有阳性表达。ANXA2蛋白在胃癌中高表达,其在胃癌和癌旁组织细胞中的阴性、弱阳性、中阳性和强阳性表达率分别为:10.6%、18.7%、37.3%、33.3%vs28.0%、32.0%、38.7%、1.3%(P<0.01),见表2;ANXA2蛋白表达与胃癌浸润深度、淋巴结转移、组织分化程度、TNM分期和肿瘤大小相关(P<0.01),而与患者年龄、性别和远处转移无关(P>0.05),见图3、表3。
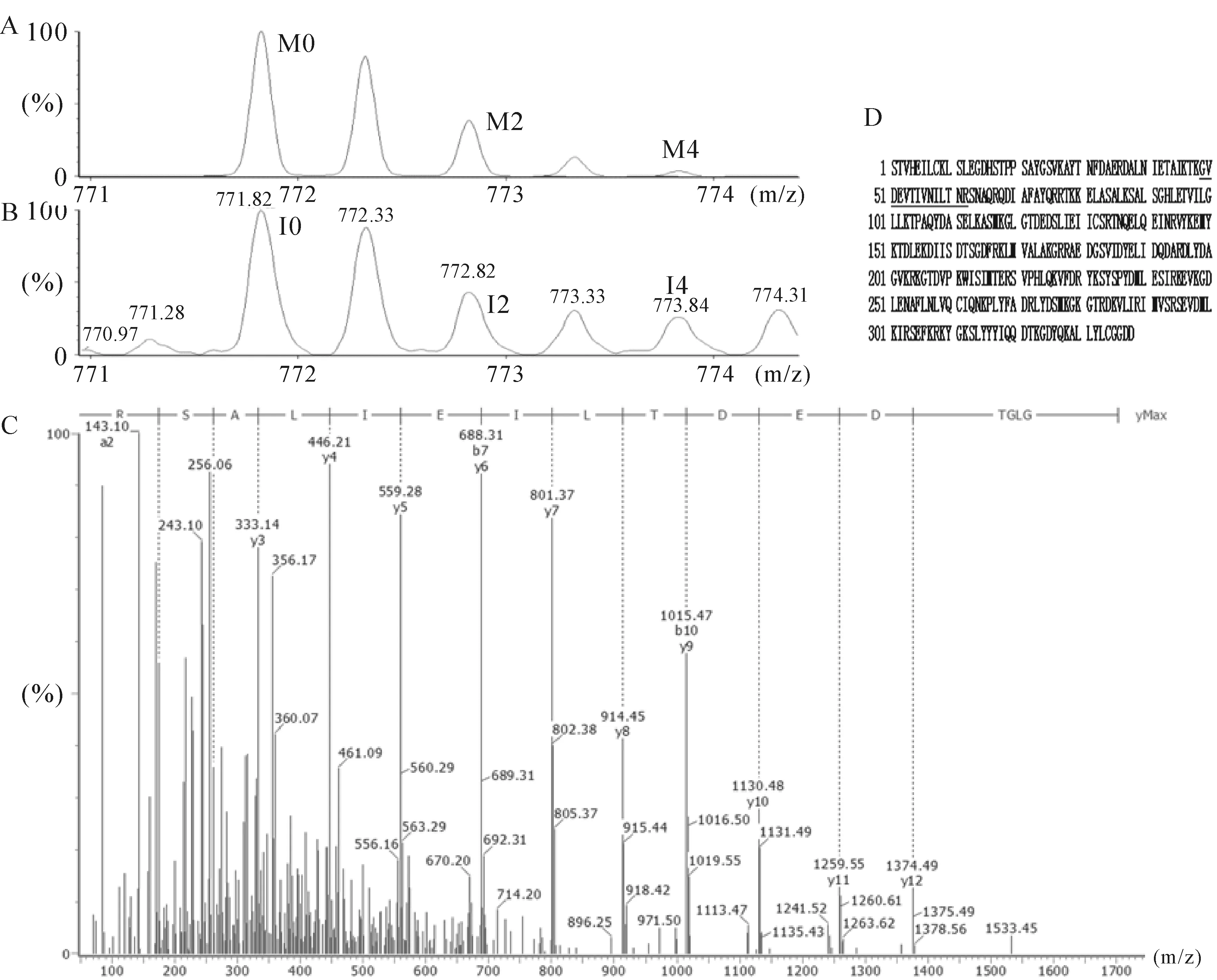
Figure 1. Mass spectrum showing the isotopic distribution patterns of the peptide of annexin A2 (GVDEVTIVNILTNR) and ESI-Q-TOF-MS analysis.A: theoretical isotopic distribution patterns (M0, M2, M4). B:isotopic distribution patterns after18O labeling .I0:unlabelled; I2:single labeled; I4:doubly labeled. C:the amino acid sequence of a doubly charged peptide with m/z 771.83 was identified as GVDEVTIVNILTNR and matched with residues 49~62 of ANXA2. D: protein sequence of ANXA2 was shown. MS/MS fragmentation-matched peptide was underlined.
图1ANXA2蛋白肽段(GVDEVTIVNILTNR)18O标记质谱峰分布图和ESI-Q-TOF-MS鉴定结果
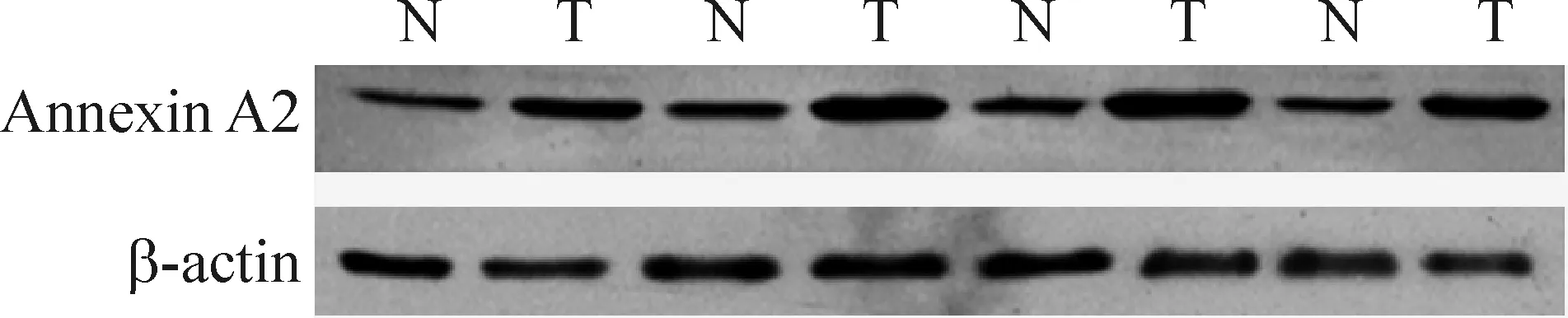
Figure 2. The expression of ANXA2 protein in NGEC(N)and GAC(T) detected by Western blotting.
图2Westernblotting检测ANXA2蛋白在NGEC和GAC的表达
表1NGEC组和GAC组ANXA2蛋白的表达


GroupANXA2expressionNGEC0.420±0.057GAC0.920±0.058**
**P<0.01vsNGEC group.

Figure 3. The expression of ANXA2 protein in normal gastric mucosa(A),high-differentiated gastric carcinoma(B) and low-differentiated gastric carcinoma(C) (immunohistochemical staining,×200).
图3ANXA2蛋白在正常胃黏膜和高、低分化胃癌的表达
表2IHC检测ANXA2蛋白在正常胃黏膜和胃癌中的表达
Table 2. The expression of ANXA2 in normal gastric mucosa and gastric carcinoma detected by IHC [n(%).n=75]
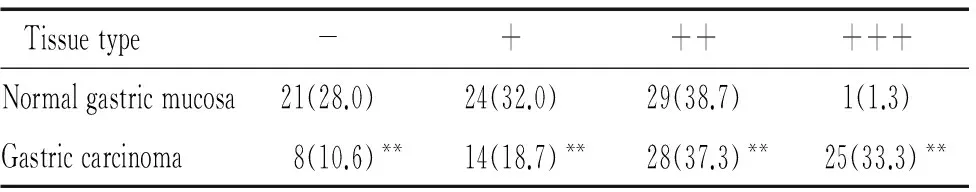
Tissuetype-++++++Normalgastricmucosa21(28.0)24(32.0)29(38.7)1(1.3)Gastriccarcinoma8(10.6)**14(18.7)**28(37.3)** 25(33.3)**
**P<0.01vsnormal gastric mucosa group.
讨 论
胃癌是一种常见的消化道恶性肿瘤,其病变部位隐匿,早期诊断率低,绝大多数胃癌患者就诊时已是晚期;加之术后复发、转移等原因导致胃癌的治疗和预后差。探讨胃癌的发生发展机制有望改变胃癌患者长期以来生存时间短、化疗和放疗效果有限的现状。胃癌既是一种多基因疾病,同时也是一种蛋白质组疾病。蛋白质组学技术在识别肿瘤发生发展过程中相关蛋白质种类、表达水平与修饰的改变、发现肿瘤分子标志物和治疗靶标方面具有重要的作用。
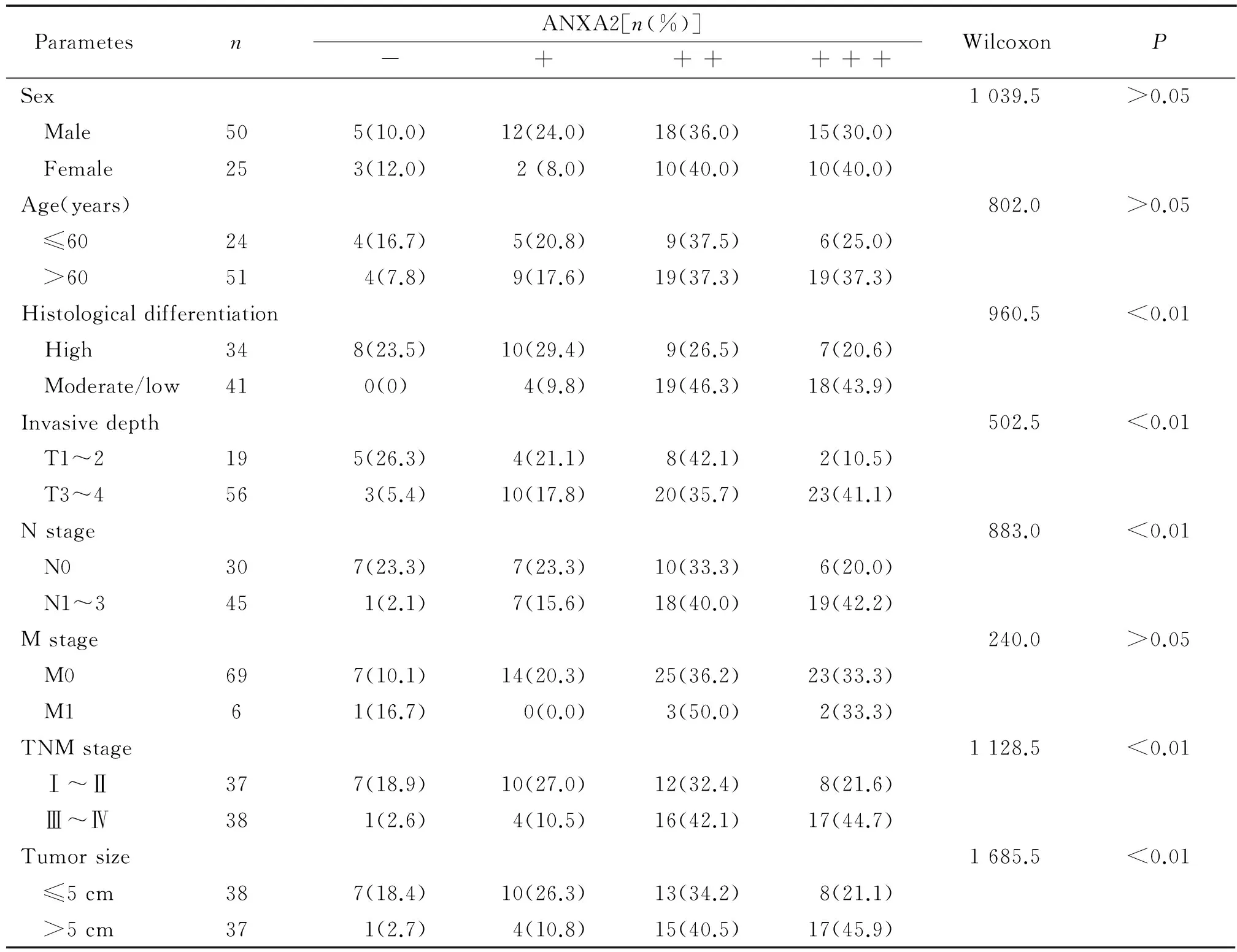
表3 胃癌组织中ANXA2表达与各临床病理参数的关系
国内外有以胃癌细胞株,血清为样本采用蛋白质组学的方法研究胃癌[4],发现了一些有意义的分子标志物,如:AMP-18、组织蛋白酶D、胃蛋白酶C[5]等,这对发现和鉴定胃癌相关生物学标记奠定了一定基础,但目前尚没有一种肿瘤标志物真正应用于临床作为胃癌发病前、中、后和进展转归预测诊断标记。因此,胃癌的蛋白质组学有待进一步深入研究。本研究采用操作简单的LCM技术,解决了肿瘤蛋白质组学异质性的问题,快速获得了同质性达90%以上的纯化细胞;结合目前在蛋白质组学领域较先进的18O稳定同位素标记技术结合质谱联用定量蛋白质学,以人的正常胃黏膜组织和胃癌组织为研究对象,筛选差异蛋白质并进行鉴定。结果发现78个差异蛋白质,其中42个在胃癌细胞较正常胃黏膜上皮细胞高表达,36个则相反呈低表达。这些差异蛋白为胃癌发生发展机制的研究和胃癌分子标志物的筛选奠定了基础。
在筛选鉴定的差异蛋白质中,ANXA2在胃癌中表达明显上调。ANXA2的生物学功能非常广泛[6]。已有研究证实其在不同肿瘤中表达各异,在肝癌、胰腺癌、宫颈鳞状细胞癌、卵巢交界黏液囊腺瘤和囊腺癌、肾细胞癌[7]和神经胶质瘤等多种组织中上调,为癌基因,而在食管黏膜细胞癌和前列腺癌中则低表达或缺失,为抑癌基因;Emoto等[8]通过免疫组化研究发现人原发性大肠癌中有29.5%的ANXA2高表达,表达水平与肿瘤组织型、体积、分期及侵袭情况有关,Pei等[9]研究发现,ANXA2在有淋巴结转移结肠癌中的表达较未发生淋巴结转移结肠癌的表达升高,提示ANXA2上调可作为结肠癌预后的指标。本研究利用了组织芯片技术发现ANXA2在胃癌组织较癌旁组织显著高表达;分析其与临床病理参数的关系发现:与胃癌局限于黏膜、黏膜下层、肌层和侵及浆膜下层的相比,ANXA2在肿瘤穿透浆膜层,侵及邻近结构的组织中表达上调;有淋巴结转移的较无淋巴结转移的胃癌组织中ANXA2高表达;高分化胃癌中ANXA2的表达较低分化组下降;随着TNM分期的增高,ANXA2表达的阳性率也升高;且肿瘤直径>5cm的ANXA2阳性表达显著高于其在肿瘤直径≤5cm的表达。这提示ANXA2与胃癌的生物学行为密切相关,其参与了胃癌发生发展、侵袭和转移过程,可能是胃癌基因,ANXA2有望成为判断胃癌预后的重要指标。目前ANXA2参与胃癌生物学行为的机制尚不十分清楚,根据ANX A2的功能及其与其它恶性肿瘤的关系研究[10],推测其参与胃癌生物学行为的可能机理如下:(1)ANXA2参与DNA合成、调节G2/M+S周期进程而调节胃癌细胞增殖;(2)诱导ERK1/2磷酸化激活MAPK信号通路促进癌细胞生长;(3)ANXA2与c-Myc、t-PA、PLG、PL、组织蛋白酶B以及S100家族等物质的协同作用;(4)形成ANXA2 /p11- F-actin复合体, 调节不同时期肿瘤细胞的黏附和去黏附,调控细胞形变、黏附、迁移以及恶性肿瘤细胞的侵袭和转移等细胞骨架行为。
本研究采用LCM技术结合高通量定量蛋白质组学方法研究胃癌组织与正常胃黏膜的差异蛋白质,发现并证实了ANXA2在胃癌细胞中呈高表达;应用组织芯片技术免疫组化方法分析ANXA2与胃癌的临床病理参数关系,结果发现ANXA2与肿瘤浸润深度、淋巴结转移、组织分化程度和TNM分期密切相关。研究结果提示,ANXA2可能参与胃癌的发生发展,胃癌组织中ANXA2的高表达可能影响胃癌的生物学行为。其在胃癌中的具体作用机制值得进一步研究,随着相关研究工作的不断深入, ANXA2有望应用于胃癌早期检测、诊断和治疗;可能成为判断胃癌预后的指标和治疗的新靶点,为胃癌的诊治拓展了新思路。
[1] Lokman NA, Ween MP, Oehler MK, et al.The role of annexin A2 in tumorigenesis and cancer progression[J]. Cancer Microenviron, 2011, 4(2):199-208.
[2] Qian WJ, Monroe ME, Liu T, et al. Quantitative proteome analysis of human plasma followinginvivolipopolysaccharide administration using16O/18O labeling and the accurate mass and time tag approach[J]. Mol Cell Proteomics, 2005,4(5):700-709.
[3] Formowitz FB, Viola MV,Chao S, et al. Ras p21 expression in the progression of breast cancer [J]. Hum Pathol, 1987,18(12):1268-1275.
[4] 徐 振, 徐松辉, 晏光荣. 运用亚细胞蛋白质组学方法发现胃腺癌潜在标志物UCHL1 [J]. 中国病理生理杂志, 2010,26(12):2358-2362.
[5] Ebert MP, Lamer S, Meuer J, et al. Identification of the thrombin light chain a as the single best mass for differentiation of gastric cancer patients from individuals with dyspepsia by proteome analysis[J]. J Proteome Res, 2005,4(2):586-590.
[6] 薛雷喜,江 淼,阮长耿. Annexin A2 的生理特性和生物学功能[J]. 江苏医药,2010,36(9):1081-1083.
[7] Domoto T, Miyama Y, Suzuki H, et al. Evaluation of S100A10, annexin Ⅱ and B-FABP expression as markers for renal cell carcinoma[J]. Cancer Sci, 2007,98(1):77-82.
[8] Emoto K, Yamada Y, Sawada H, et al. Annexin Ⅱ overexpression correlates with stromal tenascin-C overexpression: a prognostic marker in colorectal carcinoma[J]. Cancer, 2001, 92(6):1419-1426.
[9] Pei H, Zhu H, Zeng S, et al. Proteome analysis and tissue microarray for profiling protein markers associated with lymph node metastasis in colorectal cancer[J]. J Proteome Res, 2007,6(7):2495-2501.
[10]李鹏鸽,杨艳丽,葛玉婷,等.膜联蛋白A2在肿瘤生长调节与细胞骨架活动中的作用[J]. 生理科学进展, 2010, 41(6):457-460.
StudyofannexinA2expressioningastriccancerbyproteomicsandtissuemicroarray
LI Xiu-juan2, LIU Gui-tao3, ZHANG Zhi-qiang1, WEN Hao1, ZHANG Gui-ying4, LI Mao-yu5
(1DepartmentofGastroenterology,TheFirstAffiliatedHospital,2DepartmentofPathophysiology,CollegeofPreclinicalMedicine,3TheOccupationalDiseasesPreventionandTreatmentInstitution,TheFifthAffiliatedHospital,XinjiangMedicalUniversity,Urumqi830011,China;4DepartmentofGastroenterology,5KeyLaboratoryofCancerProteomicsofMinistryofHealthofChina,XiangyaHospital,CentralSouthUniversity,Changsha410008,China.E-mail:zhiqiangzhang2011@hotmail.com)
AIM: To investigate the differential expression of annexin A2 (ANXA2) in gastric carcinoma and to analyze the relationship between ANXA2 expression and clinicopathological parameters of gastric carcinoma.METHODSPure gastric adenocarcinoma cells (GAC) and normal gastric epithelial cells (NGEC) in 15 patients with gastric cancer were acquired by laser capture microdissection (LCM). All peptide specimens after trypsin digestion were labeled with18O/16O. Quantitatively identification of differential expression of the proteins betweem GAC and NGEC was performed by Nano-RPLC-MS/MS. The expression of ANXA2 in the 2 kinds of tissues was detected by Western blotting. Tissue microarray containing 75 pairs of gastric carcinoma and para-carcinoma tissues was used and the expression of ANXA2 in these specimens was detected by the method of immunohistochemistry (IHC). The relationship between ANXA2 expression and clinicopathological parameters of the pateints with gastric carcinoma was analyzed.RESULTSA total of 78 differential proteins were identified and ANXA2 was up-expressed in GAC (2.32∶1), which was confirmed by Western blotting (P<0.01). The results of IHC showed that the correlations between the expression level of ANXA2 protein and invasive depth (T stage), lymph node metastasis (N stage), histological differentiation, TNM stage and the size of tumor were observed (P<0.01), but the correlations between the ANXA2 expression and sex, age and distant metastasis (M stage) were not found (P>0.05).CONCLUSIONThe up-expressed ANXA2 may play an important role in the biological behavior of gastric cancer
Stomach neoplasms; Annexin A2 protein; Proteome
R735.2
A
10.3969/j.issn.1000-4718.2012.04.008
