17种草本植物不同器官干粉对生菜幼苗生长的影响
2012-11-06杨玉良宋吉青杨从军罗小勇
杨玉良, 宋吉青, 杨从军, 罗小勇
(1.青岛农业大学农学与植物保护学院/山东省农作物病虫害综合防控重点实验室,山东青岛 266109; 2.中国农业科学院农业环境与可持续发展研究所/农业部农业环境与气候变化重点开放实验室/农业部旱作节水农业重点开放实验室,北京100081)
杨玉良,宋吉青,杨从军,等. 17种草本植物不同器官干粉对生菜幼苗生长的影响[J]. 杂草科学,2012,30(4):10-15.
17种草本植物不同器官干粉对生菜幼苗生长的影响
杨玉良1, 宋吉青2, 杨从军1, 罗小勇1
(1.青岛农业大学农学与植物保护学院/山东省农作物病虫害综合防控重点实验室,山东青岛 266109; 2.中国农业科学院农业环境与可持续发展研究所/农业部农业环境与气候变化重点开放实验室/农业部旱作节水农业重点开放实验室,北京100081)
采用琼脂混粉法测定了17种常见的草本植物不同器官在0.005~0.5 g/L供试浓度下对受体植物生菜幼苗生长的影响。结果表明,供试的各植物器官对其胚根和胚轴的生长均具有不同程度的抑制或刺激生长活性,其中,马齿苋茎和叶、反枝苋茎、葎草叶、狼尾草茎等器官均表现出了较高的刺激生长活性,而其他植物器官的刺激生长活性相对较低或表现为一定的抑制活性。
草本植物; 化感; 活性; 生长调节; 琼脂混粉法; 生菜
植物化感作用是指一种活体植物(供体)产生并通过挥发、淋溶、根分泌和残株降解等方式向环境释放某些化学物质,从而促进或抑制自身或其他植物生长发育的化学生态学现象[1-2]。植物的化感作用是一个普遍现象。但不同的植物间,同一植物的不同器官间,甚至于同一种植物生长在不同地区时作用程度会存在较大差异。因而,明确植物的化感作用大小对了解植物间的相互作用关系及指导农业生产具有重要意义。目前,有关本领域的研究已成为国内外的热点,仅我国每年发表的论文数量达200篇左右,但这些研究的焦点主要集中在化感物质对杂草生长的抑制作用[3-14]、利用化感活性解释外来入侵植物的入侵机制及其对作物的危害[2,15]、指导复合种植系统中植物的配置[16]等方面,但专注于其农用生长调节活性的研究尚较少。本研究以生菜为受体植物,采用琼脂混粉法测定了17种常见草本植物的不同器官在不同浓度处理下对其幼苗生长的影响,特别是对根系生长的促进作用。
1 材料与方法
1.1 供试植物材料
供试材料有鹅绒藤(CynanchumchinenseR. Br.)叶,彩叶草(ColeusblumeiBenth.)茎和叶,圆叶牵牛[Pharbitispurpurea(L.) Voigt]叶,藜(ChenopodiumalbumL.)根、茎和叶,艾蒿(ArtemisiaargyiLevl. et Vant.)根、茎和叶,反枝苋(AmaranthusretroflexusL.)根、茎和叶,牛筋草[Eleusineindica(L.) Gaertn.]根和叶,葎草[Humulusscandens(Lcur.) Merr.]花、茎和叶,麦冬[Ophitopoginjaponicum(L. f) Ker.-Gawl.]叶,马唐[Digitariasanguinalis(L.) Scop.]茎和叶,狼尾草[Pennisetumalopecuroides(L.) Spreng]根、茎和叶,马齿苋(PortulacaoleraceaL.)根、茎和叶,三叶草(Trifoliumrepens)茎和叶,山苦菜[Ixerischinensis(Thunb.) Nakai]根、茎、叶和花;刺儿菜[Cephalanoplossegetion(Bunge) Kitam.]根和叶,泥胡菜(HemisteptalyrataBunge.)根和叶,播娘蒿[DescurainiaSophia(L.) Schur.]根和叶。各植物器官均采自青岛农业大学校园。将各植物器官置阴凉处干燥后用电动万能粉碎机(FW100型,转速24 000 r/min,天津市泰斯特仪器有限公司生产)粉碎2 min左右,过40目铁筛,粉末备用。
1.2 受体植物
受体植物为抗热绿湖黑核西生菜特选种388(LactucasativaL. var.ramoseHort,蔡兴利国际有限公司,美国)。
1.3 试验方法
生物活性的测定参照罗小勇提出的琼脂混粉法[7]。通过测定植物器官粉末对受体植物生菜幼苗特别是胚根生长的影响观察对根系生长的作用。往往对根系生长的促进可以提高植物的水分利用效率,起到抗旱的作用。
将受体植物生菜种子经0.2%次氯酸钠溶液浸泡15 min,自来水冲洗数次并置流水下浸泡吸水3 h左右,而后用蒸馏水洗涤数次,均匀摆放在带盖方盘内的吸水纸上,滴加蒸馏水至种子不漂浮,遮光置于全智能人工气候箱(HP1000GS-B型,武汉瑞华仪器设备有限责任公司生产)内发芽,待胚根达3~5 mm 时移植至混有不同剂量植物粉末的0.5%琼脂凝胶(事先配制100 mL,并均匀分注至3个小烧杯中)上,以不含植物粉末为空白对照。移植时先用尖嘴镊子在已凝固的琼脂表面插5个小孔,而后分别夹取胚根长度基本一致的预萌发受体植物种子,将胚根垂直由小口轻轻植入琼脂凝胶中。每烧杯5粒,重复3次。为防止光照对化合物及植物幼根生长的影响,将各烧杯放入人工气候箱遮光培养3 d。人工气候箱设置为14 h 光照,25 ℃和10 h黑暗20 ℃的自动循环,箱内的相对湿度为60%。待处理结束后,用电子游标卡尺分别测量受体植物幼苗胚根和胚轴的长度。
按下式计算胚根和胚轴的实际生长量,应用EXCEL软件,以生长量为基数,分别计算每种植物器官处理对生菜胚根和胚轴生长的抑制率以及对样本的误差,抑制率为负数表示促进生长。同时应用SPSS软件以LSD法对获得的抑制率进行差异显著性分析。
生长量 = 处理后的胚根(胚轴)长-处理前的胚根(胚轴)长
(1)

(2)
2 结果与分析
由表1~4可见,供试的17种草本植物不同器官在0.005~0.5 g/L供试浓度下对受体植物生菜幼苗的生长均具有不同程度的影响。
2.1 藜、艾蒿、反枝苋、狼尾草、马齿苋、苦菜和葎草不同器官对生菜幼苗生长的影响
表1为藜、艾蒿、反枝苋、狼尾草、马齿苋、苦菜和葎草不同器官对生菜幼苗生长的影响。
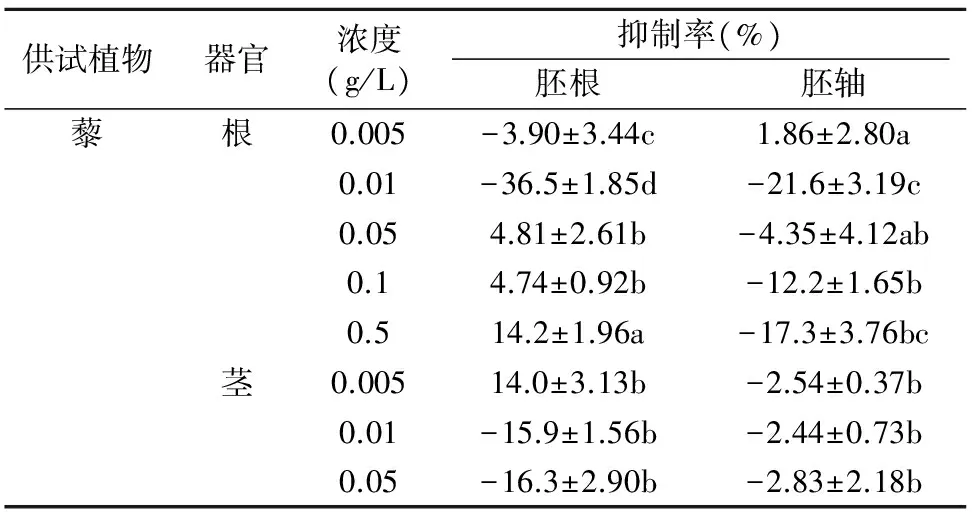
表1 藜、艾蒿、反枝苋、狼尾草、马齿苋、苦菜和葎草不同器官对生菜幼苗生长的影响Table 1 Effects of different organs of Chenopodium album, Artemisia argyi,Amaranthus retroflexus,Pennisetum alopecuroides, Portulaca oleracea,Ixeris chinensis and Humulus scandens on the growth of lettuce seedlings
续表1Table1(Continued)

供试植物器官浓度(g/L)抑制率(%)胚根胚轴0.1-11.7±0.71b-3.29±0.98b0.5-3.29±0.94a8.09±0.37a叶0.0050.44±0.77b-3.78±0.32a0.011.23±0.87b-2.03±1.33a0.050.48±0.93b-6.90±2.48a0.1-3.45±1.04c-6.57±3.17a0.510.7±2.17a-2.15±2.28a艾蒿根0.005-2.52±2.53a-0.41±1.49a0.01-6.83±2.48ab-2.72±1.92a0.05-13.4±2.83b-12.9±2.71b0.1-8.57±2.89ab-1.62±2.04a0.5-4.70±2.36a-15.6±3.35b茎0.0056.20±3.87ab4.02±3.26b0.010.98±1.53bc-13.7±3.44d0.051.91±1.75abc-5.11±2.84c0.1-5.01±3.50c-9.68±2.96cd0.59.47±2.24a14.6±1.19a叶0.005-16.9±4.33d-36.7±6.24c0.01-9.39±4.63cd-13.4±5.44b0.05-3.10±4.85c-21.8±3.22b0.116.6±3.47b7.47±1.69a0.542.5±5.50a-16.0±3.48b反枝苋根0.00514.6±3.45b3.73±1.96b0.01-2.09±2.08c-20.5±1.74c0.052.53±0.24c7.69±2.62ab0.120.5±1.14a14.6±4.90a0.519.0±1.83ab4.01±1.86b茎0.005-17.5±2.63b-10.4±2.06a0.01-11.0±1.75ab-14.3±1.90ab0.05-24.1±3.76b-19.9±2.02b0.1-10.7±3.13ab-15.0±2.65ab0.5-4.87±2.30a-12.2±2.31a叶0.0050.27±3.03bc-12.8±2.96cd0.01-8.96±3.28c-16.7±1.77d0.05-18.2±3.60c-7.58±2.80bc0.12.46±2.73b-4.83±3.36b0.512.0±3.89a5.26±0.83a狼尾草根0.0054.10±1.44c13.1±2.65b0.01-2.34±0.14d5.51±1.38c0.050.57±2.40cd-3.52±3.41d0.112.1±1.72b9.95±3.38bc0.526.6±2.66a21.1±1.70a茎0.005-7.58±1.09c-21.7±2.44bc0.01-4.32±1.40c-29.5±1.55c0.05-4.40±2.12c-14.9±1.82b0.16.94±4.32b-14.0±3.80b0.557.6±3.63a10.1±3.68a叶0.0053.03±2.84b-16.7±3.64c0.0114.6±1.64a0.73±1.63ab0.0521.4±4.18a-2.94±4.04b0.119.0±2.91a-6.12±3.83b0.520.3±0.48a7.57±0.27a马齿苋根0.0050.26±2.31b-4.50±3.57b
续表1Table1(Continued)
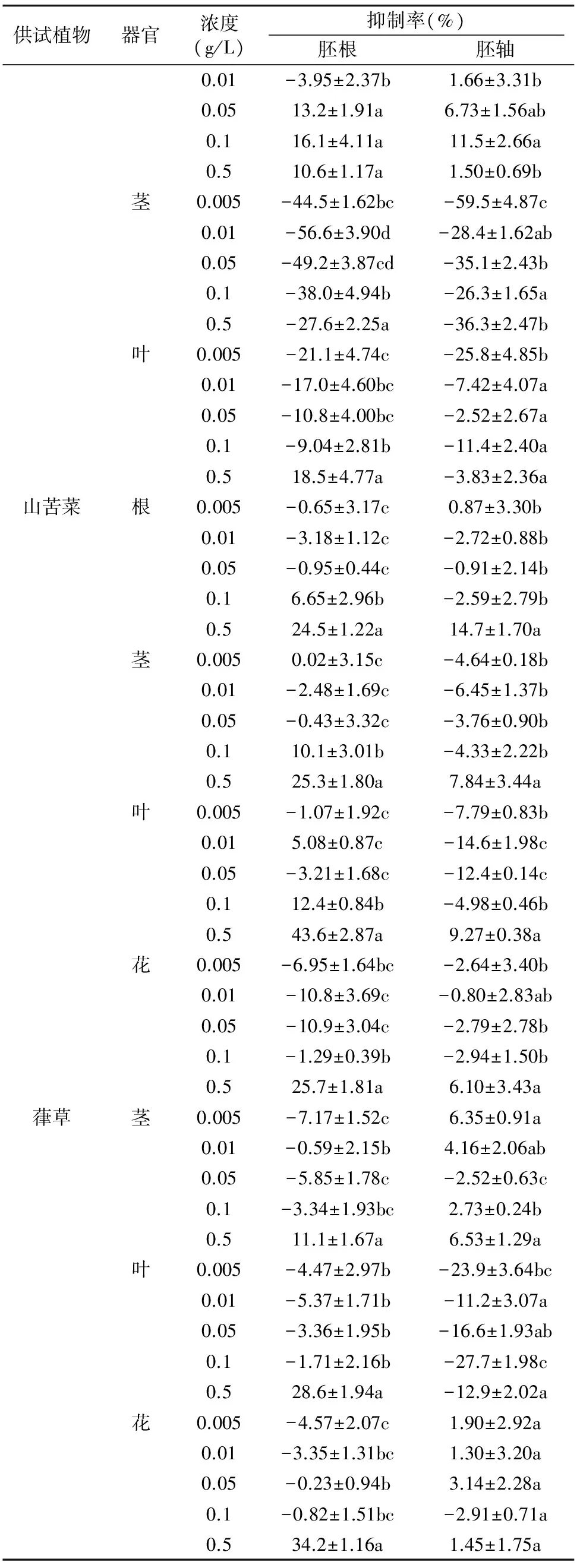
供试植物器官浓度(g/L)抑制率(%)胚根胚轴0.01-3.95±2.37b1.66±3.31b0.0513.2±1.91a6.73±1.56ab0.116.1±4.11a11.5±2.66a0.510.6±1.17a1.50±0.69b茎0.005-44.5±1.62bc-59.5±4.87c0.01-56.6±3.90d-28.4±1.62ab0.05-49.2±3.87cd-35.1±2.43b0.1-38.0±4.94b-26.3±1.65a0.5-27.6±2.25a-36.3±2.47b叶0.005-21.1±4.74c-25.8±4.85b0.01-17.0±4.60bc-7.42±4.07a0.05-10.8±4.00bc-2.52±2.67a0.1-9.04±2.81b-11.4±2.40a0.518.5±4.77a-3.83±2.36a山苦菜根0.005-0.65±3.17c0.87±3.30b0.01-3.18±1.12c-2.72±0.88b0.05-0.95±0.44c-0.91±2.14b0.16.65±2.96b-2.59±2.79b0.524.5±1.22a14.7±1.70a茎0.0050.02±3.15c-4.64±0.18b0.01-2.48±1.69c-6.45±1.37b0.05-0.43±3.32c-3.76±0.90b0.110.1±3.01b-4.33±2.22b0.525.3±1.80a7.84±3.44a叶0.005-1.07±1.92c-7.79±0.83b0.015.08±0.87c-14.6±1.98c0.05-3.21±1.68c-12.4±0.14c0.112.4±0.84b-4.98±0.46b0.543.6±2.87a9.27±0.38a花0.005-6.95±1.64bc-2.64±3.40b0.01-10.8±3.69c-0.80±2.83ab0.05-10.9±3.04c-2.79±2.78b0.1-1.29±0.39b-2.94±1.50b0.525.7±1.81a6.10±3.43a葎草茎0.005-7.17±1.52c6.35±0.91a0.01-0.59±2.15b4.16±2.06ab0.05-5.85±1.78c-2.52±0.63c0.1-3.34±1.93bc2.73±0.24b0.511.1±1.67a6.53±1.29a叶0.005-4.47±2.97b-23.9±3.64bc0.01-5.37±1.71b-11.2±3.07a0.05-3.36±1.95b-16.6±1.93ab0.1-1.71±2.16b-27.7±1.98c0.528.6±1.94a-12.9±2.02a花0.005-4.57±2.07c1.90±2.92a0.01-3.35±1.31bc1.30±3.20a0.05-0.23±0.94b3.14±2.28a0.1-0.82±1.51bc-2.91±0.71a0.534.2±1.16a1.45±1.75a
注:表中数据为抑制率±标准误差(n=3);同列不同小写字母表示在0.05水平上差异显著。下同。
2.1.1 藜 根器官粉末在0.005 g/L和0.01 g/L的低浓度下对生菜胚根的生长分别显示了3.9%和36.5%的刺激生长活性,在0.05 g/L以上的各浓度下则显示出轻微的抑制活性。该器官对胚轴的生长除最低的0.005 g/L浓度外其余均表现为一定的刺激生长活性,刺激生长率达4.35%~21.6%;茎器官粉末除了0.5 g/L浓度下对胚轴生长显示出8.1%的抑制活性外,其余浓度下对胚根和胚轴均表现为刺激生长活性,且对胚根的活性高于对胚轴的活性;叶器官粉末在各浓度下对胚轴的生长显示了轻微的刺激生长活性,而对胚根生长的影响不大。
2.1.2 艾蒿 根器官粉末在各供试浓度下对生菜胚根和胚轴的生长均表现为刺激生长活性,且该活性在0.05 g/L的浓度下分别达13.4%和12.9%;茎器官粉末对胚根生长的影响较小,而对胚轴在0.01~0.1 g/L浓度下显示了5.1%~13.7%的刺激生长活性;叶器官粉末对胚根的生长在0.005~0.05 g/L的低浓度下表现为刺激生长活性,且随浓度的增大活性降低,当浓度提高至 0.1 g/L 以上时则表现为抑制活性,在0.5 g/L浓度下抑制率达42.5%。对胚轴的生长除了0.1 g/L浓度下显示出轻微的抑制生长外,其余均为刺激活性,且在 0.005 g/L 的浓度下刺激生长活性最大,达36.7%。
2.1.3 反枝苋 根器官粉末对生菜胚根和胚轴生长的影响相对较小,且未能随浓度的增加而有规律的变化;茎器官粉末在5个处理浓度下均表现为刺激生长活性,且在0.05 g/L浓度下的活性最高,刺激生长率分别达24.1%和19.9%;叶器官粉末对胚根和胚轴生长的影响也以刺激生长为主,只在 0.5 g/L 的高浓度下显示了轻微的抑制活性。
2.1.4 狼尾草 根器官粉末对生菜胚根和胚轴生长的影响除了在0.5 g/L浓度下显示出26.6%和21.1%的抑制活性外,其余各浓度下的影响均较小;茎器官粉末在低浓度下则对二者的生长均表现为一定的刺激生长活性,且浓度越低,该活性越高,在0.005 g/L浓度下的刺激生长率分别达7.6%和21.7%。但在0.5 g/L的高浓度下,对二者均表现为抑制活性,抑制率分别为57.6%和10.1%;叶器官粉末对胚根的生长均表现为抑制活性,但抑制率相对较低,最高只有21.4%。对胚轴的生长在低浓度下均为刺激作用,0.005 g/L浓度下的刺激生长率达16.7%。
2.1.5 马齿苋 根器官粉末对生菜胚根和胚轴生长的影响轻微,但茎和叶器官则表现出较强的刺激生长活性,特别是茎器官5个浓度处理下对二者的刺激生长率分别达27.6%~56.6%和26.3%~59.5%,且低浓度下的活性相对较高;叶器官在0.005 g/L的低浓度处理下对二者的刺激生长活性虽然低于茎器官,但也分别达到21.1%和25.8%。
2.1.6 山苦菜 其根茎叶花4种器官在0.5 g/L浓度下对生菜胚根和胚轴的生长均显示出一定的抑制活性,其中对胚根的抑制活性最高达43.6%,其余各浓度下对二者的影响均较小,且大多表现为一定的刺激生长作用。
2.1.7 葎草 花和茎器官粉末对生菜胚根和胚轴生长的影响均较小,而叶器官粉末对胚轴的生长在5个供试浓度下均显示出明显的刺激生长活性,刺激率达11.2%~27.7%,而对胚根的生长在0.005~0.1 g/L的浓度处理下表现为轻微的刺激作用,在0.5 g/L的浓度下则表现为28.6%的抑制活性。
2.2 彩叶草、马唐和三叶草茎叶对生菜幼苗生长的影响
表2为彩叶草、马唐和三叶草茎叶对生菜幼苗生长的影响。其中,彩叶草除了茎器官粉末对生菜胚根的生长在供试浓度下表现出4.5%~17.6%的刺激生长活性和叶器官粉末在0.5 g/L的浓度下对胚根生长表现出34.9%的抑制生长活性外,其余浓度下茎粉末对胚轴、叶粉末对胚根和胚轴生长的影响都很小;马唐茎和叶器官粉末对生菜胚根和胚轴生长的影响均不大;三叶草茎器官粉末对生菜胚根和胚轴生长的影响除了在0.5 g/L浓度下显示出34.9%的较高抑制活性和4.79%的轻微刺激生长活性外,其余各浓度处理均表现出一定的刺激生长活性,且对胚轴的刺激活性达13.1%~22.3%,明显高于对胚根的活性。叶器官粉末在低浓度下则对二者的生长均表现为一定的刺激生长活性,只在 0.5 g/L 的高浓度下,才表现为抑制活性,抑制率分别为34.7%和10.0%。
2.3 牛筋草、刺儿菜、泥胡菜和播娘蒿根叶对生菜幼苗生长的影响
表3为牛筋草、刺儿菜、泥胡菜和播娘蒿根叶对生菜幼苗生长的影响。其中,牛筋草根和叶器官粉末在0.005~0.05 g/L浓度下,对生菜胚根的生长均显示出一定的刺激生长作用,且在0.5 g/L时叶对胚根产生了40.3%的抑制作用。而其他浓度下,根和叶的影响均较小;刺儿菜根和叶器官粉末除叶在0.5 g/L的浓度下对生菜胚根生长表现出48.2%的抑制活性外,其余浓度的影响均较小;泥胡菜根器官除0.05 g/L以上浓度对生菜胚根的生长显示出13.8%~40.6%的抑制活性外,其余浓度对胚根和胚轴的生长影响均较小,且在低浓度下表现为轻微的刺激生长活性。叶器官粉末在0.005~0.5 g/L供试浓度下对胚轴的生长均显示出一定的刺激生长活性,而对胚根的生长影响较小;而播娘蒿叶和根器官粉末对生菜胚根和胚轴生长的影响除了0.5 g/L的高浓度具有一定的抑制活性外,其余均相对较小。

表2 彩叶草、马唐和三叶草茎叶对生菜幼苗生长的影响Table 2 Effects of shoots and leaves of Coleus blumei,Digitaria sanguinalis and Trifolium repens on the growth of lettuce seedlings
2.4 鹅绒藤、圆叶牵牛和麦冬叶对生菜幼苗生长的影响
表4为鹅绒藤、圆叶牵牛和麦冬三种植物叶片粉末对生菜幼苗生长的影响。可见,鹅绒藤叶片粉末除了在0.1 g/L和0.5 g/L高浓度对胚根的生长显示出19.5%和64.4%的抑制活性外,0.05 g/L以下浓度时的影响轻微。而对胚轴的生长除0.005 g/L 浓度不明显外,其余均表现为较强的刺激生长活性,刺激生长率达8.4%~35.0%;圆叶牵牛叶0.005~0.1 g/L浓度对胚根的生长均表现为一定的刺激生长作用,刺激生长率为2.3%~16.9%,当浓度提高至0.5 g/L时则显示出29.9%的抑制活性。该植物器官在所有供试浓度下对胚轴生长的影响均很小;麦冬叶0.005 g/L和0.1 g/L浓度对胚根和胚轴的生长影响均很小,而随着浓度的提高抑制活性明显增加,在0.5 g/L时对二者的抑制率分别达95.9%和48.8%。
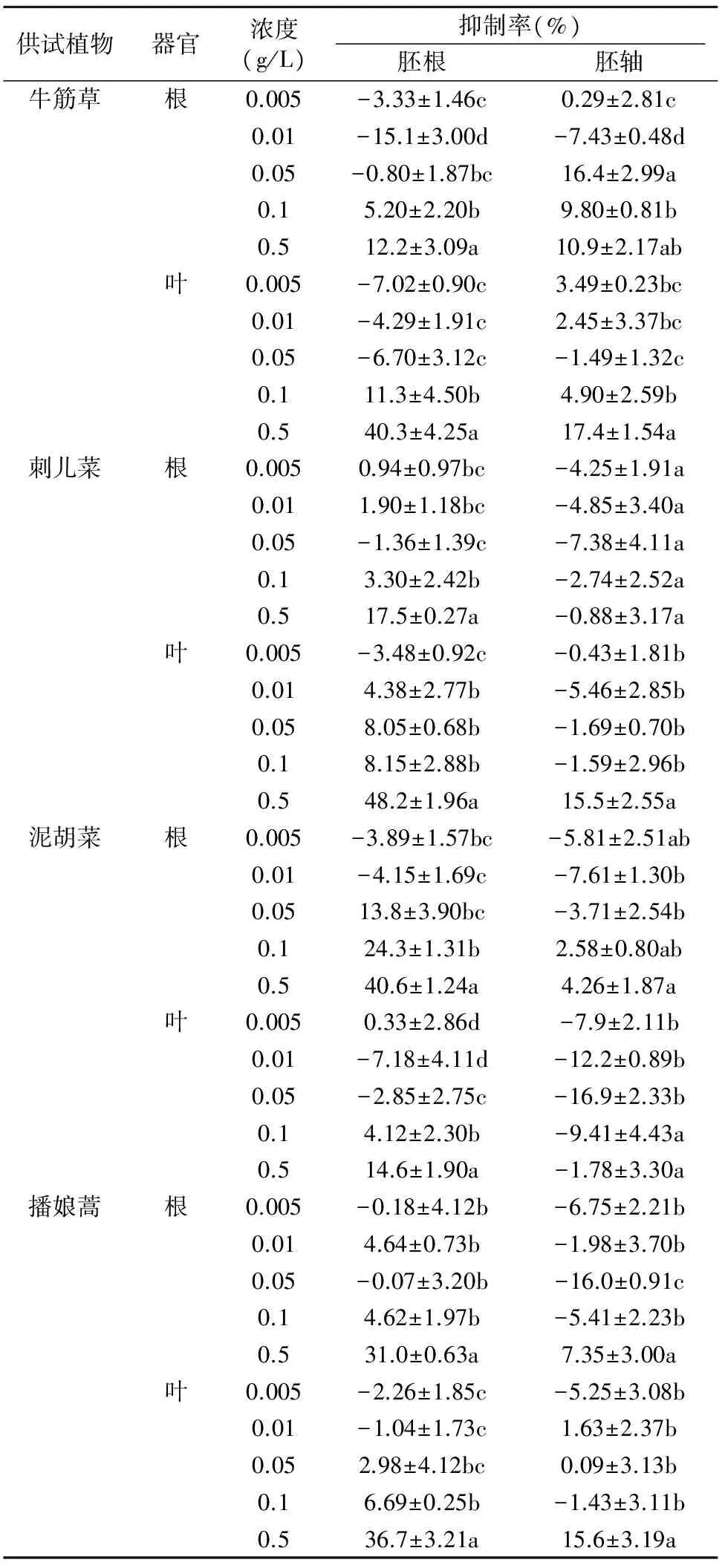
表3 牛筋草、刺儿菜、泥胡菜和播娘蒿根叶对生菜幼苗生长的影响Table 3 Effects of roots and leaves of Eleusine indica,Cirsium segetum,Hemistepta lyrata and Descurainia sophia on the growth of lettuce seedlings
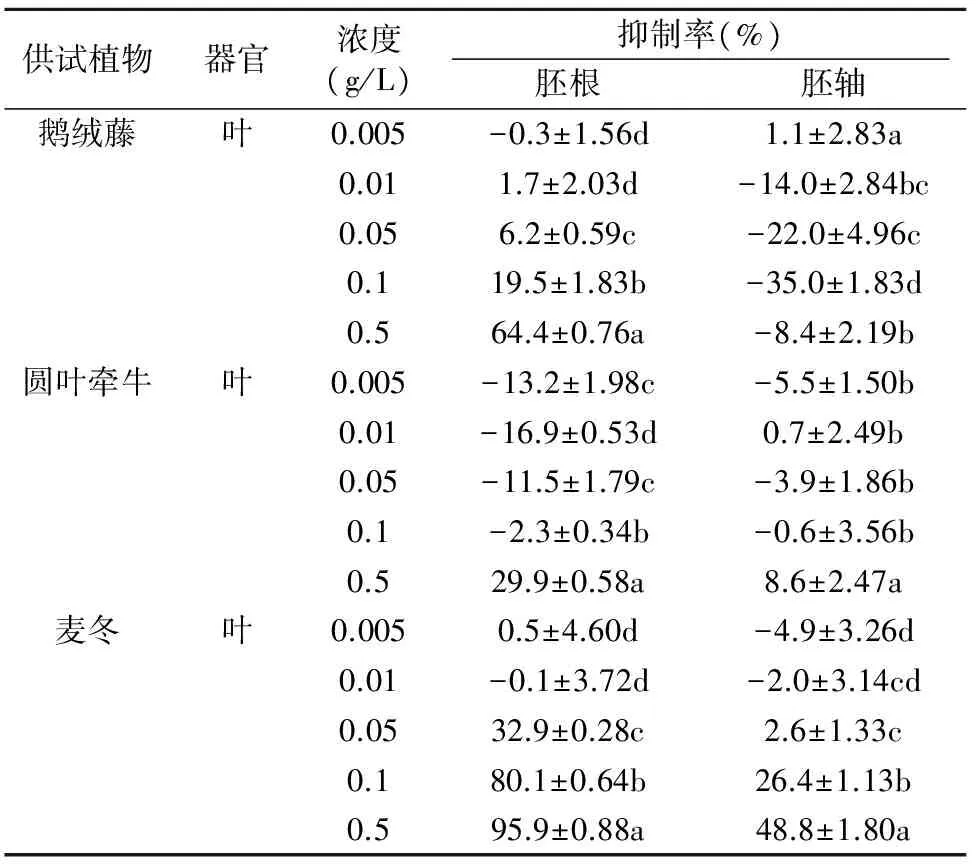
表4 鹅绒藤、圆叶牵牛和麦冬叶对生菜幼苗生长的影响Table 3 Effects of leaves of Cynanchum chinense,Pharbitis purpureaand Ophitopogin japonicum on the growth of lettuce seedlings
3 结论与讨论
不同的植物器官在不同处理浓度下对受体植物生菜幼苗生长的影响差异较大,其中,0.005~0.5 g/L 供试浓度对其胚根和胚轴的生长均表现出高刺激活性的有马齿苋的茎,表现出较高刺激活性的有艾蒿的叶、反枝苋的茎以及马齿苋的叶;在0.005~0.1 g/L供试浓度下对二者均有较高刺激生长活性的有反枝苋和马齿苋的叶以及三叶草的茎;藜的根分别在0.005~0.01 g/L和0.01~0.5 g/L浓度下对胚根和胚轴显示出较高的刺激生长活性。此外,圆叶牵牛的叶对胚根的生长以及鹅绒藤叶、葎草叶和狼尾草的茎对胚轴的生长也都表现出较强的刺激生长活性。而麦冬的茎叶在0.1~0.5 g/L的高浓度下对二者均有很高的抑制活性。这些结果为进一步开展活性化合物分离及其应用研究提供了依据。首先,一些植物器官对胚根的高刺激生长活性显示,这些器官中所含有的物质可能具有调节植物生长的作用,而且通过对根系生长的促进作用,扩大受体植物根系的数量及长度,有利于提高植物对土壤水分的利用效率,达到抗旱的目的。许多研究表明,植物的抗旱性与其根长、根粗及根干重呈正相关[17]。其次,对胚根和胚轴生长的同时刺激作用,一方面说明其中所含有的活性物质具有较强的内吸传导性,因为,本研究方法中只有胚根与含粉基质相接触,另一方面证明了该活性物质可同时作用于根和茎的生长点,有利于植物整体的生长发育。有研究表明,果园内适度的杂草生长反而有利于苹果等果树的生长和产量的提高[18],可能与这些杂草体内所含有的刺激生长活性物质有关。
[1]Rice E L. Allelopathy[M]. New York:Academic Press,1974.
[2]孔垂华,胡 飞. 植物化感作用及其应用[M]. 北京:中国农业出版社,2001.
[3]Aldrich R J . 化感作用与杂草治理[J]. 马晓渊,摘译. 杂草科学,2011,39(4):63-66.
[4]杨田甜,杜海荣,陈 刚,等. 植物化感作用的研究现状及其在农业生产中的应用[J]. 浙江农业学报,2012,24(2):343-348.
[5]刘 杰,罗小勇. 石楠不同器官除草活性的研究[J]. 安徽农业大学学报,2010,37(2):204-208.
[6]王 霞,罗小勇. 海桐不同器官除草活性的研究[J]. 中国生态农业学报,2011,19(4):982-984.
[7]罗小勇. 碧桃不同器官的除草活性研究[J]. 江西农业学报,2011,23(2):93-95.
[8]罗小勇. 牡丹不同器官的除草活性研究[J]. 植物保护,2011,37(2):87-90.
[9]张媛媛,罗小勇. 菊科植物对吡氟禾草灵的敏感性差异及其机理研究[J]. 植物保护学报,2010,37(6):557-561.
[10]罗小勇. 菊花桃不同器官的除草活性研究[J]. 中国农学通报,2010,26(14):269-272.
[11]罗小勇. 紫丁香不同器官的除草活性研究[J]. 农药,2010,49(6):460-461,464.
[12]罗小勇. 八重樱不同器官的除草活性研究[J]. 杂草科学,2010(2):27-29.
[13]罗小勇,张英杰. 芍药不同器官的除草活性研究[J]. 中国农业生态学报,2010,18(5):1148-1150.
[14]刘 杰,罗小勇. 石楠不同器官的除草活性研究[J]. 安徽农业大学学报,2010,37(2):204-208.
[15]万方浩,谢丙炎,杨国庆,等. 入侵生物学[M]. 北京:科学出版社,2011.
[16]张重义,谢小波,王 毅,等. 烟草化感自毒作用与其连作障碍研究的启示[J]. 中国烟草学报,2011,17(4):88-92.
[16]罗小勇,付艳红,周世军. 琼脂混粉法的建立及其在植物化感活性测定中的应用[J]. 青岛农业大学学报,2007,24(4):267-270.
[17]梁银丽,杨翠玲. 不同抗旱型小麦根系形态与生理特性对渗透胁迫的反应[J]. 西北农业学报,1995,4(4):31-36.
[18]刘金柱. 果园覆草综合效益研究[J]. 河北果树,2007,(4):13-16.
EffectsofDriedPowderofDifferentOrganof17SpeciesofHerbaceousPlantsonLettuceSeedlingsGrowth
YANG Yu-liang1, SONG Ji-qing2, Yang Cong-jun1, LUO Xiao-yong1
(1. College of Agronomy and Plant Protection, Qingdao Agricultural University/Key Lab of Integrated Crop Pest Management of Shandong Province,Qingdao 266109,China;2. Institute of Environment and Sustainable Development in Agriculture, Chinese Academy of Agricultural Science/Key and Open Laboratory of Agro-Enviroment & Climate Change,Ministry of Agriculture/Key Laboratory of Dryland Farming and Water-Saving Agriculture,Ministry of Agriculture,Beijing 100081,China)
Effects of different organ of 17 species of herbaceous plants on seedling growth of the receptor plant lettuce were tested under testing concentration of 0.005~0.5g/L by using PPA method. The results showed that all of the organs of all of the plants tested demonstrated different degrees of inhibitory or stimulatory activities on radicles and hypocotyls growth of lettuce,among them the stems and leaves ofPortulacaoleracea,the stems ofAmaranthusretroflexus,the leaves ofHumulusscandens,and the stems ofPennisetumalopecuroidesall presented relatively high stimulatory activity,but the other plant organs showed relatively lower stimulatory activity or showed certain inhibitory activity on lettuce seedling growth.
herbaceous plants;allelopathic effect;activity;PPA method;lettuce
Q948.12+2.1
A
1003-935X(2012)04-0010-06
2012-10-09
“十二五”农村领域国家科技计划项目子课题(编号:2011AA100503);山东省“泰山学者”建设工程专项经费。
杨玉良(1986—),男,硕士研究生,从事植物源除草活性物质研究。E-mail:415439226@qq.com。
罗小勇,博士,副教授,从事除草剂毒理及植物源除草活性物质研究。E-mail:luo-xiaoyong@163.com。
