椎间盘源性腰痛神经传入通路的实验研究
2012-11-04高春华庞晓东李端明刘春雨彭宝淦
李 茂,高春华,庞晓东,杨 洪,李端明,刘春雨,彭宝淦
腰痛是困扰人类常见的疾病之一,70%~90%的人群在一生中的某些时候会发生不同程度的腰痛,在所有到医院就诊的患者中腰痛占第2 位,仅次于上呼吸道感染[1],给社会和家庭带来巨大的心理负担与经济负担。关于腰痛的确切病因尚不明确,1947年有学者提出腰痛与椎间盘退变有关,而椎间盘退变是一非常复杂的生物学过程,受年龄、环境、生物力学、遗传学等多种因素的影响[2-5]。目前对腰腿痛的致病机理比较明确的是:纤维环破裂后,由外向内组织修复的过程中,伴随肉芽组织的长入,产生大量炎性介质,这些炎性介质刺激髓核内部的疼痛感受器使其阈值降低,或通过破裂的椎间盘裂隙漏出,刺激纤维环外部的神经末梢,在轻微压力下即可导致腰痛[6]。目前,已知的细胞因子有100 多种,其中白细胞介素-1β(interleukin-1β,IL-1β)是细胞外IL-1 的主要亚型。研究发现经IL-1β 刺激后脊神经背根节敏感性明显上升[7-8]。椎间盘内部结构的一系列变化是形成腰痛的物质基础,研究炎症反应在腰痛发生、发展过程中的作用,找到炎症信号在痛觉传导通路中的关键环节,从而对炎症信号在传导过程中进行干扰,可能是目前治疗腰痛最理想的方法[9-12]。神经电生理技术作为神经疾病诊断的三大技术之一[13],其作用主要是对神经纤维损害的范围、程度提供可靠的诊断依据。本实验用神经电生理学监测技术,通过椎间盘内注入外源性炎性因子IL-1β,分别应用选择性切断L3及L5交感干的方法,对不同节段交感神经在大鼠L5/L6椎间盘痛觉传导通路中的作用进行研究。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
本次实验以20 只成年健康雄性Wistar 大鼠(北京科宇动物养殖中心提供)为实验对象,体重为240~260 g,随机平均分为2组。
1.2 实验方法
1.2.1 预实验
从纳入实验的雄性Wistar 大鼠中随机选取1 只在显微镜下进行腰椎神经走行及分布的解剖,为进一步实验做准备。在解剖矢状面上,Wistar 大鼠腰椎有6 个椎体,其胸椎与腰椎共同形成凸向后的生理弧度;整体来看,大鼠的腰椎结构与人类的腰椎结构很相似,也是由腹侧的椎体和背侧的神经弓组成,在直视状态下,大鼠神经节比人类神经节更明显,给予基础性电刺激,可诱发出动作电位。
1.2.2 实验
据实验目的将大鼠随机分为2组,10 只切断双侧L3交感干,10 只切断双侧L5交感干,皆为自身对照,以切断前作为对照数据。采用腹腔注射0.6%戊巴比妥钠(60 mg/kg)对大鼠进行麻醉后,气管插管防止窒息,俯卧位于手术台上,无菌条件下沿腰正中线切开,暴露L1~6腰椎,用咬骨钳将L1~6腰椎棘突及椎板去除,用神经探针钝性显露脊神经节,沿脊神经向两侧充分游离,暴露交感链,立体定位仪固定后,将L1~5脊神经节靠近中枢端悬挂于双极铂金丝记录电极上,拉起皮瓣,用37℃左右的液体石蜡油充于油槽以防干燥,接地电极均置于皮下,固定于刺激电极和记录电极之间。刺激参数:采用单个方波电刺激方式(延迟10 ms,持续时间1 ms),从小到大调整隔离器的旋钮,当诱发电位出现并稳定后,打开微量注射泵向L5/L6椎间盘后侧注射IL-1β,浓度为0.5 μg/μL,速度为0.5 μL/s。用双极铂金丝电极记录两侧L1~5脊神经节动作电位的幅度和潜伏期,分别选择性切断L3及L5交感干后,观察切断前后L1~5脊神经节动作电位幅度和潜伏期的变化。
1.3 统计学处理
运用SPSS 11.5 统计学软件包,分别把相同部位L1~5脊神经节的动作电位幅度、潜伏期(两侧取平均值),按照双侧L3交感干切断组与切断前自身对照相比,双侧L5交感干切断组与切断前自身对照相比,进行成组设计t 检验,α 值取0.05。
2 结 果
2.1 切断双侧L3交感干后对脊神经动作电位的影响
当诱发电位出现并稳定后,打开微量注射泵向L5/L6椎间盘后侧注射IL-1β,浓度为0.5 μg/L,速度为0.5 μL/s,用双极铂金丝电极分别记录L1~5脊神经节动作电位的幅度和潜伏期,切断双侧L3交感干后发现L1,2脊神经节动作电位的幅度减弱(见表1),潜伏期延长(见表2)。
2.2 切断双侧L5交感干后对脊神经动作电位的影响
引出电位并稳定后,于L5/L6椎间盘后侧给药,药物浓度及速度同上,同样的方法,用双极铂金丝电极分别记录L1~5脊神经节动作电位的幅度和潜伏期,切断双侧L5交感干后发现L1~4脊神经动作电位的幅度减弱(见表3),潜伏期延长(见表4)。
2.3 统计学分析
双侧L3交感干切断后与切断前相比,相同部位L1,2脊神经节的动作电位幅度、潜伏期,差异有统计学意义(P<0.05)。双侧L5交感干切断后与切断前相比,相同部位L1~4脊神经节的动作电位幅度、潜伏期,差异有统计学意义(P<0.05)。

表1 L1~5脊神经节动作电位幅度Tab.1 Action potential amplitudes of L1-5nerve roots
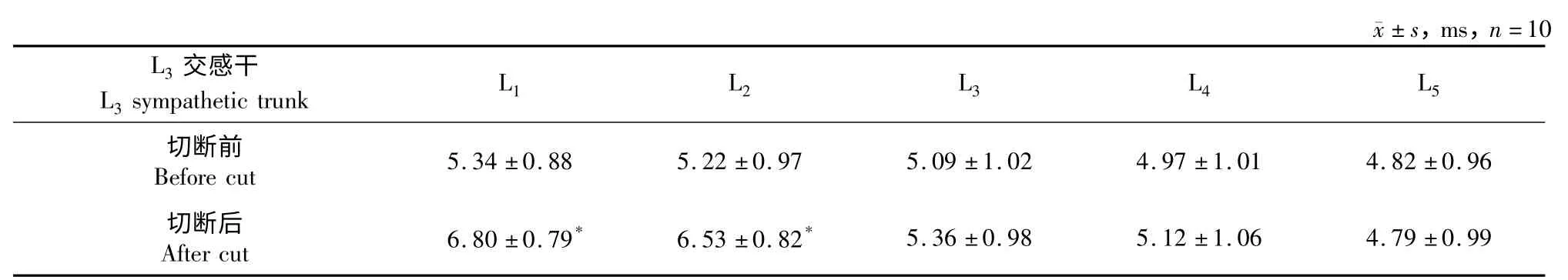
表2 L1~5脊神经节动作电位潜伏期Tab.2 Latent period of active potential of L1-5spinal ganglion

表3 L1~5脊神经节动作电位幅度Tab.3 Action potential amplitudes of L1-5spinal ganglion

表4 L1~5脊神经节动作电位潜伏期Tab.4 Latent period of active potential of L1-5spinal ganglion
3 讨 论
目前由椎间盘内部结构改变所引起的腰痛越来越受到学者们重视。其病理机制比较明确的是正常椎间盘纤维环外层分布有大量纤细的神经纤维,直径1~3 μm,纤维环破裂后,在椎间盘由外向内损伤修复的过程中,神经纤维可随着肉芽组织长入到椎间盘深层,并出现炎症反应,产生多种细胞因子和炎症介质,如IL、NO、P 物质等,这些炎性细胞因子刺激髓核内部的疼痛感受器使其阈值降低,或通过破裂的椎间盘裂隙漏出,刺激纤维环外部的神经末梢,轻微的压力下就可引发腰痛[6]。Takebayashi 等[14]用实验的方法切断大鼠L2脊神经前、后支,仅保留通过交通支和椎旁交感干相联系的L2脊神经,给予机械刺激很难诱发出动作电位,但向L5/L6椎间盘内注射角叉藻聚糖后,轻微的机械刺激就可诱发L2脊神经动作电位,这说明正常椎间盘的疼痛感受器具有较高的阈值,机械刺激不易诱发疼痛,而炎症介质使神经兴奋性升高,疼痛感受器阈值降低,从而对机械刺激更加敏感。目前IL-1β、NO、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)是椎间盘退变中研究较多的细胞因子。其中IL-1β 是一种强力的致痛性细胞因子,为细胞外IL-1 的主要亚型,研究发现经IL-1β 刺激后的脊神经背根节其敏感性明显上升,这可能与椎间盘退变所导致的腰痛、坐骨神经痛有关[7]。
自1850年Luschka 报告窦椎神经后,学者们一致认为病变椎间盘的痛觉信息由窦椎神经传递至相应背根神经节。Imai 等[15]用免疫学方法研究指出,腰椎椎间盘后方相邻节段的窦椎神经在后纵韧带和纤维环外层交织成网状,形成多节段神经分布。Nakamura 等[16]用乙酰胆碱酯酶组织化学方法检测椎间盘后方的神经分布情况,结果显示双侧单节段或单侧多节段交感干切除的大鼠,椎间盘后方的神经分布略有减少,只有双侧多节段切断交感神经的大鼠,后方的神经分布才接近消失,这表明交感神经与椎间盘后方的神经呈双侧、多节段联系。椎间盘源性腰痛常伴有腹股沟区疼痛,而腹股沟区皮肤由L2脊神经发出的生殖股神经支配,这不能用神经根的节段性支配来解释。Nakamura 等[17]对32例椎间盘源性下腰痛患者进行L2脊神经根药物封闭治疗后,除9例下肢有放射痛患者外,其余患者腰痛症状明显减轻或消失,研究推测,L2神经根可能是椎间盘源性下腰痛神经传导通路的主要传入神经。大鼠L5/L6椎间盘的神经纤维由高位L2神经元支配。Morinaga 等[18]将辣根过氧化物酶置于大鼠L5/L6椎间盘前方,3 d 后检查示踪剂在背根节神经元中的分布后发现,仅L1,2的脊神经节内出现示踪剂,而其他的神经节中没有出现,这说明L5/L6椎间盘前侧的神经纤维由高位神经元支配。Suseki 等[19]研究发现,腰椎椎间盘周围存在交感神经节后纤维和感觉纤维多种分布,但椎间盘后方的感觉纤维由窦椎神经进入交通支,而不进入同节段的脊神经。因此,L2交通支和L5交通支在L5/L6椎间盘痛觉传导通路中的作用不一样。越来越多的研究发现,交感神经在椎间盘源性痛觉传导通路中存在不同的支配方式。Ohtori等[20]应用荧光金逆行示踪发现大鼠L5/L6椎间盘后方存在2 种神经支配形式:①椎间盘后方及后纵韧带的痛觉信息由窦椎神经传递至L3~6脊神经节,呈节段性支配模式;②痛觉信息由L5/L6交感神经交通支传递至交感干继而上行通过L1或L2交感神经交通支传递至T13~L2脊神经节,呈多节段支配模式。
本实验用神经电生理学监测技术,通过椎间盘内注入外源性炎性因子IL-1β,分别应用选择性切断L3及L5交感干的方法,监测切断前后L1~5脊神经节动作电位的幅度和潜伏期。结果发现,双侧L3交感干切断后与切断前相比,切断后相同部位L1,2脊神经节的动作电位幅度减弱、潜伏期延长,而L3~5脊神经节动作电位的幅度和潜伏期无明显变化。这说明大鼠L5/L6椎间盘至下腰椎脊神经节的传导通路与L3交感干无关,而至上腰椎脊神经节的传导通路与L3交感干有关。双侧L5交感干切断后与切断前相比,切断后相同部位L1~4脊神经节的动作电位幅度减弱、潜伏期延长,而并未完全消失,结果说明交感神经只是腰椎椎间盘神经传导通路中的一部分,可能还存在其他的神经传导通路。无论双侧L3交感干切断后与切断前相比,还是双侧L5交感干切断后与切断前,都存在L1,2脊神经节动作电位的幅度减弱、潜伏期延长。这说明L3~5交感干是L5/L6椎间盘痛觉信息至L1,2脊神经节的主要传导通路。
实验结果表明,L1,2脊神经节内部分神经细胞不仅参与同节段腰神经后支的组成,而且参与了腰椎旁交感干的组成纤维,且可传递痛觉信息,故可解释为什么下位腰椎椎间盘病变能影响上位腰神经后支支配区域疼痛的原因。结合许多研究资料和本实验得出,椎间盘源性腰痛可以说是一种下腰椎椎间盘病变影响上位腰神经支配区域的放射性疼痛。具体地说,病变椎间盘产生的痛觉信号由椎旁的交感神经传至L1~3脊神经节,之后沿感觉神经末梢传向中枢系统,产生相关区域疼痛。这可以解释为什么对椎间盘源性下腰痛患者进行亚甲蓝等神经失活剂治疗后,疼痛会明显消失或缓解。详细研究椎间盘源性腰痛的神经传导通路,从而对其中的某个环节进行干预对治疗下腰痛有重要意义。
本研究结果表明:交感干在腰椎椎间盘痛觉传导通路中起重要的作用。L3交感干和L5交感干在L5/L6椎间盘痛觉传导通路中的作用不同。L5交感干在L5/L6椎间盘至L1,2脊神经节的痛觉传导通路中起重要作用。L5/L6椎间盘后侧至上腰椎的传导通路与L3交感干有关,而至下腰椎的痛觉传导通路与L3交感干无关。
[1]Andersson GB.Epidemiological features of chronic low-back pain[J].Lancet,1999,354(9178):581-585.
[2]Mashayekhi F,Shafiee G,Kazemi M,et al.Lumbar disk degeneration disease and aggrecan gene polymorphism in northern Iran[J].Biochem Genet,2010,48(7-8):684-689.
[3]Eser B,Cora T,Eser O,et al.Association of the polymorphisms of vitamin D receptor and aggrecan genes with degenerative disc disease[J].Genet Test Mol Biomarkers,2010,14(3):313-317.
[4]Guehring T,Nerlich A,Kroeber M,et al.Sensitivity of notochordal disc cells to mechanical loading:an experimental animal study[J].Eur Spine J,2010,19(1):113-121.
[5]Zhang Y,Kerns JM,Anderson DG,et al.Sensory neurons and fibers from multiple spinal cord levels innervate the rabbit lumbar disc[J].Am J Phys Med Rehabil,2006,85(11):865-871.
[6]Peng B.Issues concerning the biological repair of intervertebral disc degeneration[J].Nat Clin Pract Rheumatol,2008,4(5):226-227.
[7]Ozaktay AC,Cavanaugh JM,Asik I,et al.Dorsal root sensitivity to interleukin-1 beta,interleukin-6 and tumor necrosis factor in rats[J].Eur Spine J,2002,11(5):467-475.
[8]Le Maitre CL,Hoyland JA,Freemont AJ.Catabolic cytokine expressio n in degenerate and herniated human intervertebral discs:IL-1beta and TNFalpha expression profile[J].Arthritis Res Ther,2007,9(4):R77.
[9]Peng B,Pang X,Wu Y,et al.A randomized placebo-controlled trial of intradiscal methylene blue injection for the treatment of chronic discogenic low back pain[J].Pain,2010,149(1):124-129.
[10]Yamada H,Honda T,Yaginuma H,et al.Comparison of sensory and sympathetic innervation of the dura mater and posterior longitudinal ligament in the cervical spine after removal of the stellate ganglion[J].J Comp Neurol,2001,434(1):86-100.
[11]Aoki Y,Takahashi Y,Ohtori S,et al.Distribution and immuno-cytochemical characterization of dorsal root ganglion neurons innervating the lumbar intervertebral disc in rats:a review[J].Life Sci,2004,74(21):2627-2642.
[12]Groen GJ,Baljet B,Drukker J.Nerves and nerve plexuses of the human vertebral column[J].Am J Anat,1990,188(3):282-296.
[13]卢祖能,曾庆杏,李承晏.实用肌电图学[M].北京:人民卫生出版社,2000:187-573.
[14]Takebayashi T,Cavanaugh JM,Kallakuri S,et al.Sympathetic afferent units from lumbar intervertebral discs[J].J Bone Joint Surg Br,2006,88(4):554-557.
[15]Imai S,Hukuda S,Maeda T.Dually innervating nociceptive networks in the rat lumbar posterior longitudinal ligaments[J].Spine(Phila Pa 1976),1995,20(19):2086-2092.
[16]Nakamura S,Takahashi K,Takahashi Y,et al.Origin of nerves supplying the posterior portion of lumbar intervertebral discs in rats[J].Spine(Phila Pa 1976),1996,21(8):917-924.
[17]Nakamura SI,Takahashi K,Takahashi Y,et al.The afferent pathways of discogenic low-back pain.Evaluation of L2 spinal nerve infiltration[J].J Bone Joint Surg Br,1996,78(4):606-612.
[18]Morinaga T,Takahashi K,Yamagata M,et al.Sensory innervation to the anterior portion of lumbar intervertebral disc[J].Spine(Phila Pa 1976),1996,21(16):1848-1851.
[19]Suseki K,Takahashi Y,Takahashi K,et al.Sensory nerve fibres from lumbar intervertebral discs pass through rami communicantes.A possible pathway for discogenic low back pain[J].J Bone Joint Surg Br,1998,80(4):737-742.
[20]Ohtori S,Takahashi Y,Takahashi K,et al.Sensory innervation of the dorsal portion of the lumbar intervertebral disc in rats[J].Spine(Phila Pa 1976),1999,24(22):2295-2299.