ITO电极上催化伏安法测定锇联吡啶的研究
2012-11-02邹蕊
邹 蕊
(宁夏师范学院 化学与化学工程学院,宁夏 固原 756000)
电化学生物传感器以其灵敏度高、选择性好、响应速度快、操作简便等特点,在分析化学的研究中发挥着越来越重要的作用。构建电流型生物传感器时,通常将电化学标记物(信号产生物质)连接到生物分子上,通过电化学标记物产生的电化学信号来测定生物分子的含量。电化学标记物比较多,如亚甲基绿,亚甲基蓝,二茂铁及其衍生物[1-8]。其中二茂铁及其衍生物是使用最为广泛,但二茂铁离子的氧化态,水溶性比较差,二茂铁复合物在水溶液中稳定性差,因此,成为制备二茂铁电化学传感器所面临的最大问题。近几年里,第八族金属(铁,钌,锇)元素的复合物在构建分子器件方面的研究越来越多,比如增强型生物传感器[9-15]就是建立在这些复合物的氧化还原及发光特性上。这些复合物均表现出较大的均相反应速率常数和较低的氧化还原电位[16,17]。但由于锇联吡啶、钌联吡啶等制备成本高,分离困难,因此鲜有报道。另外,大部分过渡金属复合物都能够在ITO电极上产生良好的电化学响应,但有机酸却没有响应,因此,选用ITO电极作为工作电极,研究过渡金属复合物的电化学响应,能够避免有机酸的响应,降低了背景[5]。本文合成了锇联吡啶Os(bpy)3,选用ITO电极作为工作电极来研究锇联吡啶Os(bpy)3的电化学行为,并测定了锇联吡啶在葡萄糖,葡萄糖氧化酶体系中的催化反应动力学,测定了Os(bpy)3的均相反应速率常数KS,以及在催化反应中一级反应速率常数Kf,二级反应速率常数Kmed。
1 实验部分
1.1 试剂和仪器
六氯锇酸钾(K2OsCl6)购于比利时Acros Organics公司,2,2’联吡啶(C10H8N2)购于成都科龙化工试剂,葡萄糖氧化酶(Glucose oxidase,简称GOD,)购于Sigma公司,葡萄糖(C6H12O6)购于西安化学试剂厂。0.10 mol/L 磷酸盐缓冲溶液 (pH 7.40,0.10 mol/L NaH2PO4/Na2HPO4+0.10 mol/L NaCl,PBS)。其它试剂均为分析纯,实验所用溶液均用超纯水(Milli-Q ultrapure 18.2 MΩ/cm)配制。
电化学系统为CHI660B电化学工作站(上海辰华公司)。电极为三电极系统,工作电极为ITO电极,对极为铂丝电极,参比电极为Ag/AgCl(饱和KCl)电极。
ITO电极购于深圳南玻玻璃有限公司,使用时裁为2×100 mm的长条状,在导电一侧用蜡封,一端露出4×2 mm作为工作电极,使用前用乙醇,丙酮清洗,氮气吹干。
1.2 Os(bpy)3的合成
K2OsCl6(0.01 mmol/L)溶解到1.0 mL 乙醇和水的混合液中(乙醇0.6 mL,水0.4 mL),2,2'-bpy(0.12 mmol/L)加入到上述溶液中。将混合溶液在水浴中加热3 h,冷却到室温[18],使用时用PBS溶液稀释。
1.3 电化学测量
循环伏安测定时,扫速为0.010 ~0.10 V/s,施加电压范围为1~1000 mV,测试溶液为5 mL。催化测试底液中GOD浓度为0.01 mg/mL,葡萄糖的浓度为0.1 mol/L。
微分脉冲伏安法测定时,施加电压范围为1-1000 mV,扫速为20 mV/s,采样宽度17 ms,脉冲幅度为50 mV。
所有的电化学测量均在室温条件下进行,以参比电极电位为标准。
2 结果与讨论
2.1 Os(bpy)3的电化学表征
图1为2 μmol/L Os(bpy)3溶液的循环伏安图,扫速为50 mV/s,施加电压范围为0-1000 mV。从图中可以看到,Os(bpy)3在ITO电极上,式电位E1/2为773 mv,氧化还原电位较低,与文献报道相同,因此实验中合成的就是Os(bpy)3。ΔEp=97,可逆性良好,为准可逆过程。此时,溶液中的电极反应为:

另外,在图2的循环伏安图中可以看出,在1~1000 mV的电压范围内,溶液中只有Os(bpy)3的氧化和还原峰,未经分离的容易中其他杂质都没有产生氧化还原,因此,未经分离的溶液能够用于Os(bpy)3电化学性能的研究。
图2为Os(bpy)3在0.01 mg/mL葡萄糖氧化酶与0.1 mol/L葡萄糖底液中的循环伏安图,曲线a为2 μmol/L Os(bpy)3的循环伏安图,曲线 b为 2 μmol/L Os(bpy)3在 0.01 mg/mL GOD 、0.10 mol/L葡萄糖中的循环伏安图。从图2中可以看出,Os(bpy)3加入葡萄糖氧化酶与葡萄糖底液之后,电流值明显升高,GOD与葡萄糖反应的产物FADH能够催化Os(bpy)3,产生催化电流,Os(bpy)3可以作为第二代葡萄糖电极的电子介体。此时的溶液中的电极反应为:
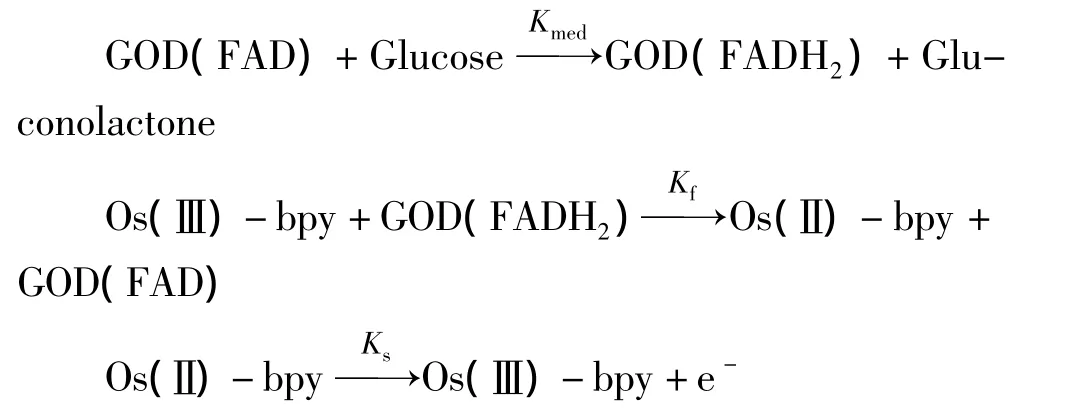
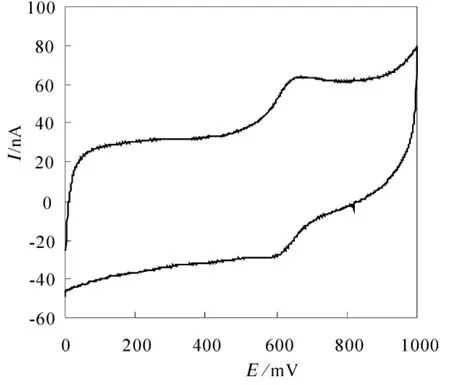
图1 Os(bpy)3在ITO电极上的循环伏安图
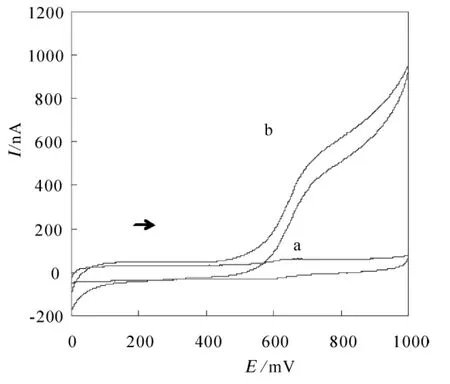
图2 Os(bpy)3在 0.01 mg/mLGOD,0.1 mol/L 葡萄糖中的循环伏安图
2.2 Os(bpy)3均相电子转移速率常数KS的测算
图3为2 μmol/L的 Os(bpy)3溶液分别在10,20,50,80,100,200 mV/s 扫速下的氧化峰电流对扫描速度的平方根作图的关系图,图3中可以看出,扫描速度的平方根与Os(bpy)3的氧化峰电流成正比,与单电子可逆氧化还原过程一致,由于其中电极面积A 为 0.08 cm2,浓度 c为 2 μmol/L,计算得 Os(bpy)3的扩散速率为D=3.9×10-6cm2/s。由于电子转移速率常数Ψ与扩散系数KS之间满足公式[19-21]:

当扫速为10 mV/s时,ΔEp=69 mV,Ψ =3,计算得出,Os(bpy)3的均相电子转移速率为Ks=2.07×10-2cm/s。
图3 2 μmol/L Os(bpy)3氧化峰电流与扫速关系图
2.3 催化过程中Kf与Kmed的测算
GOD与葡萄糖反应的产物能够催化Os(bpy)3,产生催化电流,因此,本文测定了ITO电极上在催化反应中一级反应速率常数 Kf,二级反应速率常数Kmed。在 2 μmol/L 的 Os(bpy)3与 0.01 mg/mLGOD中,分别以 10,20,50,80,100,150,200 mV/s的扫速,循环伏安法测定不同扫速下的Os(bpy)3的氧化扩散峰电流 Ⅰd。另外在 2 μmol/L 的 Os(bpy)3,0.01 mg/mL的GOD与0.1 mol/L的葡萄糖溶液中,分别以10,20,50,80,100,150,200 mV/s的扫速,循环伏安法测定不同扫速下的Os(bpy)3的催化氧化峰电流 Ⅰca。

通过不同扫描速度下测定的Ⅰd和Ⅰca值,计算Kf/a,然后Kf/a与相对应的扫描速度的倒数作图,图4为扫描速度的倒数与Kf/a的关系图:
扫描速度的倒数与Kf/a的关系满足于

计算可得,准一级反应速率常数 Kf=1.05×10-3s-1,由于 Kf=Kmed[GOD],二级反应速率常数Kmed=1.57 ×104L/(mol.s),与文献[18]报道的一致。因此,在ITO电极上,Os(bpy)3电子传输速度较快,是一种良好的电子介体。
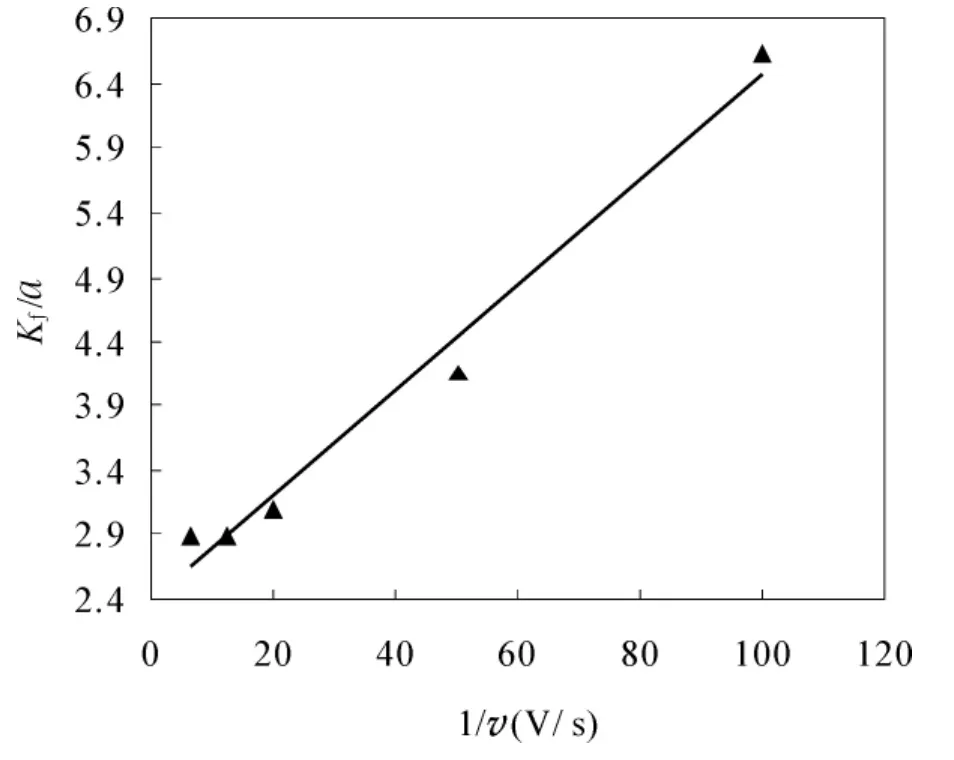
图4 Kf/a与扫描速度的倒数关系图
2.4 催化伏安法测定Os(bpy)3
为了将Os(bpy)3作为电化学标记物用于电化学生物传感器中,本文测定了催化伏安法测定Os(bpy)3的灵敏度。图5为不同浓度的Os(bpy)3微分脉冲伏安响应图,图6为Os(bpy)3浓度对催化电流的关系图,底液为 0.01 mg/mL的 GOD与0.1 mol/L的葡萄糖,扫速为10 mV/s,施加电压范围为0-1000 mV。
微分脉冲伏安法测定 Os(bpy)3,在底液为0.01 mg/mL的 GOD 与 0.10 mol/L 的葡萄糖时,Os(bpy)3的催化电流和 Os(bpy)3浓度在1×10-8mol/L~2.08×10-6mol/L范围之间呈现良好的线性关系,线性方程为 Ⅰca=140.35 c Os(bpy)3+15.233(c/μmol/L),r2=0.9823,方法检出限为 0.016 μmol/L。因此,在 ITO电极上,电子转移介体Os(bpy)3的灵敏度很高,能够满足一个良好电子介体的要求,能够用于电化学生物传感器的制备中。
3 结论
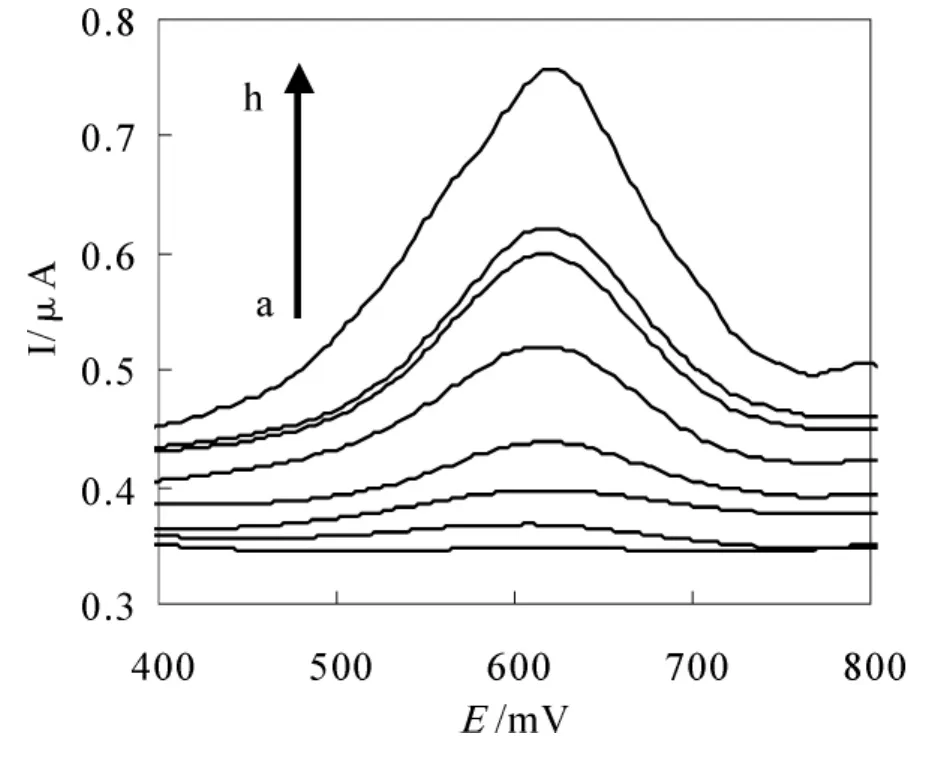
图5 不同浓度的Os(bpy)3在0.01 mg/mL的GOD与0.1 mol/L的葡萄糖底液中的微分脉冲伏安图

图6 Os(bpy)3浓度对催化电流的线性关系底液为0.1 mol/L的葡萄糖0.01 mg/mL的GOD
本研究中合成了电子转移介体Os(bpy)3,葡萄糖,葡萄糖氧化酶能够催化Os(bpy)3,产生催化电流。并研究了Os(bpy)3在ITO电极上的催化反应动力学,Os(bpy)3的均相反应速率常数KS为2.07 ×10-2cm/s,催化反应中一级反应速率常数Kf为1.05×10-3s-1,二级反应速率常数 Kmed为1.57 ×104L/(mol.s)。Os(bpy)3分子量小,水溶性好,在ITO电极表面能够进行可逆的电子转移,均相反应速率常数较大,氧化还原电位较低,吡啶基团能够很方便的与生物分子相连接,因而是一个优良的标记物用于生物传感器的构建中。本研究同时在ITO电极上测定Os(bpy)3的催化电流,检出限为0.016 μmol/L,灵敏度较高。所以将Os(bpy)3作为标记物能够用于生物传感器的构建中。
[1]Lim T K,Ohta H.Microfabricated on-chip-type electrochemical flow immunoassay system for the detection of histamine released in whole blood samples[J].Anal Chem,2003,75:3316 -3321.
[2]Dai J H,Baker G L.Use of porous membranes modified with polyelectrolyte multilayers as substrates for protein arrays with low nonspecific adsorption[J].Anal Chem,2006,78:135 -140.
[3]Padeste C,Grubelnik A,Tiefenauer L.Ferrocene – avidin conjugates for bioelectrochemical applications[J].Biosensors and Bioelectronics,2000,15:431 -438.
[4]Qiu J D,Deng M Q.Ferrocene- modified multiwalled carbon nanotubes as building block for construction of reagentless enzyme - based biosensor[J].Sensors and Actuators B,2008,135:181-187.
[5]Zheng D,Wang N.Reusable electrochemical sensing platform for highly sensitive detection of small molecules based on structure - switching signaling aptamers[J].Analytica Chimica Acta,2004,508:225 -231.
[6]Xu C,Cai H,He P G.Electrochemical detection of sequence-specific dna using a DNA probe labeled with aminoferrocene and chitosan modified electrode immobilized with ssDNA[J].Analyst,2001,126:62 -65.
[7]Yang M L,Liu C Z,et al.Study on the electrochemiluminescence behavior of ABEI and its application iin dna hybridization analysis[J].Analyst,2002,127:1267 -1271.
[8]Morris N A,Cardosi M F.An electrochemical capillary fill device for the analysis of glucose incorporating glucose oxidase and ruthenium(iii)hexamine as mediator[J].Electroanalysis,1992,4:1 -9.
[9]Ohara T J,Rajagopalan R.Glucose electrodes based on cross- linked bis(2,2'- bipyridine)chloroosmium(+/2+)complexed poly(1 - vinylimidazole)films[J].Anal Chem,1993,65:3512 -3517.
[10]Fraser D M,Zakeeruddin S M.Towards mediator design:II.Optimization of mediator global charge for the mediation of glucose oxidase of Aspergillus niger[J].Electroanal Chem,1993,359:125 -139.
[11]Ohara T J,Rajagopaian R."Wired"enzyme electrodes for amperometric determination of glucose or lactate in the presence of interfering substances[J].Anal Chem,1994,66:2451-2457.
[12]Motonaka J,Kamizasa M J.Micro - enzyme sensors with osmium complex as mediator for l- and d-amino acids[J].Electroanal Chem,1994,373:75 -81.
[13]Daigle F,Leech D.Reagentless tyrosinase enzyme electrodes:effects of enzyme loading,electrolyte ph,ionic strength,and temperature[J].Anal Chem,1997,69:4108 -4112.
[14]Danilowicz C,Cortón E,Battaglini F.Osmium complexes bearing functional groups:building blocks for integrated chemical systems[J].J Electroanal Chem,1998,445:89 -94.
[15]Kober E M,Caspar J V,Sullivan B P,et al.Synthetic routes to new polypyridyl complexes of osmium(II)[J].Inorg Chem,1988,27:4587 -4598.
[16]Zakeeruddin S M.Towards mediator design:characterization of tris-(4,4’-substituted-a,a’-bipridine)complexes of Iron(Ⅱ),Ruthenium(Ⅱ)and Osmium(Ⅱ)as mediators for glucose oxidase of Aspergillus niger and other redox proteins[J].J Electroanal Chem,1992,337:253 -283.
[17]Fraser D M.Towards mediator design Ⅱ:Optimization of mediator global charge for the mediation of glucose oxidase of Aspergillus niger[J].J Electroanal.Chem,1993,359:125-139.
[18]Zhang C X,Haruyama T.Evaluation of substituted -1,10 -phenanthroline complexes of osmium as mediator for glucose oxidase of aspergillus niger[J].Analytica Chimica Acta,2000,408:225 -232.
[19]Nicholson R S.Theory and application of cyclic voltammetry for measurement of electrode reaction kinetics[J].Anal Chem,1965,37:1351 – 1355.
[20]Hill H A O,Walton N J.Investigation of Some Intermolecular Electron Transfer Reactions of Cytochrome C by electrochemical methods[J].J Am Chem Soc,1982,104(24):6515–6519.
[21]Cass A E G,Davis G.Ferrocene- mediated enzyme electrode for amperometric determination of glucose[J].Anal Chem,1984,56(4):667 –671.
