华东师范大学在校生皮肤上葡萄球菌类型及其抗药性分析
2012-10-31蒋德明马海龙古丽斯坦努尔艾合麦提买尔丹帕力合提
蒋德明, 马海龙, 古丽斯坦·努尔艾合麦提, 买尔丹·帕力合提
(生命科学学院 华东师范大学,上海 200062)
0 引 言
皮肤是人体抵抗致病菌入侵的第一道防线,时常与环境中的各类微生物接触,同时皮肤表面又生长着大量的共生细菌.Gao等人通过分子生态学方法对人体手臂表面共生细菌群落组成进行分析,发现人体皮肤表面存在着8个细菌门,182个细菌种的共生细菌,其中放线菌门(Actinobacteria),厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)共占了94.6%,而葡萄球菌属(Staphylococcus)的细菌占了皮肤表面细菌总数的11.1%[1].葡萄球菌即广泛存在于自然环境中又定植于人体皮肤表面,对于健康人群并不致病,但可伴随“异物”(高分子材料如塑料等)进入病人体内,并通过粘附形成生物膜,入侵血循环而致败血症等,是医院交叉感染的重要来源[2].其致病性随细菌侵入途径、菌量、毒力及机体免疫力不同而异[3].
对皮肤上正常葡萄球菌群落分布的了解有助于对人类和动物上葡萄球菌相关的皮肤疾病的致病性认识.近年来国外学者对皮肤共生葡萄球菌类型分布和抗药性进行了一定的研究,如Hauschild等人通过从食虫动物和啮齿动物身上分离到197株葡萄球菌菌株,通过分析菌株rpoB和dnaJ基因序列发现,琥珀葡萄球菌(Staphylococcus succinus)占总数的28%,其次为木糖葡萄球菌(S.xylosus)占20.8%,斯氏葡萄球菌(S.stepanovicii)占18.3%[4].Nagase等人对7种不同的动物和人体皮肤上葡萄球菌的种类分布进行了研究,发现在动物皮肤上主要以木糖葡萄球菌和松鼠葡萄球菌(S.sciuri)为主,而在人体皮肤上主要以表皮葡萄球菌(S.epidermidis)为主,说明在动物身上和人体身上葡萄球菌分布的类型具有明显的不同[5].另外研究发现,皮肤上葡萄球菌群落的组成差异与皮肤疾病密切相关.如Dekio等人对患有慢性腿部溃疡病人的皮肤细菌群落进行了分析,发现和对照组正常人皮肤上的细菌组成相比,金黄色葡萄球菌(S.Aureus)在患者皮肤上的组成比例明显上升[6].Gao等人在对牛皮癣病人伤口皮肤表面的细菌组成进行了分析,发现和对照的正常皮肤细菌群落比较,其中头状葡萄球菌(S.capitis)和山羊葡萄球菌(S.caprae)数量明显减少,而八叠葡萄球菌(S.hominis)数量明显增加,表皮葡萄球菌的数量在正常皮肤和伤口皮肤上没有明显区别[7].
国内对皮肤共生葡萄球菌的类型和抗药性研究主要集中在医院临床菌株上,如王帮勇等人对重症监护病房的患者各类标本分离的凝固酶阴性葡萄球菌进行鉴定和药敏试验,结果显示,分离的凝固酶阴性葡萄球菌以表皮葡萄球菌和溶血葡萄球菌(S.haemolyticus)为主,菌株对青霉素、红霉素和苯唑西林耐药率最高,分别达100%、93.44%和91.80%[8].陈丽阳等人对广西医科大学第一附属医院2009年1~12月检出的葡萄球菌及药敏结果进行分析,结果临床标本中分离出葡萄球菌796株.药敏结果显示,葡萄球菌对青霉素G和红霉素的耐药率均大于50%,其中耐甲氧西林葡萄球菌对多种抗菌药的耐药性均高于甲氧西林敏感的葡萄球菌,但对万古霉素和利奈唑胺的耐药率为0[9].但国内对健康人群皮肤上的葡萄球菌基本没有什么实质上的研究进展.因此,健康人群皮肤上的葡萄球菌菌株类型以及对抗生素的耐药性等方面还了解得很少.
本文通过采集华东师范大学在校生皮肤表面的细菌样品,通过Baird Parker培养基选择性分离葡萄球菌属菌株,通过16S rRNA基因序列分析菌株类型及菌株之间的系统发育关系;最后利用纸片琼脂扩散法对葡萄球菌菌株对10种常见的抗生素敏感性进行分析.可在一定程度上了解正常人体表面的葡萄球菌的种类和耐药状况,对于健康人体细菌的分布、耐药性研究以及医学上指导临床合理用药等都有一定的指导意义.
1 材料与方法
1.1 材料
1.1.1 样品采集 在学校邀请了30位本校学生,他们都身体健康,且近一个月内没有服用过抗生素,其中维族15人,汉族15人.提取了他们手背皮肤表面的细菌样品,采集方法为用灭菌棉签沾取取样液(0.15 mol/L NaCl,0.1%Tween 20)在被采集者的手背擦拭后,将棉签放入盛有500μL取样液的离心管中清洗,如此重复3次获得皮肤表面细菌样品.样品编号按照英文字母顺序编写,维族人群样品用大写字母;汉族人群样品用小写字母.
1.1.2 主要试剂和仪器 基因组DNA提取试剂盒(北京天根生物有限公司,北京),小量质粒提取试剂盒(北京天根生物有限公司,北京),PCR扩增仪(Eppendoff,德国),凝胶成像系统(Bio-Rad,美国),PCR纯化试剂盒(上海生工生物有限公司,上海),稳压稳流电泳仪和电泳槽,离心机,数码相机,pMD19-T(大连宝生物生物有限公司,大连)载体,大肠杆菌DH5α,药敏纸片(上海欧韦达生物技术有限公司,上海)等.
1.2 葡萄球菌菌株分离
将采集的皮肤表面样品取100μL涂布于Baird Parker培养基(每100 mL含胰蛋白胨1.0g,牛肉浸粉0.5 g,酵母浸粉0.1 g,丙酮酸钠1.0g,甘氨酸1.2 g,氯化锂0.5 g,卵黄亚碲酸钾增菌剂5 mL,琼脂1.5 g,pH值7.2)37℃培养48 h.根据菌落表型不同随机选取不同的菌落,接种在LB液体培养基中培养16 h,加入甘油使其终浓度达到15%,-80℃冻存备用.
1.3 细菌基因组DNA提取
将-80℃冻存菌株转接到LB液体培养基中,培养16 h后,取2 mL菌液到离心管中,按照基因组DNA提取试剂盒的操作说明提取细菌基因组DNA,DNA溶液取5μL用1%琼脂糖凝胶电泳检测.
1.4菌株16S rRNA基因扩增,ARDRA分型与测序
使用细菌通用引物27F和1492R[13]对78菌株16S rRNA基因进行扩增;PCR反应体系(20μL):2×Premix Taq 10μL,上下游引物(l0μmol/L)各0.5μL,模板DNA100 ng左右.PCR扩增程序为:95℃4 min,94℃45 s,55℃45 s,72℃90 s,25个循环;72℃10min.以无菌水为空白作为阴性对照,做2个PCR扩增平行实验.取PCR反应产物5μL进行1%琼脂糖凝胶电泳检测.
对于分离到的葡萄球菌菌株,利用扩增片段限制性酶切(ARDRA)分型方法来确定菌株的类型.PCR产物用PCR产物纯化试剂盒纯化和回收,对纯化的PCR产物用Hinf I和Csp6 I进行酶切分析.酶切体系20μL:Hinf I或Csp6 I 1μL,10×buffer 2μL,PCR产物8μL,ddH2O6μL.37℃ 酶切4 h后加2μL10×Loading buffer终止反应.通过琼脂糖凝胶电泳初步判断不同菌株类型.
为了克隆菌株16S rRNA基因,纯化的PCR产物与pMD19-T Vector载体连接,转化到E.coli DH5α感受态细胞中.转化子扩大培养后,利用煮沸法[14]提取质粒,电泳检测具有目的片段插入的阳性克隆,阳性克隆直接送英俊测序中心测序.
1.5 序列分析和核酸序列收录号
阳性克隆利用引物27F和1492R进行双向测序,测序结果用Contig软件进行拼接,获得近乎全长的16S rRNA基因序列.16S rRNA基因序列与GenBank中的已知序列进行了分析比对,从GenBank中取得相关序列作为参考菌株序列,首先使用ClustalX[15]将序列进行完全比对,然后用Neighbor-joining法[16]取得序列的进化距离.使用软件 Mega[17]作出系统进化树,数据自展重抽样次数1 000次.16S rRNA基因序列进化树以溶酪大球菌(Macrococcus caseolyticus)ATCC13548(GenBank序列号Y15711)作为进化树的根.本实验中所得到的细菌16S rRNA基因序列已提交至GenBank数据库,收录号为JN175356-JN175386.
1.6 葡萄球菌菌株抗生素敏感性分析
利用纸片琼脂扩散法对31株分离到的葡萄球菌菌株的抗生素敏感性进行检测,方法见文献报道[18].本研究选用了10种不同类型的常见抗生素来检测葡萄球菌抗药性,根据产生的抑菌圈直径的大小来确定抗生素抗性情况.选取抗生素和抗性判断标准如下:阿米卡星(Amikacin)30μg,R<14,I=14~17,S>17;阿莫西林(Amoxicillin)10μg,R<28,I=28~36,S>36;氨苄西林(Ampicillin)10μg,R<28,I=28~29,S>29;先锋IV(Cefalexin)30μg,R<14,I=14~18,S>18;氯霉素(Chloromycetin)30μg,R<12,I=12~18,S>18;环丙沙星(Ciprofloxacin)5μg,R<15,I=15~21,S>21;恩诺沙星(Enrofloxacin)5μg,R<22,I=22~28,S>28;红霉素(Erythromycin)15μg,R<13,I=13~23,S>23;庆大霉素(Gentamicin)10μg,R<12,I=12~15,S>15;新霉素(Neomycin)30μg,R<12,I=12~17,S>17.上述抗性标准中,R代表具有抗药性的抑菌圈大小,S代表对抗生素敏感的抑菌圈大小,I代表处于两者之间的临界范围.
2 结 果
2.1 菌株基因组DNA提取和16S rRNA基因扩增
由图1A中可以看出所提取的基因组DNA片段基本都大于10 kb,并且较为完整,无明显降解适合用于后续PCR扩增,其中2号菌株DNA条带不明显,又重新进行了提取并看到了明显条带.细菌16S rRNA基因PCR扩增结果如图1B所示,目的片段大小都为1 500 bp左右,并且特异性较好.
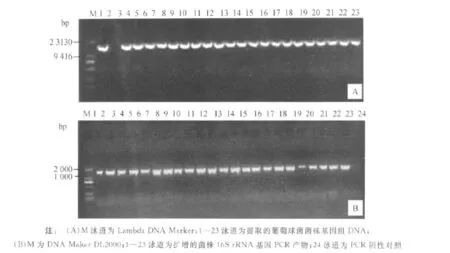
图1 部分菌株提取的基因组DNA(A)和菌株16S rRNA基因的PCR扩增结果(B)Fig.1 Genomic DNA extracted fromStaphylococci isolated from healthy skin(A)and bacterial 16S rRNA genes amplified by PCR(B)
2.2 菌株16S rRNA基因ARDRA分型
本研究中,首先对分离得到的葡萄球菌菌株进行ARDRA分型,然后选取独特类型的菌株进行后续的16S rRNA序列测定和抗生素敏感性分析.经过酶切分型后,得到共31株葡萄球菌菌株.部分酶切图谱检测结果如图2所示,PCR产物酶切条带均小于1 500 bp,因而认为酶切较为充分,并且分辨率较高.酶切图谱显示,每一个人员皮肤细菌样品中存在着至少一种以上不同类型的葡萄球菌,最高发现有3种不同类型的葡萄球菌菌株,随后将对这些菌株进行进一步的鉴定.
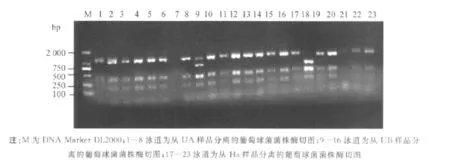
图2 部分菌株16S rRNA基因扩增产物的Hinf I酶切图谱Fig.2 Hinf I restriction patterns of some amplified 16S rRNA genes of Staphylococci strains
2.3 葡萄球菌类型及多样性分析
经过酶切分型以后,共获得了31株不同类型的葡萄球菌菌株,对这些菌株的16SrRNA基因序列进行了测定,结果发现31株菌株可以分为6个不同的种(见表1).其中表皮葡萄球菌有19株,占总数的61.3%.这些菌株中分离自维族人群有11株,它们来自于10位维族人的样品,检出率为66.7%.另外8株分离自汉族人群中,它们来自于8位汉族人的样品,检出率为53.3%.金黄色葡萄球菌发现有3株分别是S.aureus ECNU-UH3,S.aureus ECNU-UK2,S.aureus ECNU-UM4,分离自维族人群样品 H,K,M 中.金黄色葡萄球菌作为一种致病菌,也可能存在于健康人体皮肤表面但并不会引起致病,这一结果与之前Laub等人报道的结果一致[19].腐生葡萄球菌菌株有3株,其中S.saprophyticus ECNUUA1,S.saprophyticus ECNU-UA3,S.saprophyticus ECNU-UF1菌株分离自维族人群样品A和F中.山羊葡萄球菌菌株有4株,其中S.caprae ECNU-UJ2,S.caprae ECNUUF4菌株分离自维族人群样品J,F中,而S.caprae ECNU-Hd1,S.caprae ECNU-Hj3分离自汉族人群样品d,j中.另外巴氏葡萄球菌和孔氏葡萄球菌都只发现1株菌株,说明在人体皮肤微环境中存在的数量较少.
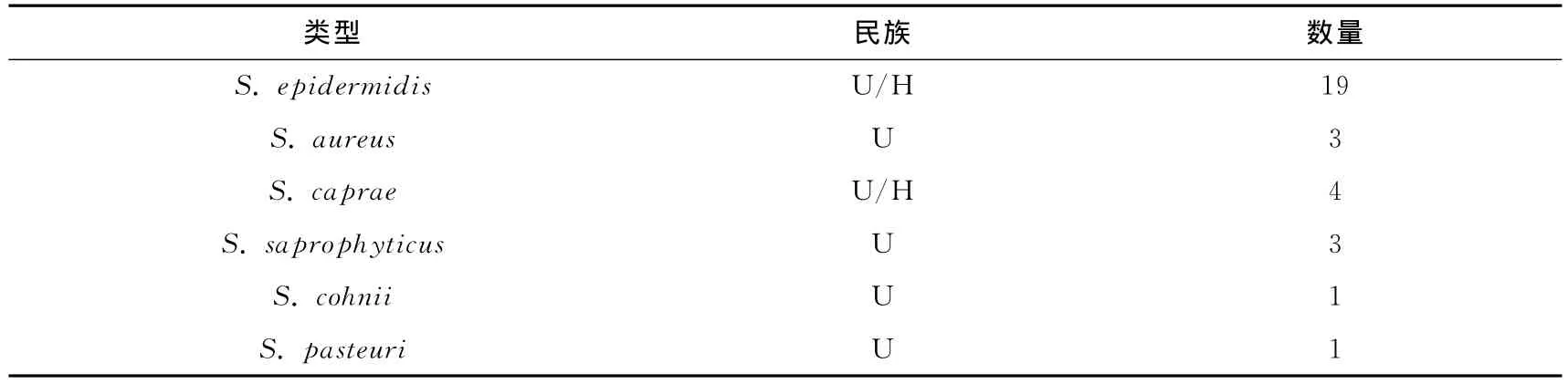
表1 华东师范大学在校学生皮肤微环境中存在的葡萄球菌类型Tab.1 Identification of various staphylococcal strains isolated from human skin samples of East China Normal University students by sequencing 16S rRNA gene
为了分析31株葡萄球菌属菌株之间的系统发育关系,构建了系统进化树,从图3中可以看出,6种不同的葡萄球菌种都位于各自的进化分支内,其中金黄色葡萄球菌与表皮葡萄球有较近的系统进化关系,而腐生葡萄球菌与表皮葡萄球菌的亲缘关系较远.表皮葡萄球菌都位于同一分支内,很多菌株之间的同源性在99%以上;由于表皮葡萄球菌菌株之间16S rRNA基因差异不显著,无法正确显示菌株之间的系统进化关系,因此有必要考虑用其他持家基因如HSP60等来进行进一步的分析.
2.4 葡萄球菌菌株抗生素敏感性分析
虽然分离的葡萄球菌是来自健康人的皮肤,属于人体正常共生细菌,并且菌样采自20~24岁的青年,使用抗生素的机会不会很大,但在研究的31株菌中没有出现一例对于10种抗生素完全敏感的现象,相反地菌株的多重抗性非常普遍,对3种及以上抗生素具有抗药性的概率为81.2%(见表2).3株金黄色葡萄球菌菌株对氨苄西林和阿莫西林都具有明显抗性,而对环丙沙星和庆大霉素都敏感.同时发现山羊葡萄球菌Hj3除了对氯霉素和新霉素抗性处于临界状态外其他7种抗生素均具有抗性,只对阿米卡星敏感的严重耐药性现象.
从图4中可以看出,在10种抗生素中,氨苄青霉素,阿莫西林和恩诺沙星3种抗菌效果都较低.其中对氨苄青霉素敏感的菌株只有3株菌株,分别是表皮葡萄球菌UE2,UI5和腐生葡萄球菌UA1.对阿莫西林敏感的菌株并没有发现,且只有3株菌株对其敏感性处于临界范围.对恩诺沙星敏感的菌株并没有发现,但有9株菌株对其敏感性处于临界范围.阿米卡星的抗葡萄球菌效果最好,在31株菌株中只有3株菌株对阿米卡星有抗性,它们分别是表皮葡萄球菌UK5,UJ1和金黄色葡萄球菌UK2.其次是新霉素,抗药性在3.1%,只有表皮葡萄球菌Hh2对其敏感,但有11株菌株对新霉素的敏感性处于临界范围.环丙沙星,氯霉素和先锋IV的抗药性则处于较低水平,为9%~20%之间.庆大霉素和红霉素的抗药性处于中等水平,分别为21.9%和31.3%.

图3 31株葡萄球菌及对照菌株的16S rRNA基因系统进化树Fig.3 The phylogenetic tree constructed by the 16S rRNA gene sequences of the 31 Staphylococcus strains and references

表2 分离自华东师范大学在校学生皮肤微环境的葡萄球菌菌株对抗生素的抗药性Tab.2 Antibiotic susceptibility of Staphylococcus strains isolated from healthy human skin samples of East China Normal University students

图4 31株葡萄球菌菌株对10种抗生素的耐药率Fig.4 Antibiotic resistance of 31 Staphylococcus strains against 10 different antibiotics
3 结 论
通过对华东师范大学在校学生的皮肤上葡萄球菌的类型分析,发现手背皮肤上主要以表皮葡萄球菌为主,而巴氏葡萄球菌和孔氏葡萄球菌都只发现1株菌株,说明在这些皮肤细菌样品中存在的数量较少.在这些皮肤细菌样品中有一半来自于维族人,一半来自于汉族人,结果显示在两个民族的皮肤细菌样品中,维族人群样品中分离的葡萄球菌数量较多,但没有发现显著的菌株类型的不同.由于采集的样品数量有限,而且在校维族学生已在沪生活最少1年以上,没有办法采集真正生活在新疆的维族人的皮肤菌样,所以两种民族皮肤葡萄球菌菌种真正的差别仍需要深入研究.
在葡萄球菌的测序结果中得到的菌种多数为表皮葡萄球菌,而进化树显示虽属同一个种但得到的表皮葡萄球菌同源性的差异也比较大,有的同源性非常近(>99%),有的则存在比较大的差异.而从进化树中也可以看出同属于葡萄球菌属的几种葡萄球菌之间的亲缘关系.但对于同一种类的菌株来看,由于16S rRNA基因差异不显著,无法得出正确的系统进化关系,可能需要对其他持家基因进行分析.纵览整个进化树可以看出金黄色葡萄球菌与表皮葡萄球有较近的亲缘关系,而腐生葡萄球菌与表皮葡萄球菌的亲缘关系较远.
在抗生素敏感性的检测中,发现虽然所采集的细菌来自健康人的皮肤,但其对于抗生素的耐药性仍然很强,氨苄青霉素、阿莫西林和恩诺沙星3种抗菌效果都比较低,阿米卡星的抗葡萄球菌效果最好,在31株菌株中只有3株菌株对阿米卡星有抗性.
[1] GAO Z,TSENG C H,PEI Z H,et al.Molecular analysis of human forearm superficial skin bacterial biota[J].Proceedings of the National Academy of Sciences of the United States of America,2007,104(8):2927-2932.
[2] 徐秀华,文细毛,任南,等.我院表皮葡萄球菌检出率的增高及评价[J].中华医院感染学杂志,2000,10(3):179-181.
[3] SPEAKER M G,MILCH F A,SHAH M K,et al.Role of external bacteria flora in the pathogenesis of acute postoperative endophthalmitis[J].Ophthalmology,1991,98:639-649.
[4] HAUSCHIDA T,SLIZEWSKIA P,MASIEWICZB P.Species distribution of Staphylococci from small wild mammals[J].Systematic and Applied Microbiology,2010,33:457-460.
[5] NAGASE N,SASAKI A,YAMASHITA K,et al.Isolation and species distribution of Staphylococci from animal and human skin[J].The Journal of Veterinary Medical Science,2002,64(3):245-250.
[6] BROOK I,FRAZIER E H.Aerobic and anaerobic microbiology of chronic venous ulcers[J].International Journal of Dermatology,1998,37:126-8.
[7] GAO Z,TSENG C H,PEI Z H,et al.Substantial alterations of the cutaneous bacterial biota in psoriatic lesions[J].PLoS One,2008,3(7):e2719.
[8] 王帮勇,陈霞,朱秋丽,等.重症监护病房凝固酶阴性葡萄球菌分布及耐药性分析[J].中国微生态学杂志,2011(4):356-357.
[9] 陈丽阳,郭世辉,钟品玲,等.临床标本中葡萄球菌的检测及耐药性研究[J].检验医学与临床,2011(2):189-190.
[10] BROSIUS J,PALMER M L,KENNEDY P J,et al.Complete nucleotide sequence of a 16S ribosomal RNA gene fromEscherichia coli[J].The Proceedings of the National Academy of Sciences USA,1978,75:4801-4805.
[11] SAMBROOK J,RUSSELL D W.Molecular Cloning:A Laboratory Manual[M].3th ed.New York:Cold Spring Harbor,2001.
[12] THOMPSON J D,GIBSON T J,PLEWNIAK F,et al.The CLUSTAL_X windows interface:flexible strategies for multiple sequence alignment aided by quality analysis tools[J].Nucleic Acids Research,1997,25:4876-4882.
[13] SAITOU N,NEI M.The neighbor-joining method:A new method for reconstructing phylogenetic trees[J].Molecular Biology and Evolution,1987(4):406-425.
[14] KUMAR S,TAMURA K,NEI M.MEGA3:Integrated software for molecular evolutionary genetics analysis and sequence alignment[J].Briefings in Bioinformatics,2004(5):150-163.
[15] PENNA B,VARGES R,MEDEIROS L,et al.Species distribution and antimicrobial susceptibility of staphylococci isolated from canine otitis externa[J].Veterinary Dermatology,2010,21(3):292-296.
[16] LAUB K,KARDOS S,NAGY K,et al.Detection of Staphylococcus aureus nasal carriage in healthy young adults from a Hungarian University[J].Acta Microbiologica et Immunologica Hungarica,2011,58(1):75-84.
