盘基网柄菌KAx-3中类免疫细胞的初步研究
2012-10-31梁静静侯连生
梁静静, 田 莉, 李 丽, 侯连生
(华东师范大学 生命科学学院,上海 200062)
0 引 言
免疫系统是所有生物必须具备的防御机构,最初演化生成的单细胞原生动物就有吞噬、销毁和排斥异物的功能。这表明在生物多样化之前,古老细胞在形成觅食机理的同时也具备了初步的防御功能.动植物具备自身免疫相关的信号系统途径,来抵抗细菌病原体等外界环境的威胁.动物主要通过Toll-like感受器(TLRs),植物主要通过抗性R蛋白表现防御反应[1,2].无论是TLRs还是R蛋白都是通过富含亮氨酸的重复(LRRs)这一特殊结构域,连接在细菌的激发子上并通过接头蛋白和效应蛋白(例如包含TIR域)发送信号,引起相关基因的表达,开启并调节特殊的防御系统[3].
盘基网柄菌(Dictyostelium discoideum)生活在土壤中并以细菌为食,因此它必须防御环境中的毒素和病原体.该菌株在多细胞发育过程中也会受到环境的威胁.已报道盘基网柄菌从细胞聚集阶段到子实体形成前,会形成一种具有半透过性的鞘与外界隔离,子实体阶段又通过形成孢子来抵抗环境的威胁[4].免疫是在吞噬作用的基础上发展而来的[5],盘基网柄菌中可能也存在类似于免疫的细胞.子实体形成前,蛞蝓样多细胞体会迁移一段时间,在这段时间里蛞蝓体很有可能通过自身免疫来防御外界的毒素和细菌病原体的威胁.因此,为了验证盘基网柄菌中是否存在这种类似于免疫的细胞,本研究以Ethidium bromide(EB)作为毒物,来观察盘基网柄菌对该毒物的反应.结果表明,盘基网柄菌中存在一种能吞噬EB的细胞,随着蛞蝓体的不断爬行,这类特殊的细胞最终能将毒物脱出体外,我们把这类具有免疫样功能的特殊细胞称之为类免疫细胞;并检测其存在于盘基网柄菌的哪类细胞中及在总细胞中所占的比例.
1 材料与方法
1.1 材料
1.1.1 细胞株
盘基网柄菌野生型细胞株KAx-3.由多伦多大学医学院生化实验室Dr.Siu惠赠.
1.1.2 EB溶液、Hoechst33342(HO)和碘化丙啶(PI)的配制
1 mL的超纯水中配制浓度为10 mg/mL的EB原液,再把原液稀释500倍成使用液,使其终浓度为20μg/mL.Hoechst33342(HO)为活体荧光染料且具有毒性,若浓度选择不恰当则可能会引起细胞死亡或应急反应[6].实验前,用超纯水将HO配置成10 mg/mL的原液.经多次实验选择,最终设置HO的工作液浓度为10μg/mL.荧光染料PI溶于PBS(pH 7.4),终浓度为10μg/mL.以上溶液均4℃避光保存.
1.2 研究方法
1.2.1 细胞培养与发育
盘基网柄菌野生型细胞KAx-3培养于SM固体培养基上,用好氧性克雷伯氏细菌(Klebstella aerogenes)喂养[7].收集对数期的细胞,用预冷的PB缓冲液(pH6.4)漂洗3次,弃上清,最后将细胞团悬浮在PDF缓冲液中,细胞浓度调至2×106cells/mL.取500μL细胞悬浮液均匀地铺在预涂有多聚赖氨酸的盖玻片上,先将其置于湿盒中,再将湿盒整体置于22℃恒温培养箱中发育.
1.2.2 观察类免疫细胞
分别收集发育至细胞丘和蛞蝓体阶段的细胞,滴加浓度为20μg/mL的EB溶液,处理15 min,1 h,2 h后用荧光显微镜观察多细胞体吞噬EB的情况.用浓度为20μg/mL EB和10μg/mL HO共同染色,共聚焦显微镜确定EB在类免疫细胞中的位置.
1.2.3 流式细胞术(FACS)测定类免疫细胞
根据Ratner等的方法[8],用Percoll密度梯度分离技术获得发育至蛞蝓体阶段的前柄细胞和前孢子细胞.在收集的前柄细胞和前孢子细胞中,分别加入PBS,4℃下650 g离心10 min.加入10μg/mL PI染色45 min后,用PBS缓冲液,650 g离心3次,每次5 min.细胞浓度调至1×108cells/mL,送流式细胞仪进行检测.
2 结 果
2.1 细胞丘时期
饥饿状态下,KAx-3细胞聚集发育至细胞丘阶段,用荧光染料EB作为毒物处理此阶段的细胞.无论是处理15 min(见图1-1)、1 h(见图1-2),甚至是处理2 h(见图1-3),均未发现细胞中有吞噬EB后而显出的特别明亮的荧光点,仅能观察到整个细胞丘在加入EB后显现的暗红色轮廓,并无吞噬EB的细胞.这表明盘基网柄菌发育至细胞丘阶段并不存在类免疫细胞.那么这一阶段该生物体有何种保护机制?目前尚不清楚,需要进一步研究.

图1 EB处理细胞丘阶段的细胞Fig.1 The cells during the mound stage were exposed to EB
2.2 蛞蝓体阶段
以EB作为毒物,处理蛞蝓体阶段的细胞.荧光显微镜观察发现,EB处理仅15 min后,发现EB被一类细胞吞噬,这类特殊的细胞在蛞蝓体内有的作为细胞群出现,细胞数量较少,约是5到10个细胞聚成一团,形成不变的细胞群(见图2-1),有的则呈现为单独的几个细胞(见图2-2).此时,这些细胞群或单个细胞主要附在蛞蝓体鞘的内表面.EB处理1 h以后,可见到明显的强荧光反应.随着蛞蝓体的迁移,这些强荧光反应的细胞团也不断向后移动(见图2-3).处理2 h后,发现在蛞蝓体遗弃的粘液鞘的后端有强荧光反应,表明EB已经被丢弃在多细胞体外(见图2-4).由于这些特殊细胞不断的被丢弃,推测可能有新的这类细胞在蛞蝓体内产生.这类特殊细胞具备隔绝EB的能力,EB也随着蛞蝓体的不断爬行而排出.在蛞蝓体中,这类细胞吞噬毒物后将其运送到有机体外面,因此,认为这是一种具有免疫样功能的类免疫细胞.同时还观察到,类免疫细胞的细胞群不会随毒物处理时间的延长而发生大小改变.
2.3 EB在细胞内的定位
以HO定位细胞核作为参照,观察EB在细胞中存在的位置.经过双重染色,观察到EB的定位并不在细胞核上(见图3-1,3-2),排除EB染凋亡细胞核的可能,从而确定EB是作为毒物被吞入细胞内的.通过激光共聚焦显微镜观察,几乎整个细胞都能观察到EB的荧光反应,在细胞核的所处的位置,荧光反应特别强烈(见图3-3,3-4).

图2 EB处理蛞蝓体阶段的细胞Fig.2 The cells were exposed to EB in the slug stage
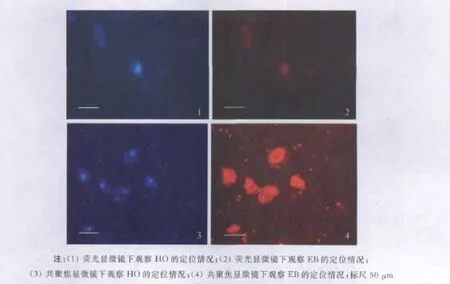
图3 EB在细胞中的定位Fig.3 EB was orientated in the disaggregated slug body
2.4 类免疫细胞的分布
为进一步确定类免疫细胞是来自于前柄细胞还是前孢子细胞,以及该类细胞在蛞蝓体中的含量,以PI作为毒物,并用流式细胞仪(FACS)上机检测.收集发育至蛞蝓体的细胞,送样检测前,采用震荡的方法将聚集的细胞打散,使之成为单个细胞.图4-2为PI处理后FACS检测结果,图4-1为对照组(未用PI处理)检测结果.数据表明,PI处理后有少部分细胞的吸光度增强,大约是原来的10倍.
Percoll密度梯度分离技术分离得到前柄细胞和前孢子细胞.PI处理收集的前柄细胞和前孢子细胞,未经PI处理的前柄细胞和前孢子细胞作为对照.FACS检测结果显示,与对照组相比(见图4-3),前柄细胞经PI处理后吸光度增大(见图4-4).但经PI处理后的前孢子细胞(见图4-6)与对照组(见图4-5)相比,吸光度没有变化.因此推断类免疫细胞主要来源于前柄细胞,前孢子细胞中几乎没有发现类免疫细胞.从结果也可以看出,类免疫细胞的含量较少,约占整个蛞蝓体细胞的10%.
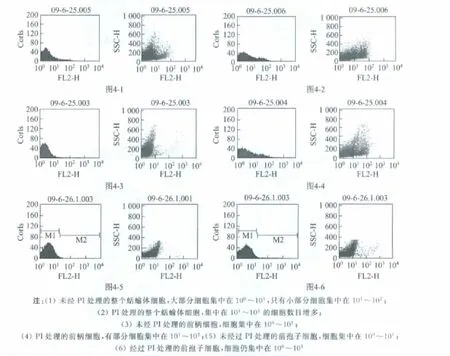
图4 FACS测定类免疫细胞的分布Fig.4 The distribution of immune-like cells by FACS
3 讨 论
盘基网柄菌多细胞发育的最终结果是形成由柄细胞和孢子细胞组成的子实体,整个发育过程历经4个阶段:细胞聚集阶段(aggregation),细胞丘(mound),蛞蝓体(slug)和子实体(fruiting body)[9].孢子细胞在合适条件下萌发开始新的生命周期,而柄细胞是死亡细胞.所以盘基网柄菌多细胞发育与高等生物发育相似,存在细胞分化和细胞凋亡现象.一般认为该菌株细胞丘时期的细胞大都是没有分化的,至多处于初步分化阶段[10].通过比较用EB处理的细胞丘和蛞蝓体阶段的细胞,可以看到两者存在明显区别:细胞丘内几乎所有的细胞都成暗红色状态;而蛞蝓体内仅少数细胞有明显的强荧光反应,这些细胞聚集成团,起到了隔绝毒物的作用,即蛞蝓体内吞噬毒物的细胞有明显的聚毒物效应.这说明只有已分化的细胞才能进一步细分成各类细胞,另一方面也反证了细胞丘时期的细胞几乎没有分化.
为使种群能够延续下去,换一句话是为使种群内大部分细胞能生存下去,就必需牺牲一小部分细胞,这种现象称之为利他(altruistic)行为[11].当整个蛞蝓体遭受到外界毒物侵袭,有生存危险时,只能牺牲一部分细胞来保存大部分细胞的生存.从数据来看,蛞蝓体内类免疫细胞将外界毒物包裹在细胞的一定范围中,并局限在蛞蝓体的表面部位,最终把毒物排出体外.而且最多牺牲10%细胞,从而使90%的细胞生存下来了.因此从某种意义上来说,免疫系统的进化除了有效抵御外界有害物质的侵袭外,另一方面就是使整个种群能顺利延续下去.流式细胞术检测结果表明,类免疫细胞存在于前柄细胞中.这可能与前柄细胞参与自噬和蛋白的分解代谢有关[12],也与多数基因在前柄细胞中表达,前柄细胞具备多种分化能力而前孢子细胞分化相对单一的现象相一致.
在盘基网柄菌的其他种类中,例D.dimigraformum,D.pupureum,D.citrinum和D.intermedium都发现具有解毒和免疫样功能的细胞[13].因此,推测低等的原生动物盘基网柄菌中具备了简单的内在的免疫细胞,能够防御外界环境对其产生的威胁.通过生物信息学手段分析盘基网柄菌细胞的基因组[14],能够鉴别出盘基网柄菌细胞内存在动植物中内在的免疫信号蛋白的同源物,其中包括两个含有TIR结构域的蛋白,它们类似于拟南芥的RPP5蛋白[15];WRKY转录因子[16],16个潜在的LRR结构域受体,其中一些蛋白非常类似于水稻的Xa2l[17]。同时肺炎军团菌在盘基网柄菌中的复制方式与在巨噬细胞中相同,细菌生长在与粗面内质网相连的囊泡中[18]。根据上述分析,推测盘基网柄菌内存在免疫相关蛋白.但是这种类免疫细胞是像动植物那样在毒物诱导后通过特殊蛋白,启动免疫机制[16]还是在毒物诱导前,机体内本身就存在;在毒物被排出蛞蝓体后,类免疫细胞是否仍然存在,有待于从分子水平上进一步深入研究.
[1] MEDZHITOV R,JANEWAY C A Jr.An ancient system of host defense[J].Current Opinion in Immunology,1998,10:12-15.
[2] THORSTEN N,FREDERIC B,BIRGIT K,et al.Innate immunity in plants and animals:striking similarities and obvious differences[J].Immunological Reviews,2004,198:249-266.
[3] CHEN G K,ZHUCHENKO O,KUSPA A.Immune-like phagocyte activity in the social amoeba[J].Science,2007,317(5838):678-681.
[4] KESSIN R H.Dictyostelium:Evolution,Cell Biology,and the Development of Multicellularity[M].Cambridge:Cambridge University Press,2011.
[5] GERMAIN R N.An innately interesting decade of research in immunology[J].Nature Medicine,2004,10(12):1307-1320.
[6] TATISCHEFF I,LAVIALLE F,PIGAGLIO-DESHAYES S,et al.Dictyosteliumextracellular vesicles contai-ning Hoechst 33342 transfer the dye into the nuclei of living cells:A fluorescence study[J].J Fluoresc,2008,18(2):319-328.
[7] SUSSSMAN M.Cultivation and synchronous morphogenesis of Dictyosteliumunder controlled experimental conditions[G]∥PHILLIP SHEELER,DONALD E BIANCHI.Methods in Cell Biology.New York:Wiley,1987,28:9-29.
[8] RATNER D,BORTH W.Comparison of differentiating Dictyostelium discoideumcell types separated by an improved method of density gradient centrifugation[J].Exp Cell Res,1983,143(1):1-13.
[9] 侯连生.gp150蛋白在盘基网柄菌发育中的作用及粘附分子间关系的分析[J].动物学报,2004,50(1):75-82.
[10] LOUISE F,ROB K,FRANCISCO V.Dictyostelium[J].Current Biology,2010,20:R1008-R1010.
[11] HIROSE S,BENABENTOS R,HO H I,et al.Self-recognition in social amoebae is mediated by allelic pairs of tiger genes[J].Science,2011,333(6041):467-470.
[12] YAMAMOTO A,TAKEUCHI I.Vital staining of autophagic vacuoles in differentiating cells of Dictyostelium discoideum[J].Differentiation,1983,24:83-87.
[13] STRASSMANN J E,QUELLER D C.Sociobiology goes micro[J].ASM News,2004,70:526-532.
[14] EICHINGER L,PACHEBAT J A,GLÖCKNER G,et al.The genome of the social amoeba Dictyostelium discoideum[J].Nature,2005,435:43-57.
[15] PARKER J E,COLEMAN M J,SZABO V,et al.The Arabidopsis downy mildew resistance gene RPP5 shares similarity to the Toll and Interleukin-1 receptors with N and L6[J].The Plant Cell,1997,9(6):879-894.
[16] EULGEM T.Regulation of the Arabidopsis defense transcriptome[J].Trends in Plant Science,2005,10:71-78.
[17] LEE S W,HAN S W,BARTLEY L E,et al.Unique characteristics of Xanthomonas oryzae pv.oryzae AvrXa21 and implications for plant innate immunity[J].Science,2006,103(49):18395-18400.
[18] SOLOMON J M,RUPPER A,CARDELLI J A,et al.Intracellular growth of Legionella pneumophilain Dictyostelium discoideum,a system for genetic analysis of host-pathogen interactions[J].Infection and Immunity,2000,68(5):2939-2947.
