葡萄球菌肠毒素DAS-ELISA检测方法的建立及应用
2012-10-28刘鹏翀黄金海
刘鹏翀,黄金海,*,刘 莉,刘 莹,刘 壮,孙 盈
(1.天津大学化工学院,天津 300072;2.天津市乳品食品监测中心,天津 300381)
葡萄球菌肠毒素DAS-ELISA检测方法的建立及应用
刘鹏翀1,黄金海1,*,刘 莉1,刘 莹1,刘 壮2,孙 盈1
(1.天津大学化工学院,天津 300072;2.天津市乳品食品监测中心,天津 300381)
为筛选特异性强、亲和力高、可夹心配对单克隆抗体4A2和5C12,通过方阵试验优化工作条件,建立金黄色葡萄球菌肠毒素(staphylococcal enterotoxins,SEs)的双抗体夹心-酶联免疫吸附试验定量检测方法。结果表明:该方法标准曲线为y=4.074x-1.1888,R2=0.9892,检测下限为0.307μg/mL,批内和批间变异系数均小于10%,脱脂乳粉中SEs掺入试验测定回收率为103%~107%,特异性、重复性和稳定性良好;应用所建双抗体夹心-酶联免疫吸附试验方法,对数株葡萄球菌分离株体外培养上清中SEs产生的动态变化进行分析表明,不同菌株SEs分泌能力不同,且0~20h分泌量不断增加,对鲜牛乳和猪淋巴组织匀浆中的SEs进行检测,检出率分别为51.7%和59.1%,并与进口商品化试剂盒检测结果比对,一致率达92.5%,表明食品中SEs污染的普遍存在。所建方法灵敏高效,可为食源性污染监控提供有效手段。
葡萄球菌;葡萄球菌肠毒素;双抗体夹心-酶联免疫吸附法;检测方法
葡萄球菌肠毒素(staphylococcal enterotoxins,SEs)是由血浆凝固酶或耐热核酸酶阳性菌株产生的一类结构相关、毒力相似、抗原性不同的胞外蛋白质[1]。迄今,血清型鉴定明确的SEs除传统分类的SEA、SEB、SEC、 SED、SEE、SEF(toxic shock syndrome toxin-1,TSST-1)外, SEG、SEH、SEI、SEJ、SEK、SEM、SEN等新型肠毒素随研究的深入而不断被发现[2]。SEs已被认为是第二大细菌毒素[3],每100g食物中含有18μg既能引发中毒,是引起人类疾病和细菌性食物中毒的主要致病因子,为世界性卫生问题[4]。建立食品原料中SEs的快速灵敏检测方法对临床诊断、预防SEs引起的食物中毒具有实际意义,也有助于开展对新型肠毒素蛋白结构、功能等的理论研究。
目前,SEs检测的酶联免疫吸附方法(enzyme-linked immunosorbnent assay,ELISA)仍是应用最广泛、可信度较高的方法,但目前普遍采用多抗,故具有存在交叉反应、灵敏度不足等缺陷,使得SEs的检测难于定量,不能满足新型肠毒素检测的需求。本研究通过筛选特异性强、亲和力高、可夹心配对的单抗,建立双抗体夹心(double antibody sandwich,DAS)-ELISA定量检测SEs方法。
1 材料与方法
1.1 材料、试剂与仪器
猪淋巴组织匀浆样本110份,采集于天津市屠宰场,-40℃冻存;鲜牛乳样本120份,由天津市乳品监测中心提供。
SEA抗原标准品 军事医学科学院微生物学研究所;SEA-His、SEK-His、SEO-His、SEG-His、SEUHis重组抗原、抗SEA单克隆抗体 4A2、7G5,抗SEO单克隆抗体8C7、5C12腹水 自制;葡萄球菌分离株PMJ 28-1(sea)、JIN 2(sek)、PMJ24-3(seo)、PYN1-3 (seg、sem、sen、seo)、ZNZ2-3(携带肠毒素sea、sec、sed、tsst、seg、she、sei、sem、sen、ser、seu基因)、JI 1-1(未携带肠毒素基因)(括号内为菌株携带肠毒素基因)由本实验室保存;金黄色葡萄球菌肠毒素总量检测试剂盒(RIDASCREEN SET Total) 德国R-Biopharm公司。其余常规试剂均为分析纯。
96孔酶标板 美国Costa公司;DNM-9602酶标仪北京普朗新技术公司;Fossomatic 5000体细胞分析仪 北京福斯佳科技有限公司。
1.2 方法
1.2.1 单克隆抗体的制备与标记
饱和硫酸铵法分别纯化4A2、7G5、8C7和5C12腹水,紫外吸收法测定蛋白浓度。间接ELISA法测定纯化抗体效价,按Beatty推导公式计算相对抗体亲和力[5]。选取效价高、亲和力较强的单抗,Wilson改良过碘酸钠法进行辣根过氧化物酶标记。标记物(HRP-McAb)采用直接ELISA方法进行抗体活性鉴定。
1.2.2 DAS-ELISA方法的建立
将除HRP标记用抗体外的其余株单抗作1:100稀释包被,分别与HRP标记单抗进行配伍组合,以选择最佳夹心配对抗体。再将最佳包被抗体分别作1:50、1:100、1:200、1:400稀释包被,SEA-His重组蛋白作为抗原,并按1:40、1:80、1:160、1:320稀释进行实验,采用交叉方阵滴定法[6],筛选、确定包被抗体与抗原最佳工作质量浓度;同时对封闭液种类和质量浓度、酶标抗体工作质量浓度、显色时间等反应条件进行优化,确定最佳的检测体系。
1.2.3 标准曲线测定
按照已确定的最佳反应条件进行ELISA检测,以SEA纯品及SEA-His为阳性样品,从10μg/mL起进行“2×”倍比稀释至0.078μg/mL,各组重复3孔。分别以OD450值为横坐标、对应抗原质量浓度的常用对数(lg CSEs)为纵坐标,获得线性区段标准曲线方程,并计算天然肠毒素检测下限。在线性检测范围为内分别将SEA-His、SEK-His、SEO-His、SEG-His、SEU-His进行“2×”倍比稀释,绘制回归曲线。
1.2.4 特异性、重复性、稳定性实验
大肠埃希氏菌肠毒素为食品常见污染物,将大肠埃希氏菌LB过夜培养物12000r/min离心2min取上清液,应用DAS-ELISA方法进行检测。同时设检测质量浓度为5、2.5、1.25μg/mL的SEA-His阳性、空白培养基阴性对照。每组重复12孔,t检验分析所建立方法的特异性及批内变异系数。将制备的不同批次的酶标板于4℃放置1、3、7、10d后,检测同一SEA-His阳性样品,每组重复12孔,计算批间变异系数。
1.2.5 DAS-ELISA方法检测样品中肠毒素
6株葡萄球菌分离株天然SEs分泌的动力学分析:将不同葡萄球菌分离株单菌落分别接种10mL LB液体培养基,37℃培养(120r/min)12h,获得种子液。分别取种子液按体积分数1%接种50mL脑心浸液培养基,37℃培养(120r/min)20h。发酵过程中,0~9h内每小时取样1mL,10~20h每2h取样1mL,样本于4℃、12000r/mim离心5min,留取上清液,即为天然SEs粗提取液。利用DASELISA体系检测6种葡萄球菌产毒动态变化。
鲜牛乳、猪肉组织中SEs检测:称取5g SEs检测阴性脱脂乳粉溶于95mL蒸馏水配制成5%脱脂乳液,煮沸30min后分别加入高(20μg/mL)、中(5μg/mL)、低(1.25μg/mL)不同剂量的SEA-His,混合后12000r/min离心2min,取上清液,按建立检测程序测定,计算平均回收率。采集天津地区120份鲜牛乳,应用体细胞分析仪测定体细胞数,同时取1mL样品12000r/min离心2min,取水相上清作待测样品。采集天津地区110份猪肉淋巴结,分别称取1g组织样本,加入5mL PBS匀浆后4℃、12000r/min离心5min,取上清液作待测样品。采用DASELISA方法对上述样品进行检测,并随机抽取40份样品应用RIDASCREEN SET Total试剂盒检测,比较检测结果的一致性。
2 结果与分析
2.1 单克隆抗体纯化与标记
4A2、7G5、8C7和5C12四株纯化单抗含量分别为4.50、8.92、9.25、6.27mg/mL,效价为1:5120~1:10240,相对亲和常数均大于6.612×108L/mol。选用效价及抗原结合能力相对较佳的5C12株单抗对其进行HRP标记,结合率为0.831。经直接ELISA测定,HRP-5C12在1:6400稀释时,结果仍为阳性。
2.2 DAS-ELISA方法建立及优化
分别以4A2、7G5、8C7纯化抗体作为捕获抗体,HRP-5C12作为检测抗体,进行夹心配对。选取P/N值最高且本底值较低的配对为最佳配伍组合(图1)。
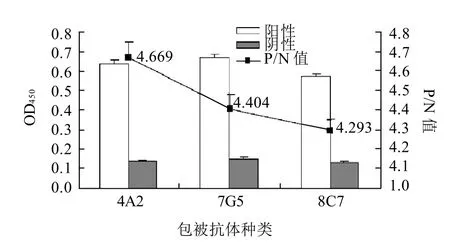
图1 3株单抗夹心配对结果Fig.1 Results of sandwich matching for three McAbs
确立DAS-ELISA方法最佳工作条件为:4A2株单抗稀释至4.5、100μL/孔,4℃过夜包被;体积分数5%猪血清为封闭液;HRP-5C12工作浓度1:160。
2.3 标准曲线测定
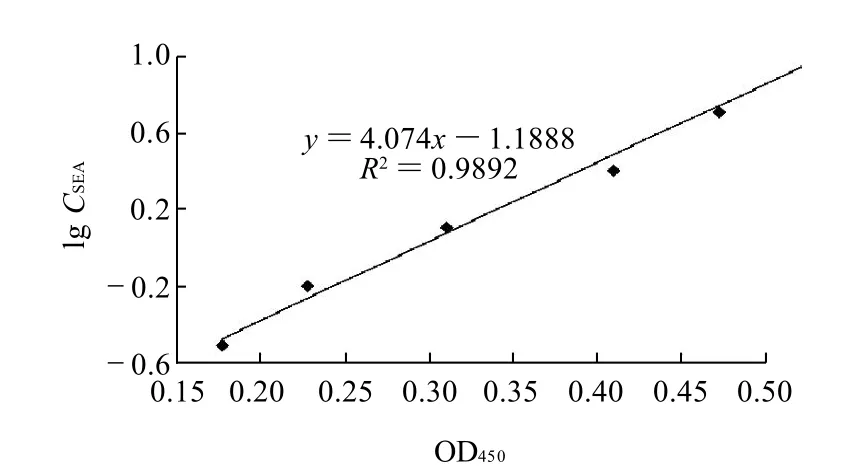
图2 SEA标准曲线Fig.2 Standard curve of SEA
应用确定的DAS-ELISA反应程序检测SEA-His系列稀释样品,绘制肠毒素质量浓度常用对数与OD值之间的反应回归曲线,结果见图2,结果表明SEA-His在0.312~10μg/mL范围内呈现明显的剂量效应关系,DASELISA检测OD450(x)与肠毒素含量常用对数lg CSEA(y)之间的回归方程为y=4.074x-1.1888,R2=0.9892,计算可知所建方法对天然肠毒素检测下限为0.307μg/mL。
在0.307~10μg/mL检测线性范围内,分别检测SEAHis、SEK-His、SEO-His、SEG-His、SEU-His倍比稀释样品,结果见图3。5种SEs-His及天然肠毒素SEA回归曲线线性关系良好,斜率相近,表明选用SEA-His建立的DAS-ELISA方法识别天然肠毒素SEA外,同时能够检测包括SEG、SEK、SEO、SEU在内多种血清型肠毒素,所用单抗具备群特异性,能满足食品中多型SEs检测的要求。
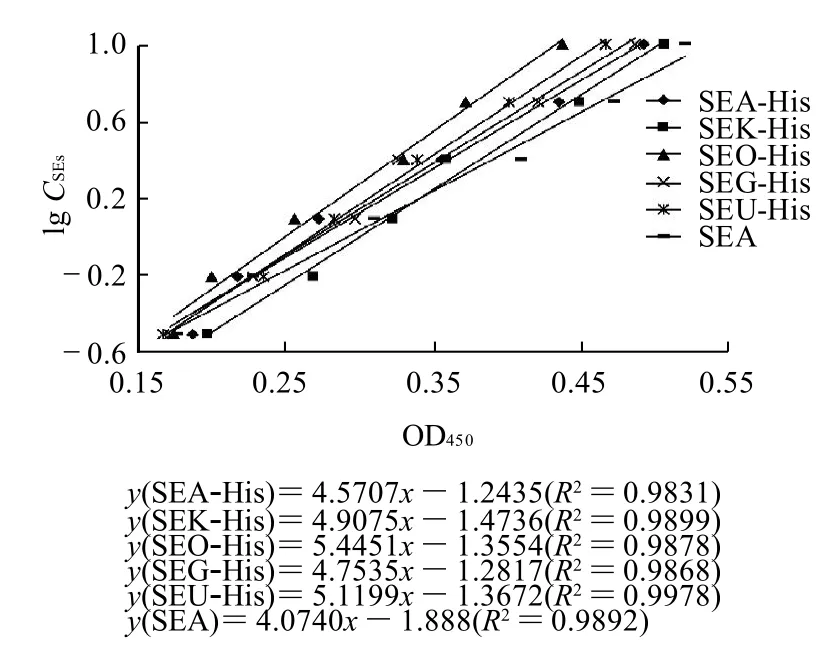
图3 SEs-His及SEA回归曲线Fig.3 Comparison of the regression curves of SE-His and SEA
2.4 特异性、重复性与稳定性实验
同时检测大肠埃希氏菌培养上清液及空白培养基,OD450分别为0.102±0.009、0.096±0.011,t检验(P>0.05),表明检测方法与大肠埃希氏菌培养物无交叉反应。对不同含量SEs样品检测的批内变异系数在2.319%~3.746%、不同批次检测试剂盒对相同样品检测的批间变异系数为6.140%~10.251%,表明检测方法具有较好的重复性和稳定性。
2.5 DAS-ELISA方法的初步应用
模拟葡萄球菌产生SEs培养环境,应用建立的DASELISA体系检测6株葡萄球菌肠毒素产生的动态变化,分别以培养时间为横坐标、OD450为纵坐标,绘制动态曲线如图4所示。结果表明,不同菌种产毒能力不同,除菌株JI1-1培养20h时接近阴阳性临界值,其余菌株在此培养条件下6~8h均有天然肠毒素检出,且随培养时间延长递增趋势明显。

图4 6株葡萄球菌SEs分泌动态曲线Fig.4 Dynamic curves of SE secretion by different isolates
检测添加不同剂量SEA-His脱脂乳中毒素,实测值与理论值间符合率良好,回收率接近100%。表1所示,SEs具有良好的亲水性,离心处理不影响奶样中SEs的全量检出。
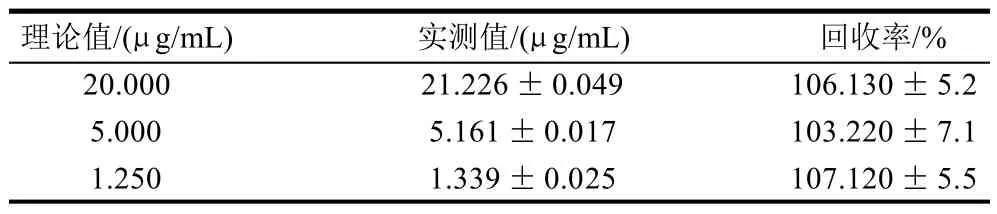
表1 脱脂乳肠毒素掺入实验结果Table 1 Recovery rates of DAS-ELISA for milk samples spiked with ES
对120份鲜牛乳样品中SEs进行检测(表2),阳性检出率为51.7%。与体细胞数检测结果比较,其中体细胞数超标(>5×10个/mL)且SEs阳性检出的样品55份,体细胞数正常且SEs阴性检出的样品28份,附合率达69.7%(83/120),表明SEs阳性与其体细胞超标可能存在一定相关性。110份猪淋巴结中SEs检测结果(表3)显示,肠毒素在淋巴结中有较高的检出率59.1%。随机抽取40份样品,自建DAS-ELISA方法与RIDASCREEN SET Total试剂盒检测结果比对,一致率为92.5%。

表2 天津地区120份生鲜牛乳样本中肠毒素检测结果Table 2 Detection results of ES in 20 fresh milk samples by DAS ELISA

表3 天津地区110份猪淋巴组织样品中肠毒素检测结果Table 3 Detection results of ES in porcine lymphoid tissue samples by DAS-ELISA
3 讨 论
葡萄球菌肠毒素对食品安全和人类健康有严重影响,基因水平的研究表明多种新型SEs 的存在[7],建立应用于食品及临床样品中SEs的特异、敏感、快速、分型检测方法具有重要意义。由于不同SEs血清型间氨基酸序列高度同源性等因素[8],难以获得型特异性抗体用于检测,使得定性、定量以及分型检测成为研究难点[9]。
本研究所建立DAS-ELISA具有以下特点:检测体系选择了可识别SEA、SEO、SEQ、SEU、SEK、SEG等多种肠毒素的群特异性单克隆抗体分别作为包被与检测抗体,可用于多种SEs的检出;所选单抗特异性强、亲和力高、可夹心配对,避免了选择多抗中多组分复杂性引起的交叉反应、内源性过氧化物干扰、本底值偏高等问题,能满足复杂食品原料中肠毒素检测的要求;可实现SEA及多种新型肠毒素的定量检测,特异性、重复性、稳定性好,在0.312~10μg/mL范围内有良好的线性相关,该方法检测下限仅为0.307μg/mL,低于基于高效价多抗基础上的检测限为1ng/mL的ELISA方法[10-11]。且单抗强的特异性、低交叉反应、易于标准化等优点,更适合于检测试剂盒的研制,通过生物素(B)-亲和素(A)等生物放大系统可进一步提高检测灵敏度。
所建DAS-ELISA方法,可检测模拟食品环境的培养基质中天然SEs产生的变化情况,分析其分泌规律。对天津地区部分养殖条件较差的个体养殖场鲜牛乳样品及猪肉淋巴结组织中的SEs检测表明,奶、肉中存在较高的SEs检出率(阳性检出率分别为51.7%和59.1%),且相当数量阳性样品接近或超过中毒剂量。葡萄球菌是动物性食品原料保藏及加工等过程中极易污染的细菌,其产生的SEs具有超抗原活性容易导致机体的免疫紊乱,加之其耐高温高压等特性,使其安全风险倍增[12]。随着我国膳食结构的变化,动物性食品原料所占比例的提高,SEs中毒给食品安全带来新挑战。但目前国内除部分进口婴幼儿乳粉进行产SEs检测外,其他乳制品、肉制品加工及出售前仅进行葡萄球菌的检测。制订奶、肉等动物性食品中SEs的相关检测标准尚不完善,加强其控制及监管,将对防止食源性中毒的发生具有重要意义。
[1] NAOMI B, AVRAHAM R. Staphylococcal enterotoxins[J]. Int J Food Microbio, 2000, 61(1): 1-10.
[2] BUZBY J C, ROBERTS T. Economic costs and trade impacts of microbid foodbome illness[J]. Wor1d Health Statt Q, 1997, 50(24): 57-66.
[3] DINGES M M, ORWIN P M, SCHLIEVERT P M. Exotoxins of Staphylococcus aureus[J]. Clin Microbiol Rev, 2000, 13(1): 16-34.
[4] ELIZABETE R S, LUIZ S C, NIVALDO S. Detection of the enterotoxins A, B and C genes in Staphylococcus aureus from goat and bovine mastitis in Brazilian dairy herds[J]. Vet Microbiol, 2005, 106(1): 103-107.
[5] BEATTY J D, BEATTY B G, VLAHOS W G. Measurement of monoclonal antibody affinity by non-competitive enzyme immunoassay[J]. J Immunol Methods, 1987, 100(12): 173-179.
[6] CARUANAL J F, POIRIER B. Inactivated rabies vaccine control and release: use of an ELISA method[J]. Biologicals, 2003, 31(1): 9-16.
[7] SEBASTIAN G, VARMA A K, BEENU M, et al. A novel loop do main in superantigens extends their T cell receptor recognition site[J]. J Molecbiol, 2007, 371(3): 210-221.
[8] VAN R A, LYON J D, BOHACH G A. Molecular evolution of the staphylococcal and streptococcal pyrogenic toxin gene family[J]. Mol Phylogenet Evol, 1993, 2(4): 281-292.
[9] SHYU R H, TANG S S, CHIAO D J, et al. Gold nanoparticle-based lateral flow assay for detection of staphylococcal enterotoxin B[J]. Food Chemistry, 2009, 118(19): 462-466.
[10] 徐丹丹, 黄金海, 刘莹, 等. 葡萄球菌A型肠毒素检测竞争ELISA方法的建立[J]. 食品工业科技, 2010, 31(10): 380-382.
[11] MARK A P, VICTOR R R, DWAYNE N. Sensitive and specific colorimetric ELISAs for Staphylococcus aureus enterotoxins A and B in urine and buffer[J]. Toxicon, 2002, 40(12): 1723-1726.
[12] YVES L L, FLORENCE B, MICHEL G. Staphylococcus aureus and food poisoning[J]. Genet and Mol Res, 2003, 2(1): 63-76.
Development and Application of DAS-ELISA for Detection of Staphylococcal Enterotoxin
LIU Peng-chong1,HUANG Jin-hai1,*,LIU Li1,LIU Ying1,LIU Zhuang2,SUN Ying1
(1. School of Chemical Engineering and Technology, Tianjin University, Tianjin 300072, China;
2. Dairy Food Monitoring Center of Tianjin City, Tianjin 300381, China)
Staphylococcal enterotoxin (SE) is an important pathogenic factor for human food-borne diseases. Based on a couple of monoclonal antibodies with high sensitivity and affinity, a rapid, sensitive, specific DAS-ELISA method for the quantitative detection of SE was established. The linear regression equation was y=4.074x-1.1888 (R2=0.9892). The detection limit was 0.307 μg/mL. The average recovery rates for SE in skim milk powder were 103%-107% with relative standard deviation (RSD) of less than 10%. In addition, the method was also successfully used for monitoring the dynamic change of SE secretion in culture supernatants of Staphylococcus aureus isolates, indicating that it can be used not only for the detection of enterotoxin-producing strains but also for monitoring the secretion of SE. Moreover, the positive rates of the method for the detection of SE in fresh milk and porcine lymphoid samples were 51.7% and 59.1%, respectively. The total coincidence rate between the results obtained by the method and imported kit was 92.5%. Therefore, the method was sensitive and efficient and could provide an effective technical support for monitoring food-borne pollution.
Staphylococcus aureus;staphylococcal enterotoxin;double antibody sandwich enzyme-linked immunosorbent assay(DAS-ELISA);detection method
R378.11
A
1002-6630(2012)08-0195-04
2011-04-02
天津市应用基础及前沿技术研究计划项目(08JCZDJC22600)
刘鹏翀(1987—),女,硕士研究生,研究方向为食品生物技术。E-mail:lpc_liupengchong@126.com
*通信作者:黄金海(1970—),男,副教授,博士,研究方向为微生物工程。E-mail:jinhaih@163.com
