非水相介质酶法转化制备乙酸3-甲硫基丙醇酯工艺
2012-10-28张佳婵王成涛尹丽丽孙宝国
张佳婵,王成涛*,赵 磊,尹丽丽,孙宝国
(北京工商大学 食品添加剂与配料北京高校工程研究中心,北京市食品风味化学重点实验室,北京 100048)
非水相介质酶法转化制备乙酸3-甲硫基丙醇酯工艺
张佳婵,王成涛*,赵 磊,尹丽丽,孙宝国
(北京工商大学 食品添加剂与配料北京高校工程研究中心,北京市食品风味化学重点实验室,北京 100048)
研究脂肪酶催化合成天然乙酸3-甲硫基丙醇酯的关键因素及条件。结果表明:固定化脂肪酶Novozym 435是无溶剂体系和正己烷体系中最佳催化剂,加酶量、分子筛用量、乙酸加入次数、反应温度、反应时间等因素对乙酸3-甲硫基丙醇酯合成有重要影响。在无溶剂体系体系,加有1.06g 3-甲硫基丙醇、0.6g乙酸的反应中正交试验设计优化的条件为:加酶量50mg、分子筛加入量2g、反应温度42℃、反应总时间30h,乙酸分3次加入,间隔时间为2h,摇床转速为150r/min,乙酸3-甲硫基丙醇酯产率达42.4%。
3-甲硫基丙醇;乙酸3-甲硫基丙醇酯;脂肪酶Novozym 435;非水相转化;无溶剂体系
3-甲硫基丙醇、乙酸-3-甲硫基丙醇酯(ethyl-3-methyl-thiopropionate,EMTP)、甲酸3-甲硫基丙醇酯(methyl-3-methylthio- propionate,MMTP)天然存在于多种水果、酒中,是3种重要的含硫香料[1-2],是美国食用香料与提取物制造者协会公布的安全香料,其FEMA编号分别为3415、3883、2720。EMTP和MMTP具有浓烈的菠萝香气,是调配菠萝、柑橘、辣根、番茄、洋葱、猪肉、牛肉、鸡肉、巧克力等多种果味香精、肉味香精和酒用香精的常用香料[3],在烘烤食品、果酱、饮料、糖果、饮料、医药、日化等工业广阔应用[3]。
目前含硫类香料主要通过化学合成生产,如乙酸3-甲硫基丙醇酯生产以乙酸钠(或对甲苯磺酸)为催化剂,3-甲硫基丙醇与乙酸酐或酰氯进行酯化反应制得[4],或以甲醇钠为催化剂,苯为溶剂,通过甲硫醇与丙烯酸乙酯反应制备[5]。尽管化学合成法成本廉价,但存在诸如原料毒性高、合成过程污染大、有毒副产物难于完全去除等弊端[6-7]。
脂肪酶(Lipase,EC 3.1.1.3.)是一类特殊的酯键水解酶,脂肪酶不仅能催化甘油脂肪酸酯水解,还能催化酯类物质的合成。近年非水介质中脂肪酶催化合成生物柴油、酯类成为酶工程的重要研究热点和绿色化学主要技术之一[6,8]。非水相体系酶催化反应具有反应条件温和、增加有机底物的溶解性,改变反应的平衡方向,提高反应的立体选择性,抑制水参与的副反应,易于消除底物和产物的抑制作用等。生物转化制备的香料,其构型、手性单一,有助于香气品质的提高,是近年来天然香料制备的重要发展方向[9-12]。本实验以发酵3-甲硫基丙醇和冰醋酸为主要原料,以脂肪酶为催化剂,研究天然乙酸3-甲硫基丙醇酯的生物转化过程,优化其非水相条件,揭示其关键因素、反应规律。
1 材料与方法
1.1 试剂与仪器
乙酸3-甲硫基丙醇酯 国药化学试剂公司;正己烷、叔丁醇、正庚烷、丙酮(均为分析纯) 北京化学试剂公司;Novozym 435、Lipozyme TL 100L 、Greasex 200 MG、Lipopan 50 BG、NovoCor ADL、Lipozyme TL 1M、Lipex 100T 丹麦诺维信公司;3-甲硫基丙醇、乙酸(发酵法制得) 本课题组制。
LC-20A型高效液相色谱仪 岛津国际贸易有限公司;HQ45恒温摇床 中国科学院武汉科学仪器厂;DF-101S磁力搅拌器 巩义市予华仪器有限责任公司。
1.2 方法
1.2.1 液相色谱条件
ODS-SP色谱柱(4.6mm×150mm),二极管阵列检测器,流动相:甲醇-水(60:40,V/V),柱温为室温,进样量20μL。
1.2.2 3-甲硫基丙醇、乙酸3-甲硫基丙醇酯的液相色谱测定
标准曲线的绘制:配制系列乙酸3-甲硫基丙醇酯的甲醇溶液,液相色谱仪检测,绘制标准曲线。3-甲硫基丙醇和乙酸3-甲硫基丙醇酯在此条件下其保留时间分别为4.1、16.35min。
标准曲线:y=3×106x+475726,R2=0.9972(y为峰面积/μV;x为乙酸3-甲硫基丙醇酯质量浓度/(mg/mL))。
样品处理:取反应后的样品200μL,用甲醇稀释至10mL,过0.45μm微孔滤膜后进液相检测。
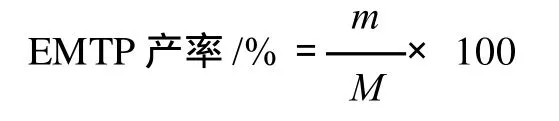
式中: m为反应结束后生成乙酸3-甲硫基丙醇酯的质量;M为理论生成乙酸3-甲硫基丙醇酯的质量。
1.2.3 脂肪酶筛选
溶剂体系:在25mL具塞三角瓶中加入3-甲硫基丙醇1.06g(0.01mol)、乙酸0.6g(0.01mol)和反应溶剂10mL(依次为正己烷、丙酮、正庚烷、叔丁醇),加入同等质量的脂肪酶,于45℃、150r/min、密封反应6h。所用脂肪酶为NovoCor ADL、Lipozyme TL 100L、Novozyme 435、Greasex 200 MG、Lipopan 50 BG、Lipozyme TL IM、Lipex 100T。液相色谱法测定乙酸3-甲硫基丙醇酯产率。
无溶剂体系:在25mL具塞三角瓶中加入3-甲硫基丙醇1.06g(0.01mol)和乙酸0.6g(0.01mol),加入同等质量的脂肪酶,于45℃、150r/min、密封反应6h。所用脂肪酶为NovoCor ADL、Lipozyme TL 100L、Novozyme 435、Greasex 200 MG、Lipopan 50 BG、Lipozyme TL IM、Lipex 100T。液相色谱法测定乙酸3-甲硫基丙醇酯产率。
1.2.4 溶剂筛选
在分别装有10mL正己烷、10mL丙酮、10mL正庚烷、10mL叔丁醇溶剂以及无溶剂的25mL具塞三角瓶中,加入3-甲硫基丙醇1.06g(0.01mol)、乙酸0.6g(0.01mol)和Novozym 435脂肪酶50mg。在45℃、摇床转速150r/min条件下密封反应6h。液相色谱法测定乙酸3-甲硫基丙醇酯产率。
1.2.5 各因素条件对乙酸3-甲硫基丙醇酯合成反应的影响
在无溶剂体系下、加有1.06g 3-甲硫基丙醇,0.6g乙酸的反应容器中,分别考察乙酸加入次数、反应温度、Novozym 435加酶量、分子筛用量、反应时间等因素对乙酸3-甲硫基丙醇酯产率的影响,反应物用液相色谱法测定。
2 结果与分析
2.1 脂肪酶的筛选
以发酵3-甲硫基丙醇、乙酸为主要原料,选择Novozym 435、Lipozyme TL等7种酶分别为催化剂,在无溶剂和有机溶剂体系的非水相条件下考察其乙酸3-甲硫基丙醇酯产率,其结果见图1、2。
图1、2结果表明,在考察的7种脂肪酶、2种反应体系中,固定化Novozym 435催化合成EMTP的产率最高为7%,Lipex 100T有较弱的催化能力,合成产率约为2%,其他脂肪酶的催化产率都很低;有机溶剂对脂肪酶的催化活性有重要影响,实验4种有机溶剂体系中,正己烷体系EMTP产率为最高,丙酮体系其产率为最低;采用无溶剂反应体系Novozym 435催化合成EMTP产率为7%,Lipex 100T在溶剂中未表现出催化活性。本实验采用无溶剂体系中固定化Novozym 435催化合成EMTP。
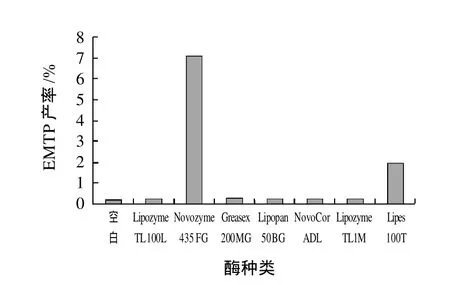
图1 无溶剂体系中不同脂肪酶对EMTP产率的影响Fig.1 Effect of lipase type on the yield of EMTP in solvent-free system
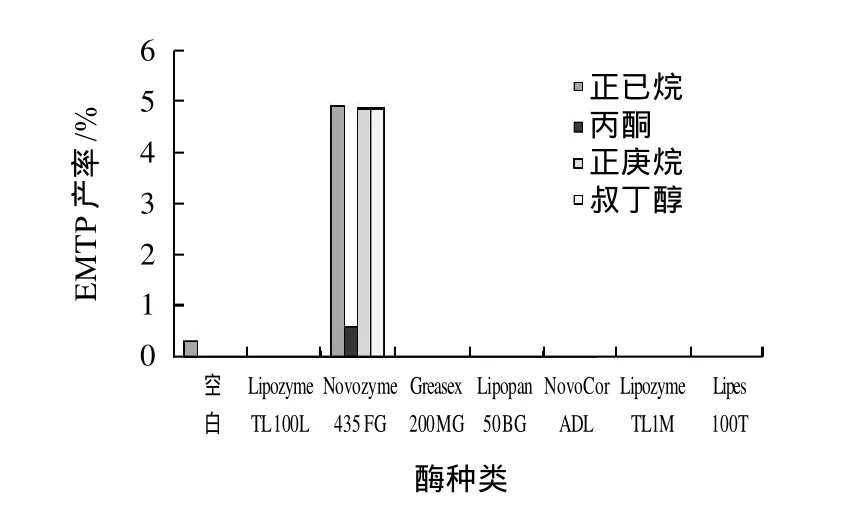
图2 有机溶剂体系中不同脂肪酶对EMTP产率的影响Fig. 2 Effect of lipase type on the yield of EMTP in organic solvent system
2.2 多种因素条件对乙酸3-甲硫基丙醇酯合成反应的影响
2.2.1 乙酸加入次数对乙酸3-甲硫基丙醇酯合成反应的影响
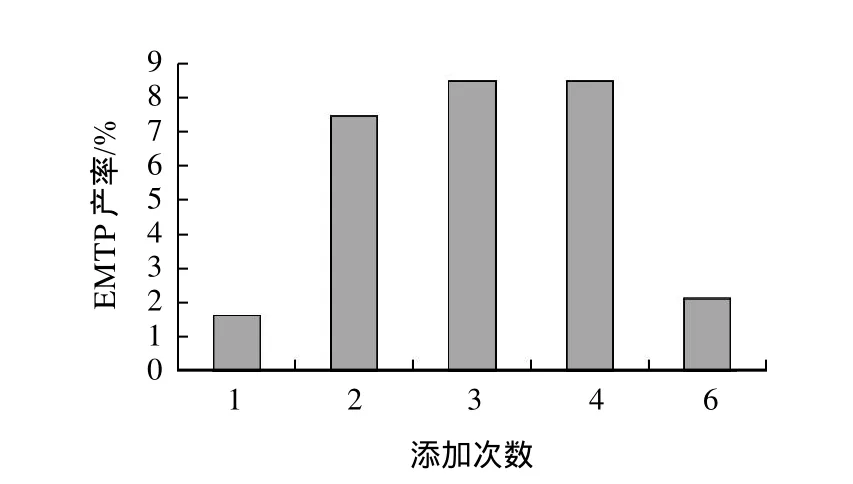
图3 乙酸加入次数对EMTP产率的影响Fig.3 Effect of times of acetic acid addition on the yield of EMTP in solvent-free system
图3结果表明,乙酸1次性加入,产物EMTP的产率很低;而将同等质量的乙酸分3~4次均匀加入时EMTP的产率较高,约为8.5%。说明乙酸添加次数对脂肪酶的催化活性和产物EMTP的产率有重要影响,其原因可能是乙酸影响了反应体系pH值及其微环境,在低pH值环境下脂肪酶的三维结构会发生改变,使酶的活性位点被“盖”起来,导致酶活性降低[11]。
2.2.2 反应温度对乙酸3-甲硫基丙醇酯合成反应的影响

图4 反应温度对EMTP产率的影响Fig.4 Effect of reaction temperature on the yield of EMTP in solvent-free system
温度对酶的催化活性及效率有重要影响,一般高温有利于酶促反应速度,但高温会降低酶的稳定性,进而降低酶的使用次数。图4表明,在反应温度30~50℃范围内,反应温度45~50℃时产物EMTP较高,产率为11%左右。
2.2.3 加酶量对乙酸3-甲硫基丙醇酯合成反应的影响
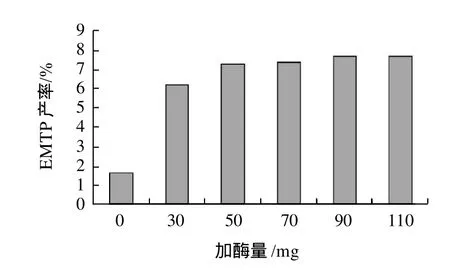
图5 固定化Novozym 435酶用量对EMTP产率影响Fig.5 Effect of Novozym 435 amount on the yield of EMTP in solvent-free system
图5显示,在1.2.5节条件下无溶剂反应体系中固定化Novozym 435加入50mg以上时,产物乙酸3-甲硫基丙醇酯产率达到较高,约为7%,继续增加脂肪酶用量其产率提高并不明显。
2.2.4 吸水剂分子筛用量对乙酸3-甲硫基丙醇酯合成反应的影响
已证实分子筛除具有吸水作用外不具有催化反应的能力,结果见图6。在无脂肪酶存在的情况下,是否添加分子筛对EMTP的产率没有影响,同时添加脂肪酶与分子筛后,EMTP产率较单纯添加脂肪酶的产率高。分子筛的添加量对反应效果的影响见图7,表明随着分子筛用量的增加,产物EMTP产率逐渐增高,当加入分子筛2g 时,其产物EMTP达到最高,产率约为28.8%。原因可能为,脂肪酶可同时催化酯类水解和酯类合成的可逆反应,3-甲硫基丙醇、乙酸为底物的酯类合成反应是一产生水的可逆反应,酯化反应和水解反应是同时进行,其方向决定于外界条件、环境,加入分子筛吸水剂,有利于酯化反应的进行,提高EMTP的转化率,因此分子筛吸水剂的添加量对非水相条件脂肪酶催化活性及转化率有重要影响。
研究[13-15]表明,脂肪酶表面水分子是维持其活性的重要因素,非水介质并非完全没有水,一般是指水分含量在0.01%以下的体系。如果完全没有水,将会导致酶构象的剧烈变化甚至失活;酶的催化活性靠着与之紧靠的一层左右的水分子来维持,如果这层水分子能够被限制在酶表面,其余水分足以用有机溶剂来替代,就不至于使酶催化能力降低或丧失。
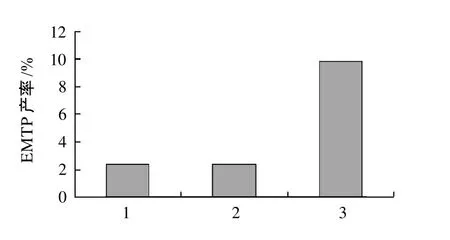
图6 分子筛吸水作用的研究Fig.6 Water-absorbing capacity of molecular sieve

图7 分子筛用量对乙酸3-甲硫基丙醇酯产率的影响Fig.7 Effect of molecular sieve amount on the yield of EMTP in solvent-free system
2.2.5 反应时间对乙酸3-甲硫基丙醇酯合成反应的影响
单因素试验显示固定化Novozym 435酶用量50mg、分子筛2g、45℃、乙酸分3~4次均匀加入是较好的反应条件,在此条件下研究无溶剂反应体系中反应时间对催化反应效果的影响,其结果见图8,当反应总时间为30h时产物EMTP产率较高约为37.6%。
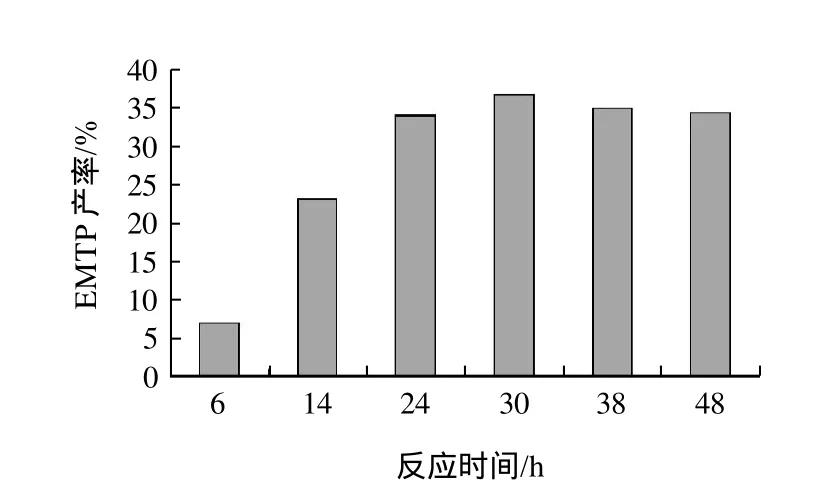
图8 反应时间对乙酸3-甲硫基丙醇酯产率的影响Fig.8 Effect of reaction time on the yield of EMTP in solvent-free system
2.3 正交试验设计优化乙酸3-甲硫基丙醇酯的转化条件
根据单因素试验结果,选取对非水相酶法转化EMTP影响较大的4个因素:酶加入量、分子筛加入量、反应温度、反应时间,采用L9(34)正交试验设计优化其转化条件,其结果见表1。 极差分析无溶剂系统中4种因素对乙酸3-甲硫基丙醇酯转化率影响主次顺序为:B>D>A>C,即反应时间>分子筛用量>反应温度>加酶量,最优水平为:A3B2C2D2,即反应温度42℃、反应时间30h、脂肪酶用量50mg、分子筛用量2g。
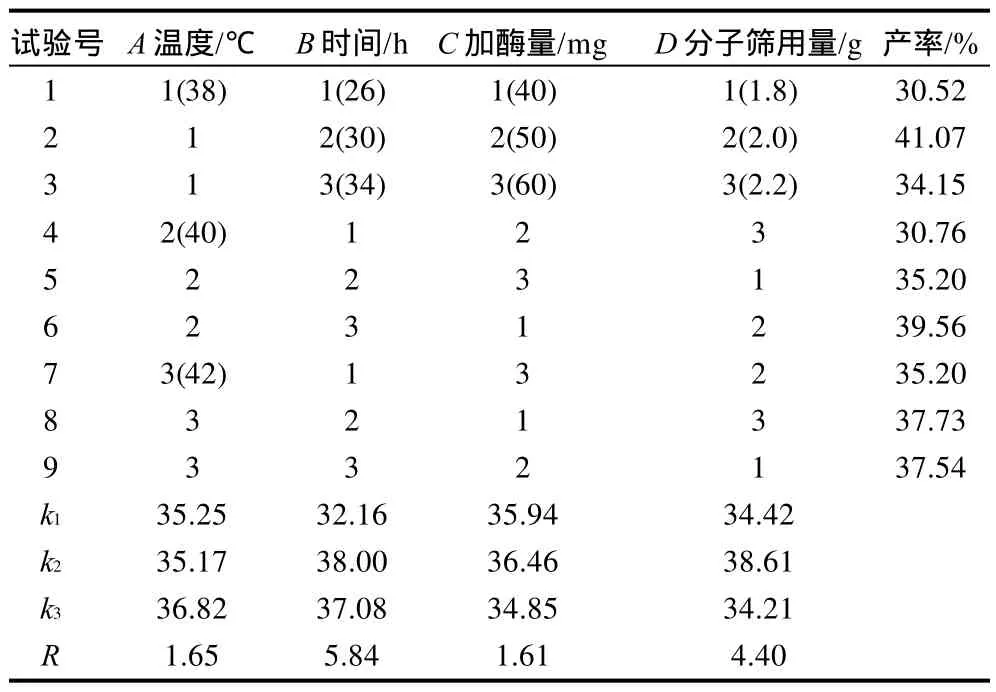
表1 乙酸3-甲硫基丙醇酯转化条件优化正交试验设计与结果Table 1 Orthgonal array experimental results and analysis
2.4 验证实验
在2.3节最优条件下,进行3组平行验证实验,3组实验结果无明显差异,EMTP产率达到42.4%,表明正交试验优化的工艺条件可行。
3 结 论
在无溶剂体系中固定化脂肪酶Novozym435为最佳催化剂,酶用量、分子筛用量、乙酸加入次数、反应温度、反应时间为对EMTP合成反应产率和酶活力有重要影响的因素。无溶剂条件下正交试验设计优化后的条件为3-甲硫基丙醇1.06g(0.01mol)、乙酸0.6g(0.01mol)。体系加酶量50mg、分子筛加入量2g、反应温度42℃,乙酸分3次加入,间隔时间为2h,摇床转速150r/min,反应总时间30h,在此条件下其乙酸3-甲硫基丙醇酯产率达到42.4%。
[1] 孙宝国. 食品添加剂[M]. 北京: 化学工业出版社, 2008: 59-85.
[2] 孙宝国, 何坚. 香料化学与工艺学[M]. 北京: 化学工业出版社, 2004:1-125.
[3] 孙宝国. 食用调香术[M]. 北京: 化学工业出版社, 2003: 50-99.
[4] 刘玉平, 孙宝国, 郑福平. 食用香料乙酸3-甲硫基丙醇酯的合成研究[J]. 食品添加剂, 2005, 26(2): 15-160.
[5] LIU Yuping, CHEN Haitao, YIN Decai, et al. Synthesis and odor evaluation of five new sulfur- containing ester flavor compounds from 4-ethyloctanoic acid[J]. Molecules, 2010, 15(8): 5104-5111.
[6] BOMMARUS A S, POLIZZI K M. Novel biocatalysts: recent developments[J]. Chemical Engineering Science, 2006, 61(3): 1004-1016.
[7] MOSCIANO G, FASANO M. Organoleptic characteristics of flavor materials[J], Perfumer & Flavorist, 1995, 20(1): 31-33.
[8] GOLDBERG K, SCHROER K, LTZ S, et al. Biocatalytic ketonereduction: a powerful tool for the production of chiral alcohols:part Ⅰ: processes with isolated enzymes[J]. Applied Microbiology &Biotechnology, 2007, 76(2): 237-248.
[9] WOODLEY J M. New opportunities for biocatalysis:makingpharmaceutical processes greener[J]. Trends in Biotechnology,2008, 26(6): 321-327.
[10] PHILIPPE P, OLIVER D. Methionine catabolism in Saccharomyces cerevisiae[J]. FEMS Yeast Research, 2006, 6(1): 48-56.
[11] YADAV G D, TRIVEDI A H. Kinetic modeling of immobilized-lipase catalyzed transesterificatin of n-octanol with vinyl acetate in nonaqueous media[J]. Enzyme and Microbiology Technology. 2003, 32(7): 783-789.[12] ETSCHMANN M M W, KTTER P, HAUF J. Production of the aroma chemicals 3-(methylthio)-1-propanol and 3-(methylthio)-propylacetate with yeasts[J]. Applied Microbiology & Biotechnology,2008, 80(4): 579-587.
[13] 张东浩. 脂肪酶催化吡哆醇区域选择性酯化及其酶学特性研究[D].天津: 天津大学, 2007.
[14] 张娜, 刘均洪. 酶在接近无水有机介质中的生物催化特性[J]. 工业催化, 2005, 13(7): 48-51.
[15] CARLQVIST P, SVEDENDAHL M, BRANNEBY C, et al. Exploring the active-site of a rationallyredesigned lipase for catalysis of michaeltype additions[J]. Chembio Chem, 2005, 6(2): 331-336.
Lipase-Catalyzed Conversion in Non-aqueous Media for the Preparation of Ethyl-3-methyl-thiopropionate
ZHANG Jia-chan,WANG Cheng-tao*,ZHAO Lei,YIN Li-li,SUN Bao-guo
(Beijing Higher Institution Engineering Research Center of Food Additives and Ingredients, Beijing Key Laboratory of Flavor Chemistry,Beijing Technology and Business University, Beijing 100048, China)
Ethyl-3-methyl-thiopropionate (EMTP) is an important kind of spice. The key factors and conditions for biocatalytic synthesis of EMTP in non-aqueous system were studied in the paper. The results indicated that the best catalyst in solvent-free medium or normal hexane was Novozym 435. Catalyst dosage, the amount of molecular sieve addition, the number of acetic acid addition, reaction temperature and reaction time were important factors for EMTP synthesis. The optimal preparation conditions, as determined using orthogonal array design method, were 50 mg of Novozym 435, 2 g of molecular sieve, 42 ℃ of reaction temperature, 30 h of reaction time, three times of acetic acid addition with an interval of 2 h, and 150 r/min of shaking speed. The yield of EMTP reached up to 42.4% in solvent-free medium under the optimal conditions.
3-(methylthio)-propane;ethyl-3-methyl-thiopropionate;Novozym 435;conversion in non-aqueous media;solvent-free system
TS202.3
A
1002-6630(2012)08-0001-05
2011-07-28
国家自然科学基金面上项目(31071593);北京市教委科技面上项目(KM201110011001);北京市属高等学校人才强教计划项目(PHR201008237)
张佳婵(1987—),女,硕士研究生,研究方向为食品生物技术。E-mail:xiaochan8787@163.com
*通信作者:王成涛(1969—),男,教授,博士,研究方向为食品生物技术。E-mail:wct5566@163.com
