响应面分析法优化回流提取岷江柏总黄酮工艺
2012-10-27王文兰王晓玲
王文兰,杨 梅,严 平,王晓玲*
(西南民族大学少数民族药物研究所,四川 成都 610041)
响应面分析法优化回流提取岷江柏总黄酮工艺
王文兰,杨 梅,严 平,王晓玲*
(西南民族大学少数民族药物研究所,四川 成都 610041)
目的:优化岷江柏总黄酮的回流提取工艺。方法:在单因素试验的基础上,采用响应面分析法,以总黄酮提取率为响应值,通过回归分析各工艺参数与响应值之间的关系,优化岷江柏总黄酮最佳提取工艺条件。结果:最佳工艺条件为回流温度90℃、乙醇体积分数70%、浸泡时间37min,其他条件为回流时间70min、液料比40:1(mL/g)、提取次数3次,在最佳工艺条件下提取率可达7.211%。结论:响应面分析法优化回流提取总黄酮的预测准确、方便,所得的最佳提取工艺高效、可行。
响应面法;岷江柏;总黄酮;回流提取
岷江柏(Cupressus chengjanaS.Y.Hu)为柏科柏木属常绿乔木,分布于四川岷江流域的汶川、理县、大渡河流域的马尔康等地[1],主要用于园林装饰,其叶中较多的挥发油用作香精的原料。柏科植物根、茎、叶、枝均可入药,具有重要的经济和药用价值,其主要化学成分为挥发油、黄酮类、生物碱类、酚酸类、有机酸等[2-10]。本课题组通过预实验对岷江柏化学成分进行定性分析,发现其含有大量黄酮类成分,后经系统分离,得到化合物槲皮苷[11]。该属植物中的总黄酮成分具有高效低毒的优势,具有多种生物活性如抗肿瘤、抗氧化、止血、镇咳祛痰、抑制核苷运转、调节内分泌和神经等,广泛用于医药、食品等行业,具有广泛的开发应用前景[12-18]。
目前尚未有关于岷江柏总黄酮提取工艺研究的报道,为进一步研究开发该植物,本研究在单因素试验的基础上,采用响应面分析法系统优化其提取工艺,为促进该植物的有效开发利用和进一步研究提供理论依据。
1 材料与方法
1.1 材料与试剂
岷江柏植物药材2009年8月采集于四川小金县,经西南民族大学刘园教授鉴定为柏科柏木属植物岷江柏(Cupressus chengjanaS.Y.Hu)。槲皮苷由本实验室制备,其结构经质谱、紫外、红外、核磁共振谱等波谱进行表征,纯度大于99.5%;其余试剂均为国产分析纯;实验用水均为蒸馏水。
1.2 仪器与设备
UV-1901紫外分光光度计 北京普析通用仪器公司;AE 240型电子天平 瑞士Mettler Toledo公司;Senconw 201-恒温水浴锅 上海申生科技公司。
1.3 方法
1.3.1 总黄酮的提取工艺流程
岷江柏枝叶→50℃烘干→粉碎→乙醇溶液浸泡→回流提取→抽滤→滤液浓缩→岷江柏总黄酮提取物
1.3.2 标准曲线的制作
精密称取真空干燥至质量恒定的槲皮苷标准品35.0mg,置100mL容量瓶中,用无水乙醇溶解,定容至刻度,配制成质量浓度0.35mg/mL的对照品溶液。分别精密量取0.0、2.0、3.0、4.0、5.0、6.0mL的槲皮苷标准品溶液(0.35mg/mL),置于50mL容量瓶中,加入无水乙醇9mL,振摇溶解,静置5min;再加入5% NaNO2溶液5mL,振摇,静置6min,加入10% Al(NO3)3溶液5mL,振摇,静置6min,最后加入5% NaOH溶液20mL,振荡摇匀,静置15min。用无水乙醇定容至刻度。以没加入槲皮苷且按照上述相同显色方法配制的乙醇溶液为空白溶液。在500nm波长处测定吸光度A,以A(y)为横坐标、槲皮苷的含量(x,mg/mL)为纵坐标作线性回归,得标准曲线:y=12.923x-0.0048,r=0.9994。结果表明槲皮苷质量浓度在0.017~0.040mg/mL之间线性关系良好,满足含量测定要求。
1.3.3 岷江柏总黄酮的提取率测定
精密称取岷江柏干粉1.000g置于50mL圆底烧瓶中,加入一定液料比、一定体积分数乙醇,使药材浸泡一定时间后,在一定温度下回流一定时间,一定提取次数,过滤,合并滤液,浓缩,无水乙醇定容至100mL容量瓶,精密吸取5.00mL提取液,按照1.3.2节方法进行显色并测定吸光度,根据标准曲线计算出总黄酮的质量,计算总黄酮提取率。
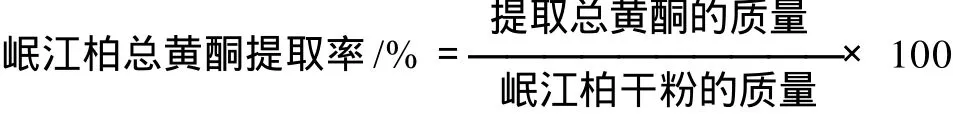
1.3.4 岷江柏总黄酮提取工艺优化
1.3.4.1 单因素试验
准确称取岷江柏干粉1.000g置于50mL圆底烧瓶中,在其他条件相同的情况下,采用不同液料比、乙醇体积分数、浸泡时间、回流温度、回流时间、提取次数进行回流提取,以总黄酮提取率为响应值,考察各单因素对提取效果的影响。
1.3.4.2 响应面试验
根据单因素试验结果,选取影响总黄酮提取率显著的回流温度、乙醇体积分数、浸泡时间3个因素为考察对象,以总黄酮提取率为响应值,通过Design-Expert 7.1.6软件,采用Box-Behnken设计试验对3个主要影响因素进行优化,建立回归模型,确定最佳提取工艺,因素水平设计见表1。
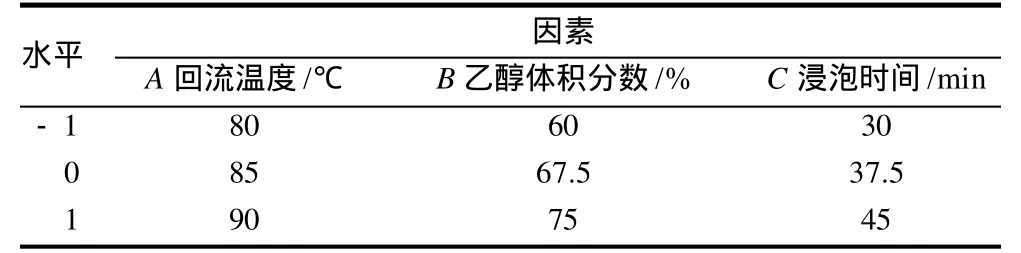
表1 岷江柏总黄酮提取响应面试验因素水平表Table 1 Coded values and corresponding actual values of the optimization parameters used in response surface analysis
2 结果与分析
2.1 单因素试验结果及分析
2.1.1 液料比对总黄酮提取的影响
精密称取岷江柏干粉1.000g,用60%乙醇浸泡45min后,回流温度80℃,回流70min,提取3次,液料比分别为10:1、20:1、30:1、40:1、50:1(mL/g)五个水平,测定总黄酮提取率。
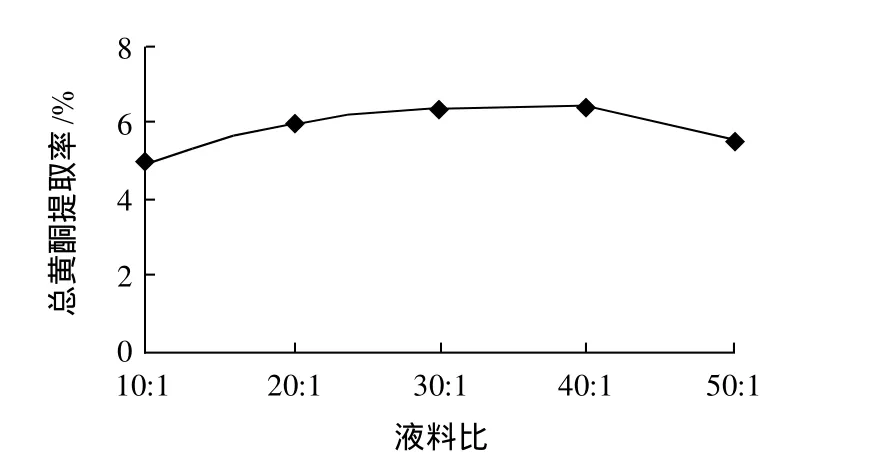
图1 液料比对总黄酮提取率的影响Fig.1 Effect of liquid-to-material ratio on extraction rate of total flavonoids
图1显示,当液料比小于40:1时,随着液料比的增大提取率呈上升趋势,并且在液料比40:1时,其提取率达到最大,但是随着液料比的增大提取率反而呈下降趋势。其原因在于液料比影响溶剂的极性,从而影响不同极性黄酮类的溶解性;当液料比增大时,乙醇中提取出的总黄酮浓度相对较小,传质阻力较小,利于原药中黄酮类化合物的溶出,但是液料比太大,在较长的后续处理加热过程中对热不稳定的黄酮可能被氧化分解等,从而提取率降低。因此液料比选择在40:1左右为宜,在响应面试验中不做考察。
2.1.2 乙醇体积分数对总黄酮提取的影响
精密称取岷江柏干粉1.000g,固定液料比40:1,用一定体积分数乙醇浸泡45min,回流温度80℃,回流70min,提取3次,乙醇体积分数分别为45%、60%、75%、80%、95%,测定总黄酮提取率。
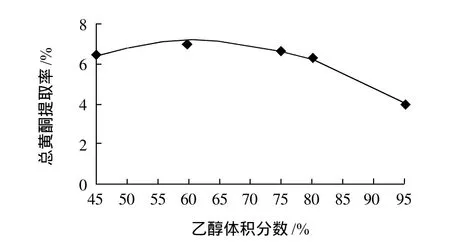
图2 乙醇体积分数对提取率的影响Fig.2 Effect of ethanol concentration on extraction rate of total flavonoids
由图2可知,随着乙醇体积分数增加,岷江柏总黄酮提取率逐步上升,其原因可能是在水中溶解度小的黄酮,比如:槲皮苷,柏黄酮等在醇中溶解度大;当乙醇体积分数增大到60%时,提取率最大,此时醇溶性黄酮基本提取完毕,达到动态平衡;当乙醇体积分数增加到75%以后,提取率反而下降,其原因可能是岷江柏总黄酮中水溶性黄酮较多,所以醇浓度增加,水含量减少,使得水溶性黄酮的提取率下降。因此乙醇体积分数考察范围在60%~75%之间为宜。
2.1.3 浸泡时间对总黄酮提取的影响
精密称取岷江柏干粉1.000g,固定液料比40:1,用60%乙醇浸泡一定时间,回流温度80℃,回流70min,提取3次,分别浸泡15、30、45、60、75min,测定总黄酮提取率。

图3 浸泡时间对提取率的影响Fig.3 Effect of soaking time on extraction rate of total flavonoids
由图3可知,随着浸泡时间的延长,岷江柏中总黄酮的提取率增加,在30~45min区间内总黄酮提取率较高,但超过45min以后,总黄酮的增加量减少,可能是浸泡时间增加,浸泡出大量杂质,从而影响总黄酮的含量。因此浸泡时间选在30~45min为宜。
2.1.4 回流温度对总黄酮提取的影响
精密称取岷江柏干粉1.000g,固定液料比40:1,用60%乙醇浸泡45min后,回流70min,提取3次,回流温度分别用60、70、80、90、100℃五个水平,测定总黄酮提取率。

图4 回流温度对提取率的影响Fig.4 Effect of reflux temperature on extraction rate of total flavonoids
由图4可知,当回流温度在60~80℃时,岷江柏中总黄酮的提取率增加,当温度继续增加到90~100℃时,其总黄酮的提取率反而降低。其原因可能是总黄酮在一定适宜的温度下提取率增加,当过大的温度会促使一些醇溶性杂质、色素、亲脂性强的成分溶出量增加,与黄酮类化合物竞争和乙醇、水结合,从而导致黄酮类化合物提取率下降,影响总黄酮的提取率。因此回流温度取80~90℃为宜。
2.1.5 回流时间对总黄酮提取的影响
精密称取岷江柏干粉1.000g,固定液料比40:1,用60%乙醇浸泡45min后,回流温度80℃,回流提取3次,回流时间分别为30、50、70、90、110min,测定总黄酮提取率。
图5 回流时间对提取率的影响Fig.5 Effect of reflux time on extraction rate of total flavonoids
由图5可知,总黄酮提取率随着回流时间的延长而不断增加,但在70min过后,随着时间的延长,其提取率稍有下降。其原因在于:由于提取包括扩散、渗透和溶解等过程,时间延长有助于黄酮类化合物的溶出,从而提取率上升,故提取时间越长,提取越完全,70min以后黄酮提取基本完全,随着时间的延长黄酮提取率变化不大。
2.1.6 提取次数对总黄酮提取的影响
精密称取岷江柏干粉1.000g,固定液料比40:1,用60%乙醇浸泡45min后,回流温度80℃,回流7 0 mi n,分别提取1、2、3、4、5次,测定总黄酮提取率。

图6 提取次数对提取率的影响Fig.6 Effect of repeated extraction number on extraction rate of total flavonoids
由图6可知,随着提取次数的增加,岷江柏中总黄酮的提取率增加,提取次数越多总黄酮的提取率越高,但超过3次以后,总黄酮的增加量减少。因此提取次数选在3次为宜,在响应面试验中不做考察。
2.2 响应面试验设计
表2 岷江柏总黄酮提取工艺响应面试验设计及结果Table 2 Experimental design and results for response surface analysis
Box-Behnken试验设计及结果表2,利用Design-Expert 7.1.6对表2数据(响应值)进行多元回归拟合及对模型进行方差分析,结果见表3。各因素经二次多项回归拟合后,得到岷江柏总黄酮提取率对回流温度、乙醇体积分数、浸泡时间3个因素的二次多项回归方程:0

表3 回归方程各项方差分析Table 3 Analysis of variance for each term of the fitted regression equation
经方差分析得到:模型的F值为11.30、P值为0.0021<0.05,说明本实验所采用的二次模型是显著的。PA、均小于0.01,达到极显著水平,但乙醇体积分数、浸泡时间及其二次项、相互项都不显著,说明各因素间的交互作用很小。决定因素R2为0.9356,也说明模型能够很好的反应响应值的变化,拟合度好。由方差分析结果可知,回流温度、乙醇体积分数、浸泡时间3个因素在试验过程中均起主要作用,对总黄酮提取率的影响顺序为回流温度>乙醇体积分数>浸泡时间。
2.3 响应面分析

图7 各两因素交互作用对岷江柏总黄酮提取率影响的响应面与等高线图Fig.7 Response surface and contour plots for the effects of three variables on extraction rate of total flavonoids
由图7可知,回流温度是影响总黄酮提取率的最主要因素,乙醇体积分数次之,选择合适的回流温度和乙醇体积分数,可获得较高的提取率。由图7a可以看出,当回流温度不变时,总黄酮提取率随着乙醇体积分数的升高而先增加后降低,并在0水平左右达到最大值;而当乙醇体积分数不变时,总黄酮提取率随着回流温度的升高而升高;由图7b可以看出,当回流温度不变时,总黄酮提取率随着浸泡时间的延长而先升高后降低,曲面趋于平缓;当浸泡时间不变时,总黄酮提取率随着回流温度的升高而升高。由图7c可以看出,乙醇体积分数不变时,总黄酮提取率随着浸泡时间的延长呈现先升高后降低的趋势,并在0水平左右达到最大值;当浸泡时间不变时,总总黄酮提取率随着乙醇体积分数的升高也呈现先升高后降低的趋势,并由图分析得到,在乙醇体积分数和浸泡时间均达到0水平附近总总黄酮提取率可达到最大值。
通过最优化分析,最佳的提取条件为回流温度90℃、乙醇体积分数69.34%、浸泡时间36.91min、回流时间70min、液料比40:1、提取次数3次,预测提取率为7.229%,但考虑到实际操作的局限性,将提取工艺修正为回流温度90℃、乙醇体积分数70%、浸泡时间37min、回流时间70min、液料比40:1、提取次数3次,在此条件下,验证实验得到总黄酮的提取率为7.211%,与预测值基本相符,证实了该方程的准确性和实用性。
3 结 论
采用回流方法对岷江柏总黄酮进行提取,通过单因素试验和Box-Behnken试验设计以及响应面分析法对岷江柏总黄酮的提取工艺条件进行优化,通过回归分析建立相关性良好的方程,得到最佳的提取工艺为回流温度90℃、乙醇体积分数70%、浸泡时间37min、回流时间70min、液料比40:1、提取次数3次,并在此条件下总黄酮提取率为7.211%。得到的岷江柏总黄酮提取率与各影响因素变量的二次方程模型,该模型回归极显著,对试验拟合较好。
[1] 袁志忠, 包维楷, 何丙辉. 川西地区岷江柏种群生命表与生存分析[J]. 云南植物研究, 2004, 26(4): 373-381.
[2] 江玉师, 覃模昌, 代培云. 岷江柏叶精油化学成分的研究[J]. 四川林业科技, 1997, 11(1): 49-53.
[3] 李智立, 刘淑莹. 侧柏果实挥发油化学成分的研究[J]. 中国药学杂志, 1997, 32(3): 138-139.
[4] 郝德君, 张永慧, 戴华国, 等. 气相色谱/质谱法分析柏树叶挥发油的化学成分色谱[J]. 色谱, 2006(3): 185-187.
[5] 赵军, 闫明, 黄毅, 等. 新疆园柏黄酮类成分的研究[J]. 林产化学与工业, 2008(2): 33-37.
[6] HYUN S, WON K O, BO Y, et al. Inhibition of phospholipase C gamma l activity by amentoflavone isolated fromSelaginella tamariscina[J]. Planta Med, 1996, 62(4): 293-296.
[7] LIN R C, SEGUIN E, TILLEQUIN F, et al. New alkaloid glycosides fromSelaginella doederleinii[J]. J Nat Prod, 1987, 50(3): 422-426.
[8] LIN R C, SEGUIN E, SKALTSOUNIS A L, et al. Synthesis of the Glycoalkaloids ofSelaginella doederleiniiand structure revision of one of them[J]. J Nat Prod, 1990, 53(4): 882-893.
[9] 崔秀君, 程立万, 刘青. 侧柏叶中活性成分异海松酸的分离、鉴定与高效液相色谱定量[J]. 时珍国医国药, 2004, 15(2): 78-79.
[10] 赵宇新. 北美西部圆柏叶中2个新的酚苷类成分[M]. 国外医学: 中医中药分册, 2004, 26(1): 56.
[11] 刘海请, 林瑞超, 冯芳. 旱生卷柏化学成分的研究(Ⅱ)[J]. 中草药, 2004, 35(1): 14-15.
[12] 王文蜀, 李二伟, 贾忠建, 等. 祁连圆柏中一种新的抗癌活性二萜[J].兰州大学学报: 自然科学版, 2002, 38(6): 121-122.
[13] 蒋继宏, 李晓储, 高甜惠, 等. 几种柏科植物挥发物质及抗肿瘤活性初步研究[J]. 福建林业科技, 2006, 33(2): 52-57.
[14] 于建东, 胡军影, 程显隆, 等. 卷柏属植物化学成分及药理研究进展[J]. 中国药事, 2007, 21(9): 763-767.
[15] LIN L C, KUO Y C, CHOU C J. Cytotocix biflavonoids fromSleaginella delicatula[J]. J Nat Prod, 2000, 63(5): 627-630.
[16] 丁航, 刘慧明, 梁统, 等. 侧柏叶中黄酮类化合物对H2O2诱导的人红细胞氧化作用的影响[J]. 实用临床医学, 2003, 4(3): 23-24.
[17] 华满堂. 新疆园柏治疗鼻出血[J]. 新疆中医药, 1998, 16(4): 16-17.
[18] 晃志, 程彰华. 卷柏的止血作用[J]. 中草药, 1997, 28(6): 351-353.
Optimization of Reflux Extraction Process for Total Flavonoids fromCupressus chengjanaS. Y. Hu by Response Surface Methodology
WANG Wen-lan,YANG Mei,YAN Ping,WANG Xiao-ling*
(Ethnic Pharmaceutical Institute, Southwest University for Nationalities, Chengdu 610041, China)
Objective: To optimize the reflux extraction of total flavonoids from leaves and stems ofCupressus chengjanaS. Y. Hu. Methods: One-factor-at-a-time design and response surface methodology (RSM) were used to determine optimal conditions for the extraction of total flavonoids through regression analysis of the relationship between the extraction efficiency of total flavonoids and various process parameters. Results: The optimal extraction process was soaking for 37 min in 70% ethanol solution at a solid-to-solvent ration of 1:40 (g/mL) followed by reflux extraction repeated 3 times for 70 min each time, resulting in an extraction efficiency of 7.211%. Conclusion: Response surface methodology can provide an accurate and convenient way to predict the reflux extraction of total flavonoids to obtain optimal process with high effectiveness and applicability.
response surface methodology (RSM);Cupressus chengjanaS. Y. Hu;total flavonoids;reflux extraction
TQ461
A
1002-6630(2012)18-0057-06
2011-07-11
西南民族大学中央高校基本科研业务费项目(11NFW02);西南民族大学2012年研究生学位点建设项目(2012XWD-S0703)
王文兰(1988—),女,硕士研究生,研究方向为天然药物化学。E-mail:ningxiatongxin@126.com
*通信作者:王晓玲(1969—),女,教授,博士,研究方向为天然药物化学。E-mail:wxl3232@sina.com
